Катализ - Химическая кинетика, равновесия, термодинамика
К изложенному в учебнике необходимо несколько уточнений и добавлений.
Во-первых, реакция в присутствии катализатора идет не в одну стадию, а минимум в две, как показано ниже на рис. 1 - энергетической диаграмме реакции (в новом издании [2] это учтено). Здесь А и М - условные обозначения исходных веществ и конечных продуктов, а АК - условное обозначение промежуточного продукта с участием катализатора. Соответственно, есть минимум два переходных состояния, ПС1 и ПС2 (а ПС0 - это переходное состояние без катализатора). В случае системы последовательных реакций энергия активации получения конечного продукта определяется самым высоким из промежуточных потенциальных барьеров. В примере на рисунке это ПС1, но в общем случае это не обязательно барьер первой стадии.
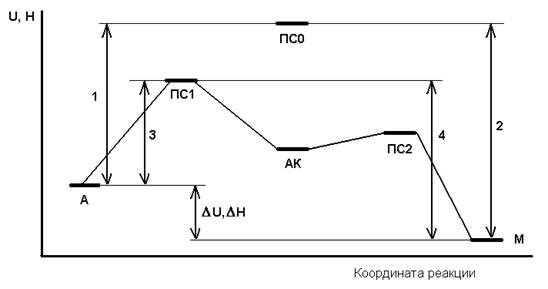
Рис. 1. Энергетическая схема реакции А > М без катализатора и с катализатором К
На рис. 1 отрезки 1 и 2 - это энергии активации прямой и обратной реакции без катализатора, 3 и 4 - то же с катализатором, ДU или ДH - тепловой эффект реакции, выраженный, как изменение внутренней энергии U или энтальпии H. В любом случае Еа(прямой) - Еа(обратной) = ДU или ДH. На данной схеме реакция экзотермическая (ДU, ДH < 0), но это не обязательно.
Принципиально важно, что введение катализатора в любом случае снижает энергию активации и прямой, и обратной реакции на одинаковую величину, и поэтому увеличивает скорость и прямой, и обратной реакции в одинаковое число раз, так что соотношение скоростей в каждый момент остается неизменным. В частности, в состоянии равновесия, когда скорость прямой реакции равна скорости обратной, введение катализатора не нарушает этого состояния. Катализатор не смещает равновесие, а лишь ускоряет его достижение.
Во-вторых, важно то, что многие катализаторы действуют избирательно, т. е. ускоряют только одну из нескольких возможных параллельных реакций, причем не всегда самую термодинамически выгодную. Таким образом, правильный подбор катализатора позволяет направлять процессы по желаемому пути.
В третьих, неверно называть ингибиторы - вещества, замедляющие реакцию - отрицательными катализаторами. Если энергия активации процесса с участием ингибитора выше, чем без него, реакция просто не пойдет по этому пути, ее механизм и кинетика останутся прежними. Если же ингибитор препятствует протеканию реакции, значит, он связывается с реагентами или промежуточными продуктами, т. е. расходуется, и это противоречит определению катализатора. Например, ингибиторы цепных реакций окисления масел - это добавки, связывающие свободные радикалы; ингибиторы коррозии металлов - это вещества, связывающиеся с поверхностью металла и затрудняющие доступ агрессивной среды.
Наконец, есть особый случай каталитических реакций - автокатализ, когда катализатором является продукт реакции. Если обычные реакции (каталитические или без катализатора) быстрее всего идут в начальный момент, а потом замедляются, т. к. расходуются реагенты, то автокаталитические реакции идут с самоускорением. В начальный момент, пока катализатор еще не образовался, реакция идет медленно. По мере ее протекания накапливается катализатор, и реакция ускоряется. Но по мере расходования реагентов реакция неизбежно в конце концов замедлится и прекратится. Следовательно, скорость автокаталитической реакции в функции времени проходит через максимум, а график зависимости концентраций (или количеств) реагентов и продуктов от времени имеет точку перегиба в соответствующий момент (рис. 2).
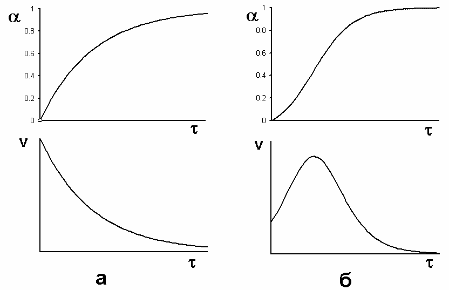
Рис. 2. Так изменяются в функции времени степень превращения б = - ДC/C0 и скорость реакции v = dб/dф в случае реакции без катализатора или с заранее введенным катализатором (а) и в случае автокатализа (б)
В обоих случаях графики соответствуют реакциям первого порядка.
Примеры автокаталитических реакций:
- растворение меди (или серебра) в растворе азотной кислоты (катализатор - оксид азота):
Cu + 4H+ + 2NO3- > Cu2+ + NO2 +2H2O;
- - окисление щавелевой кислоты в кислой среде перманганатом калия (катализатор - катион марганца):
- 5H2C2O4 + 2MnO4- + 6H+ > 10CO2 + 8H2O + 2Mn2+.
Ввиду ограниченного числа лабораторных занятий, практикум по катализу заменяется лекционными демонстрациями. Оба опыта (а) и (б) ниже основаны на разложении пероксида водорода Н2О2 в водном растворе. Это соединение способно практически необратимо разлагаться на воду и кислород: Н2О2 > Н2О + 0,5О2. В самом деле, мы постоянно имеем кислород в контакте с водой, но пероксид из них не образуется. Правда, и Н2О2 может храниться довольно долго из-за высокого потенциального барьера реакции, но на свету, при нагревании, или в присутствии катализатора разложение происходит быстро. Различие в скоростях наглядно без всяких измерений, по выделению пузырьков газа.
- (а) Гетерогенный катализ под влиянием крупинки MnO2. То, что это катализатор, а не реагент, доказывается тем, что крупинка в ходе реакции не исчезает, а объем выделившегося кислорода гораздо больше того, который содержится в твердом оксиде. Например, если предположить, что MnO2 отдает половину содержащегося в нем кислорода, переходя в MnO, то из одного миллиграмма оксида могло бы получиться лишь около 0,1 мл кислорода. А реально выделяются десятки и сотни миллилитров, в зависимости от количества взятого пероксида. Однако в этом опыте не видно признаков того, что катализатор вступает в промежуточные реакции. Поэтому делаем следующий опыт. (б) Гомогенный катализ под влиянием раствора бихромата калия K2Cr2O7. Этот катализатор не столь активен, поэтому для ускорения процесса используем нагревание в стакане с горячей водой. Но чтобы показать эффект катализа, надо обязательно нагревать и такой же раствор пероксида без катализатора. В данном случае по изменению окраски сразу понятно, что бихромат вступает в реакцию. Чтобы доказать, что он не реагент, а катализатор, нужно обязательно дождаться окончания реакции, когда возвращается исходный цвет бихромата.
В этих опытах может также наблюдаться самоускорение реакции, но не от автокатализа, а от саморазогрева. Мы обсуждаем скорости при одинаковой температуре, а реакция экзотермическая, и если теплота не успевает рассеиваться в окружающую среду, то температура повышается, и это дает дополнительное ускорение.
Похожие статьи
-
(а) Зависят ли энергия активации и предэкспоненциальный множитель от природы реагентов? от их концентраций? от температуры? от присутствия посторонних...
-
(а) На основе уравнения ЗДМ объясните физический смысл константы скорости. (б) Зависит ли константа скорости от концентраций реагентов? от их природы? от...
-
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1: 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите...
-
Катализ - Концепции современного естествознания: химическая составляющая
Наиболее сильное влияние на скорость реакции оказывает присутствие в реагирующей системе Катализатора -- вещества, которое повышает (а иногда и уменьшает...
-
Краткая теория Основное уравнение гомогенной кинетики - закон действующих масс, ЗДМ (хотя реально подставляются не массы, а молярные концентрации):...
-
К сожалению, многие учебники химии построены не вполне логично, в частности, одно и то же слово может использоваться в разных смыслах, поэтому...
-
Краткая теория В старом учебнике Глинки вопрос хорошо изложен на качественном уровне, но не хватает строго количественного описания влияния температуры...
-
Автору кажется, что логично было бы начать изложение с термодинамики, и лишь потом на ее основе рассматривать кинетику и равновесия: если реакция...
-
Заготовьте в тетради заранее таблицу для записи исходных данных и результатов опытов. Сейчас в нее внесены некоторые предполагаемые объемы растворов, но...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
Энтропия. Движущее начало химических процессов - Химическая термодинамика. Термохимия. Решение задач
Убедившись в полезности знания тепловых эффектов химических превращений, мы, тем не менее, не смогли ответить на вопрос: "Почему одни химические реакции...
-
Энергия Гельмгольца Изохорно-изотермический потенциал F = U - TS Величина ( V - TS ) является свойством системы; она называется энергией Гельмгольца....
-
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - Неограническая химия
Задание 3.1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте...
-
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально...
-
Кинетика химических реакций - Концепции современного естествознания: химическая составляющая
Одна из особенностей химических реакций заключается в том, что они протекают во времени. Одни реакции протекают медленно, месяцами, как, например,...
-
Катализ, Разновидности катализа:, Принципы катализа: - Гомогенный и гетерогенный катализ
Явление катализа - Это изменение скорости реакции под действием некоторых веществ, которые к концу реакции остаются в химически неизменном виде....
-
Введение - Химическая термодинамика. Термохимия. Решение задач
Химия изучает химическую форму движения материи, под которой понимают превращение одних веществ в другие. В результате химических процессов появляются...
-
Смещение химического равновесия. Принцип Ле-Шателье - Основы химии
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на...
-
1. Какие вопросы решает химическая термодинамика? 2. Что называется термодинамической системой? Как классифицируются системы? Приведите примеры различных...
-
Введение, Гомогенный и гетерогенный катализ - Гомогенный и гетерогенный катализ
Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды, другие осуществляются за минуты,...
-
ТЕРМОХИМИЯ - Химическая термодинамика. Термохимия. Решение задач
Уравнения химических реакций, учитывающие тепловые эффекты, называются термохимическими уравнениями. Например: 2Н2(г.)+О2(г.) = 2Н2О(г.); ДН = - 476 кДж....
-
Кинетика и катализ, Теоретические основы термического пиролиза - Пиролиз углеводородного сырья
Теоретические основы термического пиролиза Термическое разложение углеводородов представляет собой сложный процесс, который можно представить как ряд...
-
Основные понятия химической термодинамики - Химическая термодинамика. Термохимия. Решение задач
Прежде чем приступить к изучению предмета химической термодинамики, необходимо ввести ряд терминов и понятий, используемых в этом разделе. Изучаемые...
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
"Катализ. Гомогенный и гетерогенный катализ" - Гомогенный и гетерогенный катализ
В 1835 году Берцелиус впервые использовал термин "катализатор" для обозначения "веществ, которые способны пробудить сродство, дремлющее при данной...
-
Гомогенный и гетерогенный катализ. Механизм действия катализатора - Основы химии
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газовая смесь или раствор). При гетерогенном катализе катализатор и...
-
Химическая термодинамика. Термохимия. Решение задач
> Стандартные энтальпии образования Н298, энтропии Sє298 и энергии Гиббса образования ДG298 некоторых веществ Вещество Н298, кДж/моль Sє298, Дж/(моль-К)...
-
Если на равновесную с-му не оказ-ся вноешнего воздействия (не изм. темп, давл.), то равновесие м/существовать неизменным долго. Любое внешнее возд-ие...
-
Энтропия. Самопроизвольный процесс - Химическая термодинамика и ее процессы
Самопроизвольный процесс - процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве,...
-
К-изменение скорости хим. р-ции, под действием особых ве-в-катализаторов, кот. участвуют в ходе р-ции, но к концу ее остаются в неизменном кол-ве. Виды:...
-
Введение - Химическая термодинамика и ее процессы
Предметом физической химии является объяснение химических явлений на основе более общих законов физики. Физическая химия рассматривает две основные...
-
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Катализаторы - вещества,...
-
Уравнение Михаэлиса-Ментен и его анализ - Гомогенный и гетерогенный катализ
Уравнемние Михаэмлиса -- Мемнтен -- основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от...
-
Реакторами идеального (полного) смешения называются реакторы непрерывного действия, в которых осуществляется турбулентный гидродинамический режим. В них...
-
Теоретические основы процесса Реакторы смешения - это емкостные аппараты с мешалкой или циркуляционным насосом. Человечество давно пользуется...
-
Гетерогенный катализ - Гомогенный и гетерогенный катализ
Механизм гетерогенного катализа включает пять стадий, причем все они обратимы. 1. Диффузия реагирующих веществ к поверхности твердого вещества. 2....
-
КАТАЛИЗ В БИОХИМИИ - Процесс катализа
Ферментативный катализ неразрывно связан с жизнедеятельностью организмов растительного и животного мира. Многие жизненно важные химические реакции,...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
Активность и селективность катализатора - Гомогенный и гетерогенный катализ
Все процессы переработки углеводородного сырья сопровождаются фазообразованием (испарение, катализ, крекинг и др.). Одна из задач физико-химической...
Катализ - Химическая кинетика, равновесия, термодинамика