Химическая термодинамика, Основы химической термодинамики. Первое начало термодинамики - Физическая химия
Основы химической термодинамики. Первое начало термодинамики
Термодинамические системы и термодинамические параметры. Функции состояния. Парциальные величины. Интенсивные и экстенсивные величины. Формулировка первого начала термодинамики. Взаимосвязь внутренней энергии, теплоты и работы. Адиабатический, изотермический, изохорный, изобарный процессы. Энтальпия. Уравнения для расчета работы, изменения энтальпии и внутренней энергии в различных процессах.
Термодинамика - наука, изучающая взаимопревращения теплоты и работы в уже равновесных системах, а также при переходе системы к равновесию. Химическая термодинамика - это раздел физической химии, в котором методы термодинамики используются для рассмотрения химических реакций, фазовых переходов и процессов в растворах.
Основным объектом рассмотрения химически термодинамики является термодинамическая система - материальный объект (или группа объектов) выделенная из окружающего мира с помощью границы (реальной или воображаемой) и способные обмениваться с другими телами энергией и (или) веществом. Термодинамическая система с некоторыми допущениями описывает некий реальный объект или систему объектов. Остальной мир, не входящий в выделенную термодинамическую систему принято называть средой.
Термодинамика базируется только на экспериментально обнаруженных объективных закономерностях.
Предмет изучения термодинамики:
- 1. Переходы энергии из одной формы в другую, от одной части системы к другой; 2. Энергетические эффекты, сопровождающие различные физические и химические процессы и зависимость их от условий протекания данных процессов; 3. Возможность, направление и пределы самопроизвольного протекания процессов с учетом конкретных условий.
Основные понятия, используемые в термодинамике.
Гомогенная система - система, внутри которой невозможно по каким-либо материальным признакам (например, агрегатное состояние вещества или различный состав) выделить части системы (фазы), а значит и нет поверхностей, разделяющих части системы.
Гетерогенная система - система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы.
Фаза - совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделенная от других частей системы реальными границами раздела.
Изолированная система - система, в которой нет энергетического и материального обмена с окружающей средой.
DE=0, dm=0
Закрытая система - система, в которой есть энергетический обмен с окружающей средой, но отсутствует массообмен.
Открытая система - система, обменивающаяся с окружающей средой и веществом, и энергией.
Состояние любой термодинамической системы может быть охарактеризовано количественно с помощью термодинамических переменных. Переменные, которые фиксированы условиями существования системы, и, следовательно, не могут изменяться в пределах рассматриваемой задачи, называют термодинамическими параметрами:
Экстенсивные, которые прямо пропорциональны массе системы или числу частиц. Например, объем V, энергия U, энтропия S, теплоемкость С;
Интенсивные, которые не зависят от массы системы или числа частиц, например, температура T, плотность массы, давление p.
Всякое изменение термодинамического состояния системы (изменения хотя бы одного параметра состояния) есть термодинамический процесс.
Обратимый процесс - процесс, допускающий возможность возвращения системы в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения.
Равновесный процесс - процесс, при котором система проходит через непрерывный ряд равновесных состояний.
Несамопроизвольный процесс - происходящий только при определенном воздействии на систему (совершением над ним работы, или привнесением в систему энергии в определенных форме и количестве).
Самопроизвольный процесс - для осуществления такого процесса не требуется никакого воздействия на рассматриваемую систему.
Одной из основных характеристик как систем, так и процессов протекающих в них является энергия.
Энергия - мера способности системы совершать работу; с другой стороны это - общая качественная мера движения и взаимодействия материи. Любая материя обладает той или формой и количеством энергии.
Обычно в химической термодинамике рассматриваются неподвижные системы в отсутствие внешних полей.
Формы перехода энергии от одной системы к другой могут быть разбиты на две группы. В первую группу входит только одна форма перехода движения путем хаотических столкновений молекул двух соприкасающихся тел, т. е. путем теплопроводности (и одновременно путем излучения). Мерой передаваемого таким способом движения является теплота. Теплота есть форма передачи энергии путем неупорядоченного движения частиц. Во вторую группу включаются различные формы перехода энергии, общей чертой которых является перемещение частиц, охватывающих очень большие числа атомов или молекул (т. е. макроскопических масс), под действием каких-либо сил. Например, переход некоторого количества электричества от большего электростатического потенциала к меньшему, расширение газа, находящегося под давлением и др. Общей мерой передаваемого такими способами движения является работа - форма передачи энергии путем упорядоченного движения частиц. Теплота и работа возникают только тогда, когда возникает процесс, и характеризуют только процесс. В статичных условиях теплота и работа не существуют. Различие между теплотой и работой, принимаемое термодинамикой как исходное положение, и противопоставление теплоты работе имеет смысл только для тел, состоящих из множества молекул, т. к. для одной молекулы или для совокупности немногих молекул понятия теплоты и работы теряют смысл. Поэтому термодинамика рассматривает лишь тела, состоящие из большого числа молекул, т. е. так называемые макроскопические системы.
Первый закон (первое начало) термодинамики - также называют законом сохранения энергии:
Существует аддитивная функция состояния термодинамической системы, называемая энергией (U). Энергия изолированной системы постоянна. В закрытой системе энергия может изменяться за счет совершения работы А над окружающей средой (или среды над системой) и обмена теплотой Q с окружающей средой.
DU = дQ + дА (дифференциальная форма)
ДU = Q + А (интегральная форма)
В системе СИ размерность работы, теплоты и энергии - [Дж].
Положительная теплота - полученная системой
Положительная работа - совершенная над системой.
Теплота эквивалентна работе (установлено экспериментально).
Первый закон справедлив для любых систем и процессов, но в случае открытых систем использовать его в форме уравнения dU = дQ + дА нельзя, так как в процессах, сопровождающихся переносом вещества от системы к окружению или обратно, наблюдаемые изменения энергии не удается разделить на теплоту и работу. Иногда для открытых систем первый закон записывают в виде:
DU = дQ + дА + ?мdnI
Где ?мdnI характеризует процесс обмена веществом между системой и окружением. Эту сумму условно называют "химической работой", имея в виду работу переноса вещества из окружения в систему. Функция м получила название "химический потенциал". Внутренняя энергия является функцией состояния; это означает, что изменение внутренней энергии ДU не зависит от пути перехода системы из состояния 1 в состояние 2 и равно разности величин внутренней энергии U2 и U1 в этих состояниях:
Измерение абсолютного значения внутренней энергии системы невозможно.
Приложение первого начала термодинамики для определения работы расширения идеального газа.
|
Изохорный процесс (V = const; ДV = 0). Поскольку работа расширения равна произведению давления и изменения объема, для изохорного процесса получаем: A=PV=0 |
Изотермический процесс (Т = const). Из уравнения состояния одного моля идеального газа получаем: 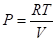
=> 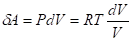
Интегрируя выражение от V1 до V2, получим |

Изобарный процесс (Р = const). 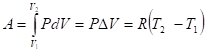
Подставляя полученные выражения для работы различных процессов получим для тепловых эффектов этих процессов следующие выражения: 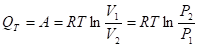
Группируем: 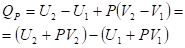
Отсюда выводим уравнение для энатльпии: Абсолютное значение энтальпии вычислить или измерить невозможно. Таким образом, тепловой эффект изобарного процесса равен изменению энтальпии системы. |
Адиабатический процесс (Q = 0). При обратимом адиабатическом расширении идеального газа давление и объем связаны соотношением (уравнением адиабаты): PV Г = const, TV Г-1 = const, T Г p1-г = const, Где г = Cp / CV, Cp и CV - изобарная и изохорная теплоемкости. При адиабатическом процессе работа расширения совершается за счет уменьшения внутренней энергии газа: 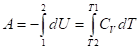
В случае если CV не зависит от температуры (что справедливо для многих реальных газов), работа, произведенная газом при его адиабатическом расширении, прямо пропорциональна разности температур: |
Теплота. Калорические коэффициенты
Начиная рассмотрение тепловых эффектов наиболее целесообразно выразить зависимость теплоты от температуры и объема с помощью дифференциального уравнения первого закона термодинамики:
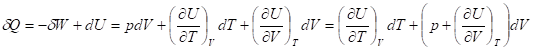
Частные производные в скобках носят название калорических коэффициентов системы и характеризуют:
1. теплоемкость системы при постоянном объеме (или изохорную теплоемкость)
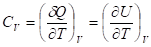
2. скрытую теплоту изотермического расширения
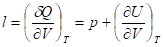
3. Изобарная теплоемкость:
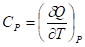
Кроме изобарной и изохорной теплоемкостей в термодинамике используют также понятия истинной и средней теплоемкости.
4. Истинная теплоемкость:
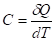
5. Средняя теплоемкость - количество теплоты для нагрева вещества на 10К:
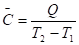
Если величины C, , CV, Cp относятся к одному молю вещества, то говорят о мольных значениях теплоемкостей Cm.
Размерность теплоемкости - [ДжК-1], мольной теплоемкости - [Джмоль-1К-1]. Истинная и средняя мольные теплоемкости связаны между собой соотношениями:
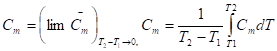
Соотношение между Cp и CV:
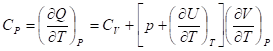
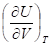
Установлено, что при изотермическом расширении идеального газа его внутренняя энергия не зависит от объема, то есть= 0.
В изотермических процессах с участием идеального газа внутренняя энергия не изменяется, и
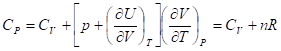
Или для одного моля идеального газа
CP, m=CV, m+R.
Для конденсированной фазы CPCV, CP, m CV, m.
Тепловой эффект реакции. Стандартные состояния
Тепловые эффекты зависят, в общем случае, от температуры и давления, поэтому для термохимических расчетов необходимо, чтобы все тепловые эффекты были отнесены к одинаковым условиям, т. е. стандартизированы. Энтальпию реакции между веществами, находящимися в стандартных состояниях при температуре T, называют стандартной энтальпией реакции и обозначают ДRHTO . Стандартная энтальпия образования, ДF HTO - изобарный тепловой эффект реакции образования одного моля данного химического соединения из простых веществ в стандартных состояниях. Энтальпия образования простого вещества в стандартном состоянии равна 0 при любой температуре.
Стандартная энтальпия сгорания ДCHTO - изобарный тепловой эффект реакции окисления одного моля вещества газообразным кислородом при p(O2) = 1 бар. Теплота сгорания, если не оговорено особо, отвечает окислению углерода до СО2, водорода до H2O(ж), для остальных веществ в каждом случае принято указывать образующиеся продукты.
Из закона Гесса вытекают два следствия, которые позволяют рассчитывать энтальпии химических реакций.
Следствие 1. Стандартная энтальпия химической реакции
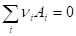
Равна разности стандартных энтальпий образования продуктов реакции и реагентов (с учетом стехиометрических коэффициентов):
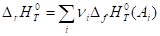
Следствие 2. Стандартная энтальпия химической реакции
Равна разности энтальпий сгорания реагентов и продуктов реакции (с учетом стехиометрических коэффициентов):
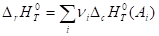
Стехиометрические коэффициенты положительны для реагентов и отрицательны для продуктов реакции.
Зависимость теплоемкости и энтальпии от температуры и давления.
Закон Кирхгофа
Большинство термохимических данных в справочниках приведено для стандартных условий - при температуре 298К. Для расчета тепловых эффектов при других температурах используют уравнение Кирхгофа:
В дифференциальной форме:
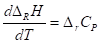
В интегральной форме:
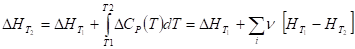
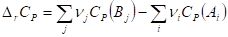
Где - разность изобарных теплоемкостей продуктов реакции и исходных веществ, - высокотемпературная составляющая энтальпии i-го вещества. Если разница T2 - T1 невелика, то можно принять ДRCp = const. иначе необходимо учитывать температурную зависимость ДRCp(T).
Во всем интервале температур описать теплоемкость одной формулой невозможно и используются различные интерполяционные или экстраполяционные функции. При корректной экстраполяции теплоемкости должны выполняться предельные условия
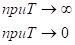

Вот несколько примеров:
Слоистые и цепные структуры - зависимость CV(T) вблизи абсолютного нуля описывается степенными функциями вида: CV =kT.
Мольная теплоемкость одноатомных идеальных газов при невысоких температурах:
CV, m = 3/2 R,
Для двухатомных газов: CV, m = 5/2 R.
Интерполяционные формулы позволяют корректно восстановить значение теплоемкости при температурах внутри указанного температурного интервала. К таким выражениям относятся часто используемые уравнения:
Cp = a + bT,
Cp = a + bT + сТ-2,
Cp = a + bT + cTlnT.
Число варьируемых параметров зависит от точности имеющихся данных, ширины температурного интервала. Попытка использовать эти уравнения как экстраполяционные, т. е. предсказывать значения теплоемкости при температурах, выходящих за пределы указанного температурного интервала часто приводит к физически некорректным величинам CV или Cp. Это утверждение продемонстрировано на рис.:
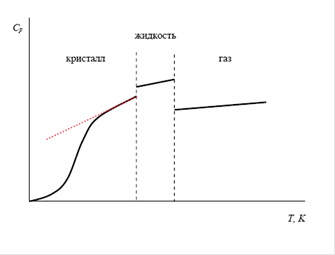
Кроме того, есть и другие способы оценок этих величин:
- * правило Дюлонга-Пти: теплоемкость CV твердых соединений приблизительно равна сумме атомных теплоемкостей; при этом принимают, что для простых веществ они одинаковы и равны 25 Джмоль-1К-1 ? 3R (исключение составляют легкие элементы); * правило Неймана-Коппа (правило аддитивности): теплоемкость Cp сложного вещества равна сумме теплоемкостей образующих соединение простых веществ; * мольные теплоемкости органических жидкостей рассчитывают суммированием атомно-групповых составляющих (инкрементов) теплоемкостей. * для большинства органических соединений в небольшом интервале температур
Cp = a+ bT, причем b/a = 0.0022.
Зависимость энтальпии от давления в общем виде определяется выражением
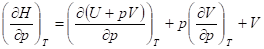
Зависимость изобарной теплоемкости от давления получается при дифференцировании
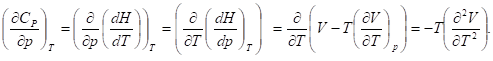
Аналогично, и для изохорной теплоемкости
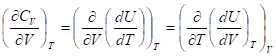
Внутренняя энергия (энтальпия) идеального газа не зависят от объема (давления), поэтому
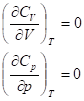
Т. е. теплоемкость идеального газа не зависит от V и p. Для реальных газов и конденсированной фазы эта зависимость становится заметной только при очень больших давлениях.
Похожие статьи
-
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - Неограническая химия
Задание 3.1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте...
-
Первое начало термодинамики. Энтальпия - Химическая кинетика, равновесия, термодинамика
Это закон сохранения энергии. Подводимая к системе теплота Q расходуется на изменение ее внутренней энергии и на совершение работы А: Q = U + А Здесь U =...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Общие сведения Термодинамика - наука о превращениях энергии в различных процессах, как физических, так и химических, и о направлении процессов, о...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
Внутренняя энергия термодинамическая функцция состояния системы, ее энергия, определяемая внутренним состоянием. Внутренняя энергия складывается в...
-
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально...
-
ТЕРМОХИМИЯ - Химическая термодинамика. Термохимия. Решение задач
Уравнения химических реакций, учитывающие тепловые эффекты, называются термохимическими уравнениями. Например: 2Н2(г.)+О2(г.) = 2Н2О(г.); ДН = - 476 кДж....
-
Основные понятия химической термодинамики - Химическая термодинамика. Термохимия. Решение задач
Прежде чем приступить к изучению предмета химической термодинамики, необходимо ввести ряд терминов и понятий, используемых в этом разделе. Изучаемые...
-
Фактически это следствие первого начала термодинамики, но сформулирован раньше, чем первое начало. Тепловой эффект изобарного (или изохорного) процесса...
-
Смещение химического равновесия. Принцип Ле-Шателье - Основы химии
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на...
-
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа : При повышении температуры на каждые 10о скорость большинства реакций...
-
Ниже рассматривается наиболее важный изобарно-изотермический случай. Если реакция идет в изохорно-изотермических условиях, то вместо энергии Гиббса нужно...
-
1. Какие вопросы решает химическая термодинамика? 2. Что называется термодинамической системой? Как классифицируются системы? Приведите примеры различных...
-
Энтропия. Самопроизвольный процесс - Химическая термодинамика и ее процессы
Самопроизвольный процесс - процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве,...
-
Энтропия. Движущее начало химических процессов - Химическая термодинамика. Термохимия. Решение задач
Убедившись в полезности знания тепловых эффектов химических превращений, мы, тем не менее, не смогли ответить на вопрос: "Почему одни химические реакции...
-
Способы получения и химические свойства оксидов - Основы химии
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. Окисление кислородом простых...
-
Истинное и ложное равновесие Все химические реакции в той или иной степени обратимы. Если возможна реакция aA + bB хХ + yY, то возможна и обратная...
-
Химия в системе наук - Основы естественно-научных знаний
Химия - наука о веществах, их свойствах, строении и взаимных превращениях. Под веществом понимается любая совокупность атомов и молекул. Традиционная...
-
В предыдущих разделах рассмотрены отдельные аспекты кинетики, а теперь пора подвести общие итоги: от чего зависят скорости реакций и как можно ими...
-
Физические свойства воды. В современной шкале измерений вода принята за эталон по очень многим показателям. Температурой таяния льда является 0 градусов...
-
Растворы - термодинамические устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это...
-
Положение металлов в ПС. Физические свойства металлов. Методы получения металлов - Основы химии
Металлы располагаются в основном в левой и нижней части ПС К физическим свойствам относятся плотность, плавление (температура плавления),...
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
С кислородом большинство металлов образует оксиды - амфотерные и основные: 4Li + O2 = 2Li2O, 4Al + 3O2 = 2Al2O3. Щелочные металлы, за исключением лития,...
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Введение - Химическая термодинамика. Термохимия. Решение задач
Химия изучает химическую форму движения материи, под которой понимают превращение одних веществ в другие. В результате химических процессов появляются...
-
(а) Зависят ли энергия активации и предэкспоненциальный множитель от природы реагентов? от их концентраций? от температуры? от присутствия посторонних...
-
Автору кажется, что логично было бы начать изложение с термодинамики, и лишь потом на ее основе рассматривать кинетику и равновесия: если реакция...
-
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов,...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
Гомогенный и гетерогенный катализ. Механизм действия катализатора - Основы химии
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газовая смесь или раствор). При гетерогенном катализе катализатор и...
-
Критерии самопроизвольного протекания процессов - Химическая кинетика, равновесия, термодинамика
А) В изолированной системе самопроизвольно идут только процессы с увеличением энтропии. S > 0 - процесс возможен, S Одновременно действуют обе тенденции...
-
Теоретические основы процесса Реакторы смешения - это емкостные аппараты с мешалкой или циркуляционным насосом. Человечество давно пользуется...
-
Второе начало термодинамики. Энтропия Из предыдущих глав мы знаем много обратимых процессов, но есть и необратимые, например: - переход тепла от горячего...
-
Еще три следствия из закона Гесса - Химическая кинетика, равновесия, термодинамика
2. Тепловой эффект процесса равен разности между суммами теплот сгорания исходных веществ и продуктов с учетом коэффициентов в уравнении реакции. (при...
-
Электролиз - физико-химический процесс, состоящий в выделении на Электродах составных частей растворенных веществ или других веществ, который возникает...
-
Химическая связь - Квантовые концепции в химии
Химия изучает процессы превращения молекул при воздействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного...
Химическая термодинамика, Основы химической термодинамики. Первое начало термодинамики - Физическая химия