Зависимость скорости от природы реагирующих ве-в, температуры. Энергия активации - Основные понятия неорганической химии
Опис-ся правиломВант-Гоффа:
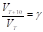
С увелич-ем темп. на каждые 10 градусов. Скор. больш-ва хим. р-ций увелич-ся в 2-4 раза.
Где г-темп. коэф-т скорости хим. р-ции.
Для расчета исп-ся другая ф-ма записи правила:
Завис-ть скор. хим. р-ции от темп. запис-ся ур-ем Аррениуса:
Где к-конст. скор. хим. р-ции, е-основание натур. логарифма (2,7), R-универс. газ. постоянная (8,314 дж/моль*л), Т-абсол. Темп. ЕА-энергия активации.
Энергия активации. Чтобы произошло физич. взаим-е частицы д/столкнуться. Атомы и молекулы двигаются с огр. скоростью и сталкиваются очень часто. Если бы все столкновения приводили к реакции, то они протекали бы с огр. скоростями.. опыт показывает, что р-ции протекают не мгновенно, а с конечной скоростью, т. е. не любое столкновение приводит к хим. взаимодействию. м/у собой реагирут молекулы, кот. обладают некот. повыш. энергией в момент соударения, величина кот. достаточна для протекания р-ции. Этот избыток энергии, по сравн. со ср. значением энергии всех молекул, кот. д/обладать частица, чтобы ее столкновение с другой частицей было эффективным - наз-ся эн. акт.
Похожие статьи
-
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа : При повышении температуры на каждые 10о скорость большинства реакций...
-
Соли-сильные электролиты, существующие в водных растворах в виде положительно запряженных ионов металлов и отрицательно заряженных ионов кислотных...
-
Или N экв.1=n экв.2 для газообразных ве-в наряду с понятием молярного V (22,4 моль/л), исп-ся понятие - молярный объем эквивалента-это V одного моль...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
При взаимодействии атомао м/у ними может возникнуть хим. связь, приводящая к образованию устойчивой многоатомной с-мы - молекулы, кристалла. Чем прочнее...
-
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Атомно-молекулярное учение этот закон объясняет следующим...
-
Атомно-молекулярное учение. Основные понятия химии - Основные понятия неорганической химии
Все вещества сост. из атомов. В химию понятие атома ввел Ломоносов: ат. разные, ат. каждого вида один. М/у собой, но отлич. от атомов др. вида., ат....
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
К-изменение скорости хим. р-ции, под действием особых ве-в-катализаторов, кот. участвуют в ходе р-ции, но к концу ее остаются в неизменном кол-ве. Виды:...
-
Слабые (L<<1, L<<100%) нек. мин. к-ты HNO2, H3PO4, HJ NH3, все ост. органич. основания (Me(OH)2), больш-во органич. кислот НСООН, СН3СООН,...
-
Если на равновесную с-му не оказ-ся вноешнего воздействия (не изм. темп, давл.), то равновесие м/существовать неизменным долго. Любое внешнее возд-ие...
-
Гидролиз - р-ция обменного взаимод-я ионов связи, с ионами, входящими в состав Н2О (Н+ и ОН-). Г-з протекает в том случае, если хотя бы один из ионов...
-
Рассмотрим реакцию между веществами А и В, протекающую по схеме: А А + в В = с С + d D Количественно зависимость между скоростью реакции и концентрациями...
-
Электролиз - р-ция превращения ве-ва под действ. эл. тока. если к р-ру или расплаву эл-та поднести эл. ток, то ионы в нем начнут направленно перемещаться...
-
ОВР, протекающие с изменением ст. окисления эл-тов, вхлдящие в состав реакц. ве-в. они сопровожд-ся переход электронов одним за другим. Zn-2e =Zn2+...
-
Р-ры-галог. с-мы, сост. из 2х или более компонентов(расв-ль и растворимые ве-ва). Растворитель-тот компонент, кот. в чистом виде нах-ся в том же...
-
ТЕМПЕРАТУРА - Основные положения молекулярно-кинетической теории, ее опытные обоснования
Любое макроскопическое тело или группа макроскопических тел называется термодинамической системой. Тепловое или термодинамическое равновесие - такое...
-
Понятие квантовой химии - Квантовые концепции в химии
Квантовая химия - это раздел теоретической химии, в котором строение и свойства химических соединений, их взаимодействие и превращение в химических...
-
Составление химических уравнений, Расчеты по химическим уравнениям - Основные понятия и законы химии
Включает три этапа: 1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками "+" и "®" : HgO ®...
-
Если два химических элемента дают несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же...
-
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ, Атомно-молекулярное учение - Основные понятия и законы химии
Химия - наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении. В настоящее время известно более 100 тыс....
-
Св-ва хим. эл-тов, а так же формы и св-ва соединений эл-тов нах-ся в периодической зависимости от заряда ядер их атомов. Возрастание + зарядов атомных...
-
Атом сост. из массивн. "+" заряж. ядра и нах-ся в его поле "-"электронов. В ядрах нах-ся практич. вся масса атома. В состав ядра входят элемент. частицы:...
-
Комплексные соединения - соед-я, обр-ся сочетанием нескольких, способных к существованию ионов, сост. из атома в опр. валентном сост-ии, связ. с одной...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
Пластичными массами называют материалы, полученные на основе полимеров, содержащие различные добавки и способные под влиянием температуры и давления,...
-
Основные положения стереохимии Стереохимия Стереохимия или структурная химия(от греч. уфесеьт -- твердый, пространственный), -- раздел химии о...
-
Способность минералов закрепляться на поверхности раздела воздух - вода (или в общем случае газ - жидкость) зависит от степени полярности минеральной...
-
Полимеризация - это процесс получения ВМС, при котором молекула полимера образуется путем последовательного присоединения молекул мономера...
-
Анализ модели - Кинетические закономерности взрывного свечения азида серебра
Рассмотрим процесс развития реакции при произвольной степени разложения. Нас будет интересовать вид кинетических зависимостей концентрации носителей цепи...
-
Уравнение Клайперона-Менделеева - Основные понятия и законы химии
Если записать объединенный газовый закон для любой массы любого газа, то получается уравнение Клайперона-Менделеева: PV= (m / M) RT Где m - масса газа; M...
-
Закон Авогадро ди Кваренья (1811 г.) - Основные понятия и законы химии
В равных объемах различных газов при одинаковых условиях (температура, давление и т. д.) содержится одинаковое число молекул. Закон справедлив только для...
-
ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР - Процесс катализа
Все каталитические реакции - самопроизвольный процесс, т. е. протекают в направлении убыли энергии Гиббса - убыли энергии системы. Давно уже было...
-
Гомогенный и гетерогенный катализ. Механизм действия катализатора - Основы химии
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газовая смесь или раствор). При гетерогенном катализе катализатор и...
-
Согласно молекулярно-кинетической теории все вещества состоят из мельчайших частиц - молекул. Молекулы находятся в непрерывном движении и взаимодействуют...
-
"Квантовая химия" Квантовая химия - область теоретической химии, в которой вопросы строения и реакционной способности химических соединений, химические...
-
Химия в системе наук - Основы естественно-научных знаний
Химия - наука о веществах, их свойствах, строении и взаимных превращениях. Под веществом понимается любая совокупность атомов и молекул. Традиционная...
-
Химия 20 века - Этапы становления химии
Конец 19 в. ознаменовался тремя выдающимися открытиями в области физики, в результате которых была доказана сложная структура атома, прежде считавшегося...
-
Введение, Химическая природа, Биологическая роль фолацина - Витамин Вс (фолиевая кислота)
Фолиевая кислота (от лат. "folium" - лист) поскольку впервые она была выделена из листьев шпината. Она широко распространена в биологических системах....
-
Теоретические основы масс-спектрометрии Масс-спектрометрия представляет собой метод исследования веществ, основанный на определении массы (точнее,...
Зависимость скорости от природы реагирующих ве-в, температуры. Энергия активации - Основные понятия неорганической химии