Гидролиз солей. Механизм Г. Типичные случаи Г. Ступенчатый Г. Степень гидролиза. Константа Г - Основные понятия неорганической химии
Гидролиз - р-ция обменного взаимод-я ионов связи, с ионами, входящими в состав Н2О (Н+ и ОН-).
Г-з протекает в том случае, если хотя бы один из ионов соли способен обр-ть с ионами Н2О слаб. электролит (сл. к-та. Сл. осн-е).
По спос-ти к Г выд-т 4 типа солей:
1. соли, образованные катионом сл. осн-я и анионом сильн. к-ты: NH4Cl-продукт сильн. к-ты HCl и сл. осн-я. NH4OH подв. Г по катиону:
NH4Cl> NH4++Cl- ; NH4++НОН- NH4ОН+Н-
Р-ция среды кислая.
2. соли, обр-е кат. сильн. осн-я и анионос сл. к-ты:
KNO2>K++NO2-; NO2-+Н2О-HNO2+OH-
Р-ция среды щелочная (рН>7)
- 3. соли, обр-е катионос сл. осн-я и анионом слаб. к-ты: 4. кат. силн. осн-я и анион сильн. к-ты, Г не подвергаются, среда нейтральная:
KCl>K++Cl-; K++H2O; Cl-+H2O
Если Г продвергается многовалентный ион, то Г протекает ступенчато, число ступеней Г численно =валентности иона
- 1 ст.: 2. ст.: +-Н2РО4-+ОН- 3 ст.: Н2РО4-+- Н2РО4+ОН-
По каждой последующей ступени Г протек. в меньшей степени, чем по предыдущей.
Р-ция Г обратима, поэтому воздействием разл. факторов (темп., доб. кисл. или щелочи) можно добиться подавления или усиления Г.
Конст. Г наз-т конст. равновесия р-ции. Напр., р-ция Г акцетата натрия:
Хар-ся конст. равовесия
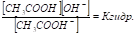
Т. к концентрация воды постоянна, то
По общему ур-ю получим:
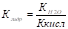
Похожие статьи
-
Или N экв.1=n экв.2 для газообразных ве-в наряду с понятием молярного V (22,4 моль/л), исп-ся понятие - молярный объем эквивалента-это V одного моль...
-
Слабые (L<<1, L<<100%) нек. мин. к-ты HNO2, H3PO4, HJ NH3, все ост. органич. основания (Me(OH)2), больш-во органич. кислот НСООН, СН3СООН,...
-
Диссоциация воды. Водородный показатель. Гидролиз солей - Основы химии
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды...
-
Опис-ся правиломВант-Гоффа: С увелич-ем темп. на каждые 10 градусов. Скор. больш-ва хим. р-ций увелич-ся в 2-4 раза. Где г-темп. коэф-т скорости хим....
-
При взаимодействии атомао м/у ними может возникнуть хим. связь, приводящая к образованию устойчивой многоатомной с-мы - молекулы, кристалла. Чем прочнее...
-
Р-ры-галог. с-мы, сост. из 2х или более компонентов(расв-ль и растворимые ве-ва). Растворитель-тот компонент, кот. в чистом виде нах-ся в том же...
-
К-изменение скорости хим. р-ции, под действием особых ве-в-катализаторов, кот. участвуют в ходе р-ции, но к концу ее остаются в неизменном кол-ве. Виды:...
-
Комплексные соединения - соед-я, обр-ся сочетанием нескольких, способных к существованию ионов, сост. из атома в опр. валентном сост-ии, связ. с одной...
-
Электролиз - р-ция превращения ве-ва под действ. эл. тока. если к р-ру или расплаву эл-та поднести эл. ток, то ионы в нем начнут направленно перемещаться...
-
Если на равновесную с-му не оказ-ся вноешнего воздействия (не изм. темп, давл.), то равновесие м/существовать неизменным долго. Любое внешнее возд-ие...
-
Соли-сильные электролиты, существующие в водных растворах в виде положительно запряженных ионов металлов и отрицательно заряженных ионов кислотных...
-
ГИДРОЛИЗ СОЛЕЙ - Характеристика основных видов растворов
Гидролизом называется обменная реакция между веществом и водой. При гидролизе обычно происходит изменение реакции среды. Если гидролиз не сопровождается...
-
ОВР, протекающие с изменением ст. окисления эл-тов, вхлдящие в состав реакц. ве-в. они сопровожд-ся переход электронов одним за другим. Zn-2e =Zn2+...
-
Св-ва хим. эл-тов, а так же формы и св-ва соединений эл-тов нах-ся в периодической зависимости от заряда ядер их атомов. Возрастание + зарядов атомных...
-
Атом сост. из массивн. "+" заряж. ядра и нах-ся в его поле "-"электронов. В ядрах нах-ся практич. вся масса атома. В состав ядра входят элемент. частицы:...
-
Атомно-молекулярное учение. Основные понятия химии - Основные понятия неорганической химии
Все вещества сост. из атомов. В химию понятие атома ввел Ломоносов: ат. разные, ат. каждого вида один. М/у собой, но отлич. от атомов др. вида., ат....
-
Гидролиз солей в водном растворе - Реакция обмена между растворами электролитов
Цель работы. Исследовать характер гидролиза солей. Приборы и реактивы . Штатив с пробирками, растворы карбоната натрия, сульфата меди, хлорида аммония...
-
Уравнение Клайперона-Менделеева - Основные понятия и законы химии
Если записать объединенный газовый закон для любой массы любого газа, то получается уравнение Клайперона-Менделеева: PV= (m / M) RT Где m - масса газа; M...
-
Гидролиз по катиону и аниону - Ионные реакции
Соли, образованные слабым основанием и слабой кислотой, гидролизуются и по катиону и по аниону: CH3COONH4 + H2O " CH3COOH + NH4OH Или в ионной форме:...
-
Растворы электролитов. Диссоциация кислот, солей и оснований - Основы химии
Электролиты - вещества, которые при растворении подвергаются диссоциации на ионы. В результате раствор приобретает способность проводить электрический...
-
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Атомно-молекулярное учение этот закон объясняет следующим...
-
Закон Авогадро ди Кваренья (1811 г.) - Основные понятия и законы химии
В равных объемах различных газов при одинаковых условиях (температура, давление и т. д.) содержится одинаковое число молекул. Закон справедлив только для...
-
Ответ: Функция y=arctgx, ее график, свойства Ответ: Функция y=arcctgx, ее график, свойства Ответ: Решение уравнений sinx=a, частные случаи Ответ:...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Если два химических элемента дают несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же...
-
Закон постоянства состава - Основные понятия и законы химии
Впервые сформулировал Ж. Пруст (1808 г). Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное...
-
Составление химических уравнений, Расчеты по химическим уравнениям - Основные понятия и законы химии
Включает три этапа: 1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками "+" и "®" : HgO ®...
-
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ, Атомно-молекулярное учение - Основные понятия и законы химии
Химия - наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении. В настоящее время известно более 100 тыс....
-
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ - Характеристика основных видов растворов
Все вещества по способности в растворе или в расплавленном состоянии проводить электрический ток можно подразделить на две группы: электролиты и...
-
Гамильтоновы циклы, Основные понятия и определения - Гамильтоновы циклы
Название "гамильтонов цикл" произошло от задачи "Кругосветное путешествие" предложенной ирландским математиком Вильямом Гамильтоном в 1859 году. Нужно...
-
Пусть { , , ..., } - множество возможных состояний некоторой физической системы. В любой момент времени система может находиться только в одном...
-
Способы получения и химические свойства солей - Основы химии
1. С использованием металлов Металл+неметалл Mg+Cl2=MgCl2 Металл+кислота Zn+2HCl=ZnCI2+H2 Металл+соль Fe+CuSO4=FeSO4+Cu 2. С использованием оксидов...
-
Конкретные модели процессов управления в социальных и экономических системах исходят из общей методологии, которую и формулируем в настоящей статье....
-
Гомогенный и гетерогенный катализ. Механизм действия катализатора - Основы химии
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газовая смесь или раствор). При гетерогенном катализе катализатор и...
-
Основные классы неорганических соединений
Классификация неорганических веществ прошла долгий путь развития и складывалась постепенно, начиная с первых опытов алхимиков, вплоть до наших дней,...
-
ФУНКЦИИ, Основные понятия - Свойства функций
Основные понятия При изучении различного рода явлений приходится иметь дело с совокупностью переменных величин, которые связаны между собой таким...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
ЖЕСТКОСТЬ ВОДЫ - Химические свойства и строение воды
Жесткость воды - свойство воды (не мылиться, давать накипь в паровых котлах), связанное с содержанием растворимых в ней соединений кальция и магния, это...
-
Понятие конформного отображения - Конформное отображение
Основная задача теории конформных отображений - построить конформное отображение заданной области на некоторую заданную область плоскости переменной w....
Гидролиз солей. Механизм Г. Типичные случаи Г. Ступенчатый Г. Степень гидролиза. Константа Г - Основные понятия неорганической химии