Производство формальдегида на серебряном катализаторе - Анализ способов получения глиоксаля и технологических схем окисления одноатомных спиртов
Основной производственный метод получения формальдегида во всем мире уже много лет - каталитическое взаимодействие метанола с кислородом воздуха.
В 20-х годах многими исследователями было показано, что серебро и его сплавы более эффективны в качестве катализаторов, чем медь.
Как известно, смеси метанола с кислородом или воздухом взрывоопасны. При атмосферном давлении область распространения пламени в смесях метанол - воздух находится в диапазоне объемного содержания метанола от 6,7 до 36,4 %. При добавлении инертного газа (азот) пределы взрывных концентраций сужаются, также аналогичный эффект оказывает добавление паров воды (рисунок 1.1). С повышением температуры указанные пределы несколько расширяются.
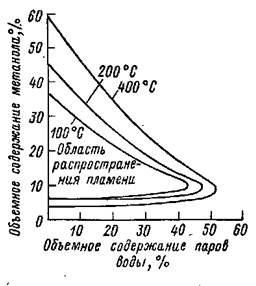
Рисунок 1.1 - Влияние воды на размеры области распространения пламени в смесях метанола с воздухом
Окислительная конверсия метанола на серебре (рисунок 1.2) проводится при соотношении метанол : воздух выше верхнего предела взрывной концентрации, то есть при большом избытке метанола по отношению к кислороду.
Образование формальдегида осуществляется в результате протекания параллельных реакций простого и окислительного дегидрирования метанола (тепловые эффекты найдены на основе данных [17, стр. 33], ?Q298 = - ?Н298):
СН3ОН + 0,5О2 > СН2О + Н2О + 147,4 кДж/моль, (1.4.1)
СН3ОН > СН2О + Н2 - 93,4 кДж/моль. (1.4.2)
Наряду с этими реакциями в системе протекает ряд побочных превращений:
СН3ОН + 3/2О2 > СО2 + 2Н2О + 575,1 кДж/моль, (1.4.3)
СН2О + 0,5О2 > НСООН + 270,4 кДж/мол, (1.4.4)
НСООН + 0,5О2 > СО2 + Н2О + 14,5 кДж/моль, (1.4.5)
СН2О > СО +Н2 + 1,9 кДж/моль. (1.4.6)
Рисунок 1.2 - Технологическая схема производства формальдегида на серебряном катализаторе
1 - испаритель; 2 ,7- теплообменник; 3 - реактор; 4 - катализатор; 5 - подконтактный холодильник; 6 - абсорбер; 8 - сборник формалина; а - воздух, б - метанол, в - вода, г - метанольный формалин.
Технологическая схема рассматриваемого процесса приведена на рисунке 1.2. Она состоит из следующих узлов: Испарителя 1; четырех теплообменников 2 и 7; реактора 3, в который входят катализатор 4 и подконтактный холодильник 5; абсорбера 6; сборника формалина 8.
На схеме производства формальдегида на катализаторе серебро на носителе метанол, содержащий 20 - 25 % воды, поступает в испаритель 1, где испаряется в токе воздуха. Паровоздушная смесь перегревается до 110 °С в теплообменнике 2 и подается в верхнюю часть реактора 3. При пуске системы слой катализатора 4 в реакторе разогревается до 250 - 300 °С с помощью специального электроподогревателя, а после "зажигания" слоя температура катализатора поддерживается на заданном уровне за счет тепла реакции. Пройдя с высокой скоростью через слой катализатора, реакционная смесь охлаждается в подконтактном холодильнике 5. Далее газообразные продукты реакции поступают в абсорбер 6, где из них извлекаются формальдегид и не прореагировавший метанол. Абсорбер, представляющий собой тарельчатую колонну, разделен на три секции. Нижняя секция орошается формалином, средняя - раствором, содержащий 15 - 20 % формальдегида, а верхняя - чистой водой. Из низа абсорбера выходит товарный формалин г.
Превращение метанола в формальдегид происходит в результате контакта молекул спирта с кислородом, хемосорбированных на атомах серебра, то есть активными центрами катализатора являются поверхностные окислы серебра.
В условиях технического процесса значение ?Q составляет 90 - 100 кДж. Исходная смесь, попадая в реактор, нагревается более, чем на 500 оС, процесс осуществляется без отвода тепла - адиабатический режим. С учетом большого разбавления азотом, система в целом малочувствительна к изменению давления. Изменение общего давления от 0,01 до 1 МПа практически не влияет на состав продуктов.
При температуре около 300 оС происходит "зажигание" катализатора, то есть переход от изотермического к адиабатическому режиму. Этот момент характеризуется быстрым и самопроизвольным повышением температуры "горячей точки" катализатора до 600 - 700 оС, соответствующей заданному мольному отношению кислород : метанол.
Разбавление спиртовоздушной смеси инертными газами - один из способов повышения общей конверсии метанола [18]. Оптимальным разбавлением является отношение инерт : метанол = 1,5 : 1 ч 2 : 1. В этих пределах разбавления лежат рекомендации патентов [20]. В качестве разбавителя рекомендуется применять абгазы, азот, аргон, гелий [18, 19], диоксид углерода [20].
В таблице 1.8 приведены показатели процесса получения формальдегида с рециркуляцией отходящего газа по данным фирмы BASF [17, стр. 44].
Добавление к исходному метанолу воды, помимо уменьшения взрывоопасности процесса, благоприятно сказывается на таких показателях, как селективность, стабильность работы катализатора.
Таблица 1.8 - Показатели процесса получения формальдегида
|
Мольная селективность образования формальдегида, % |
89,3 |
|
Конверсия метанола, % |
97- 98 |
|
Температура в реакторе, оС |
680 - 720 |
|
Выход абгазов (на 1т формалина), м3 |
1984 |
|
Массовое содержания формальдегида в формалине, % |
50 - 55 |
|
Содержание (на 100 % формальдегида) Метанола, % Муравьиной кислоты, ‰ |
|
|
Содержание воды в продуктах реакции (в расчете на 1т формалина), м3 |
0,54 |
Похожие статьи
-
В России процесс окисления этиленгликоля с получением глиоксаля в промышленных масштабах не реализован, что обусловлено отсутствием соответствующих...
-
В промышленности синтез глиоксаля окислением этиленгликоля протекает в адиабатических условиях, оптимальный температурный режим процесса зависит от...
-
Запатентован способ получения глиоксаля окислением этиленгликоля в жидкой фазе при обработке кислородом или кислородсодержащим газом. Окисление проводят...
-
Другим способом получения формальдегида является окислительное дегидрирование метилового спирта в присутствии катализаторов. Последние можно разделить на...
-
Таблица 2 - Структура сырья в производстве метанола, %. Сырье В мире Беларусь и Россия Природный газ 73,8 70,7 Нефть и нефтепродукты 24,4 4,0 Отходы...
-
Метод жидкофазного окисления ацетальдегида азотной кислотой является одним из промышленных способов получения глиоксаля. Суммарное уравнение реакции...
-
Общие сведения о глиоксале Глиоксаль (этандиал, диформиль, щавелевый альдегид) -- простейший диальдегид. Несмотря на простое строение и химический состав...
-
В настоящее время производственные методы получения формальдегида большим разнообразием не отличаются. Так, в реакциях восстановления СО и СО2 Водой...
-
Термодинамика процесса В процессах парофазного каталитического окисления моноатомных спиртов и этиленгликоля возможна реализация следующих превращений...
-
Существуют разработки метода синтеза глиоксаля озонированием бензола эквивалентным количеством озона с дальнейшим гидрированием получаемых продуктов для...
-
Введение - Анализ способов получения глиоксаля и технологических схем окисления одноатомных спиртов
Синтез альдегидов и кетонов парофазным каталитическим окислением спиртов осуществляется во всех промышленно-развитых странах. Таким путем получают...
-
Получение синтезированного газа - Анализ и технологическая оценка химического производства
Химические методы переработки нефти проводят при высоких температурах без катализатора (термический крекинг), при высоких температурах в присутствии...
-
Метиловый спирт [30] - Разработка технологической схемы получения анизола и крезола
Молекулярная формула CH3OH Молярная масса 32,04 г/моль Внешний вид бесцветная жидкость Свойства Плотность и агрегатное состояние 791,8 кг/м?,...
-
Качественные методы анализа - Разработка технологической схемы получения анизола и крезола
Рециркуляционных реакционно-ректификационных процессов. При анализе сложных ХТС, характеризующихся большим числом параметров и переменных необходимо...
-
Каталитическое окисление органических соединений является ведущим методом получения ценных продуктов химической и нефтехимической промышленности. Этим...
-
Получение продукта конденсации карбамида и формальдегида холодным способом - Поликонденсация
Реактивы: Карбамид - 60 г (1 моль); формальдегид 40%-ный - 130 г (1,75 моля); уротропин - 3-4 г, щавелевая кислота - 0,3 г. Оборудование: Трехгорлая...
-
При использовании разомкнутых химико-технологических систем в большинстве случаев принципиально невозможно проведение процессов при практически полной...
-
Этот способ концентрирования обеспечивает получение чистой концентрированной азотной кислоты без вредных выбросов в атмосферу. Однако у него есть ряд...
-
Производство полимеров - Анализ и технологическая оценка химического производства
Высокомолекулярные соединения получают из мономеров полимеризацией, сополимеризацией, поликонденсацией и методами привитой полимеризации и...
-
Полимеризация двуокиси азота. Переработка нитрозных газов в азотную кислоту обычно происходит при температурах от О до 50 °С. В этих условиях двуокись...
-
Описание технологического процесса Процесс каталитического риформинга осуществляют при сравнительно высокой температуре и среднем давлении, в среде...
-
Принципиальная схема установки риформинга (см. рис.1) включает 4 блока: Блок гидроочистки сырья - бензиновых фракций (до содержания серы не более 1...
-
Свойства, получение и применение компонентов разделяемой смеси Анизол C7H8O / С6Н5ОСН3 Молекулярная масса: 108.1 Температура кипения: 155°C Температура...
-
Процесс получения винилхлорида сбалансированным методом из этилена состоит из шести стадий: 1. синтез 1,2-дихлорэтана прямым жидкофазным хлорированием...
-
Один из способов повысить селективность - это правильно подобрать катализатор. Рассмотрим этот метод, на примере получения анизола и крезола. Анизол и...
-
Сравнение методов получения хлорида калия - Производство хлорида калия галургическим способом
Флотационный метод обогащения по сравнению с галургическим (растворение и кристаллизация) имеет следующие преимущества: - флотация проходит при...
-
Газов в гомологическом ряду нет. Это жидкости. Начиная с С12Н25ОН до С20Н41ОН - маслообразные и с С21Н43ОН -- твердые вещества. Ткип СН3ОН=65 °С, Ткип...
-
1. Спирты реагируют со щелочными металлами (Na, K и т. д.) с образованием алкоголятов: 2R--OH + 2Na 2R--ONa + H2 Реакция протекает не так бурно, как при...
-
Азотный кислота утилизация оксид Методы получения азотной кислоты Первый завод по производству HNO3 из аммиака коксохимического производства был пущен в...
-
Схема 1. Технологическая схема производства серной кислоты по методу ДК. 1-серная печь; 2- котел-утилизатор; 3- экономайзер; 4- пусковая топка;...
-
Известен способ получения мономерного формальдегида термической деполимеризацией низкомолскулярных полиоксиметиленов, получаемых при обработке водных...
-
При озонолизе наряду с другими продуктами образуется формальдегид, что указывает на наличие концевой метиленовой группы. При озонолизе концевых двойных...
-
Окисление природного газа и низших парафинов - Аналитический обзор получения формалина
Одним из способов получения формальдегида является окисление природного газа и низших парафинов. Данный способ с точки зрения доступности и дешевизны...
-
О-КРЕЗОЛ - Разработка технологической схемы получения анизола и крезола
C7H8O/CH3C6H4OH Молекулярная масса: 108.2 Температура кипения: 191°C Температура плавления: 31°C Относительная плотность (вода = 1): 1.05 Растворимость в...
-
Производство азотной кислоты - Анализ и технологическая оценка химического производства
Безводная азотная кислота HNO3--тяжелая бесцветная жидкость плотностью 1520 Кг/м 3 (при 15° С). Она замерзает при температуре --47° С и кипит при 85°С,...
-
Введение - Разработка технологической схемы получения анизола и крезола
Известно в некоторых случаях невозможно достичь высокой селективности химико-технологических процессов. Это происходит вследствие наличия побочных...
-
Реакция окисления углерода - Основы теории окислительной плавки
Основная составляющая шихты при выплавке стали - чугун - содержит в среднем 4%. В готовой стали содержание углерода в большинстве случаев исчисляется...
-
ПОЛУЧЕНИЕ ОБЖИГОВОГО ГАЗА ИЗ СЕРЫ. - Получение серной кислоты
При сжигании серы протекает необратимая экзотермическая реакция (II) с выделением очень большого количества теплоты: ?H = -362,4 кДж/моль, или в...
-
ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ПОЛУЧЕНИЯ МАЗЕЙ., ПРИГОТОВЛЕНИЕ МАЗЕЙ В АПТЕКАХ - Производство мазей
ПРИГОТОВЛЕНИЕ МАЗЕЙ В АПТЕКАХ Приготовление мазей в аптеках. В аптеках мази готовят по экстемпоральным прописям, которые в среднем в нашей стране...
-
Технологическая схема производства - Производство хлорида калия галургическим способом
Принципиальная технологическая схема приведена на рис. 2. Перед выщелачиванием сырую руду подвергают дроблению. В калийной промышленности в последние...
Производство формальдегида на серебряном катализаторе - Анализ способов получения глиоксаля и технологических схем окисления одноатомных спиртов