Сравнительный анализ методов производства формалина, Неполное окисление метана и его гомологов - Аналитический обзор получения формалина
В настоящее время производственные методы получения формальдегида большим разнообразием не отличаются. Так, в реакциях восстановления СО и СО2 Водой выход СН2О очень мал. Внимание химиков уже давно привлекала реакция гидрирования оксида углерода
СО+Н2 -СН2О (1)
Тем более, что эта реакция может рассматриваться как этап процесса получения метанола:
СО + 2Н2 >СН3ОН (2)
Однако термодинамический расчет показывает, что равновесие реакции (1) сильно смещено влево. Даже при давлении 100 МПа равновесная концентрация формальдегида не достигает 2%, а при 10 МПа и ниже измеряется сотыми и тысячными долями процента. Возможным выходом из термодинамических ограничений является быстрый и полный вывод образовавшегося формальдегида из зоны реакции. Основными промышленными методами получения формальдегида являются неполное окисление метана и его гомологов и окислительное дегидрирование метилового спирта.
Неполное окисление метана и его гомологов
На рисунке 1 показана схема получения формальдегида неполным окислением концентрированного метана кислородом воздуха с использованием в качестве-катализатора окислов азота (гомогенный катализ). Окисление проводят в реакторе трубчатого типа при температуре около 600 °С Трубки изготовлены из жароупорного сплава сихромаля и футерованы изнутри керамической массой (80% Si02, 20% А1203).
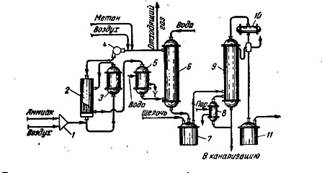
Рисунок 1 - Технологическая схема производства формальдегида окислением метана кислородом воздуха в присутствии гомогенных катализаторов (окислов азота): 1 - горелка; 2 - теплообменник; 3 - реактор; 4 - газодувка; 5 - водяной холодильник; 6 - водяной скруббер; 7 - емкость для нейтрализации раствора формальдегида; 8 - выносной кипятильник; 9 - ректификационная колонна; 10 - дефлегматор; 11 - сборник формалина.
Метан и воздух в объемном отношении 3,7: 1, предварительно подогретые до 400 °С в теплообменнике 2, поступают в реактор 3. Перед входом в реактор к газам добавляют 0,08 объемн. % паров азотной кислоты, образуемой в результате окисления аммиака кислородом воздуха в горелке 1. Продукты реакции охлаждаются в теплообменнике 2, а затем в водяном холодильнике 5 и поступают в скруббер 6, где формальдегид отмывают водой. Из верхней части скруббера 6 выходит газ, содержащий 12% СН4, 5% СО, 2% СО2, 6% О2 и 75% N2. Часть этого газа возвращают в реактор, так чтобы на 1 объем исходной смеси приходилось 9 объемов рециркулирующего газа.
Вытекающий из скруббера 6 водный раствор формальдегида с содержанием до 10% НСНО нейтрализуют в аппарате 7 щелочью для связывания муравьиной кислоты. Далее раствор подвергают ректификации под давлением 4 ат в колонне 9, где получают 34%-ный раствор формальдегида, содержащий 3 вес.% метилового спирта. Выход формальдегида составляет 38% от прореагировавшего метана [1].
Также формальдегид получают из метанола, диметилового эфира, природного и попутных газов (газа коксохимического производства и нефтепереработки).
Похожие статьи
-
Технологические свойства формалина - Аналитический обзор получения формалина
Формалин - 37% водный раствор формальдегида, в нем формальдегид присутствует в виде гидрата HCHO-H2O и низкомолекулярных полимеров...
-
Полимеризация двуокиси азота. Переработка нитрозных газов в азотную кислоту обычно происходит при температурах от О до 50 °С. В этих условиях двуокись...
-
Процессы окисления. - Методы очистки и получения коллоидных растворов
Наряду с серой в реакциях окисления обычно образуются политио-новые кислоты, главным образом пентатионовая кислота H2S5O6 Реакции двойного обмена....
-
Азотный кислота утилизация оксид Методы получения азотной кислоты Первый завод по производству HNO3 из аммиака коксохимического производства был пущен в...
-
Таблица 2 - Структура сырья в производстве метанола, %. Сырье В мире Беларусь и Россия Природный газ 73,8 70,7 Нефть и нефтепродукты 24,4 4,0 Отходы...
-
Введение., Способы получения перхлоратов - Производство перхлоратов в промышленности
Получение перхлората калия или перхлоратов вообще имеет большое значение для промышленности. Ведь перхлораты широко используются как в проведении...
-
Получение синтезированного газа - Анализ и технологическая оценка химического производства
Химические методы переработки нефти проводят при высоких температурах без катализатора (термический крекинг), при высоких температурах в присутствии...
-
Задачи и методы количественного анализа - Основы аналитической химии
Количественный анализ - это совокупность химических, физико-химических и физических методов определения количественного соотношения компонентов, входящих...
-
Качественные методы анализа - Разработка технологической схемы получения анизола и крезола
Рециркуляционных реакционно-ректификационных процессов. При анализе сложных ХТС, характеризующихся большим числом параметров и переменных необходимо...
-
Задачи и методы качественного анализа - Основы аналитической химии
Обнаружение или, как иногда говорят, "открытие" отдельных элементов или ионов, входящих в состав веществ - это задачи качественного анализа. Качественный...
-
Применение формалина - Аналитический обзор получения формалина
Формалин используется в производстве: - синтетических смол; - синтетического каучука; - поверхностно-активных веществ; - многоатомных спиртов; - формалей...
-
На хроматографической пластинке, покрытой закрепленным тонким слоем силикагеля, отмечают линию старта, на которую наносят каплю хлороформной вытяжки из...
-
Пероксид водорода представляет собой бесцветную вязкую жидкость с плотностью 1,46 г/см3, замерзающую при t = -0.48c и кипящую при t = 152c. В лаборатории...
-
Производство азотной кислоты - Анализ и технологическая оценка химического производства
Безводная азотная кислота HNO3--тяжелая бесцветная жидкость плотностью 1520 Кг/м 3 (при 15° С). Она замерзает при температуре --47° С и кипит при 85°С,...
-
Физико-химические закономерности получения продукта - Производство ацетона
Ацетон, применение которого можно отметить почти во всех сферах человеческой деятельности, имеет характерные физические свойства. Например, он оказывает...
-
Одно дерево бразильской гевеи в среднем, до недавнего времени, было способно давать лишь 2-3 кг каучука в год; годовая производительность одного гектара...
-
Это метод который нашел мировое применение для анализа лекарствнных средств. Он основан на свойстве галогенидов количественно осаждаться нитратом серебра...
-
Выбор метода производства (или выделение) готового продукта Современные методы производства азотной кислоты основаны на применении синтетического аммиака...
-
МЕТОДЫ СРАВНИТЕЛЬНОГО ШКАЛИРОВАНИЯ - Многомерный статистический анализ
Шкалирование методом попарного сравнения - Это метод сравнительного шкалирования, при котором респонденту дается два объекта для выбора по определенному...
-
Количественный анализ - это совокупность, химических, физико-химических и физических методов определения количественного соотношения компонентов,...
-
Схема 1. Технологическая схема производства серной кислоты по методу ДК. 1-серная печь; 2- котел-утилизатор; 3- экономайзер; 4- пусковая топка;...
-
Получение спиртов - Химические свойства и характеристики спиртов
Некоторые из показанных выше реакций (рис. 6,9,10) обратимы и при изменении условий могут протекать в противоположном направлении, приводя к получению...
-
Физические свойства. Очень чистые вещества бесцветные и очень устойчивые соединения. Получение: Диоксид щелочного металла получают путем быстрого...
-
Физические свойства Очень чистый Na2O2 бесцветен, обычно полученный продукт чуть желтоватого цвета. Tпл = 6750 c (разлагается). Гексагональная...
-
При использовании разомкнутых химико-технологических систем в большинстве случаев принципиально невозможно проведение процессов при практически полной...
-
Конденсационные методы получения коллоидных систем - Методы очистки и получения коллоидных растворов
Из классификации дисперсных систем по размеру частиц следует, что коллоидные растворы (золи) занимают промежуточное положе-ние между молекулярными и...
-
Методы очистки коллоидных растворов - Методы очистки и получения коллоидных растворов
При получении коллоидных растворов тем или иным методом, особенно с помощью химических реакций, практически невозможно точно предусмотреть необходимое...
-
Окисление органического вещества, Получение хлорной воды, Окисление фосфора - Свойства галогенов
При направлении струи хлора из газоотводной трубки на бумагу, смоченную скипидаром мы наблюдаем С10H16 + 8Cl2 > 10C + 16HCl Вывод: Окисление...
-
Один из способов повысить селективность - это правильно подобрать катализатор. Рассмотрим этот метод, на примере получения анизола и крезола. Анизол и...
-
В 1960-х годах разработан агрегат по производству азотной кислоты мощностью 120 тыс. т год под давлением 0,716 МПа с использованием высокотемпературной...
-
МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРНЫХ МЕМБРАН, Получение мембран из растворов полимеров - Полимеры в мембранах
Разделяющая способность мембран, их производительность и стабильность характеристик зависят не только от химической природы полимера, но и от хитростей...
-
Процесс получения винилхлорида сбалансированным методом из этилена состоит из шести стадий: 1. синтез 1,2-дихлорэтана прямым жидкофазным хлорированием...
-
Синтезы на основе ацетилена - Анализ и технологическая оценка химического производства
Ацетилен СН=СН -- газ, легко вступающий в самые различные химические реакции с образованием многочисленных соединений, используемых при получении...
-
Производство полимеров - Анализ и технологическая оценка химического производства
Высокомолекулярные соединения получают из мономеров полимеризацией, сополимеризацией, поликонденсацией и методами привитой полимеризации и...
-
КОНТАКТНЫЙ МЕТОД ПОЛУЧЕНИЯ СЕРНОЙ КИСЛОТЫ. - Получение серной кислоты
Рассмотрим процесс получения серной кислоты контактным методом из двух видов сырья: серного (железного) колчедана и серы. Получение H2SO4 из колчедана....
-
Численный сравнительный анализ - Ранговый метод оценивания параметров регрессионной модели
Итак, в рамках данной работы рассматриваются такие распределения случайных величин, как распределения Гаусса и Лапласа, треугольное распределение...
-
Сравнение методов получения хлорида калия - Производство хлорида калия галургическим способом
Флотационный метод обогащения по сравнению с галургическим (растворение и кристаллизация) имеет следующие преимущества: - флотация проходит при...
-
Особенности анализа органических соединений
Особенности анализа органических соединений: - Реакции с органическими веществами протекают медленно с образованием промежуточных продуктов. -...
-
1. Спирты реагируют со щелочными металлами (Na, K и т. д.) с образованием алкоголятов: 2R--OH + 2Na 2R--ONa + H2 Реакция протекает не так бурно, как при...
-
Получение, Физические свойства, Химические свойства - Кальций и его биологическая роль
Свободный металлический кальций получают электролизом расплава, состоящего CaCl2 (75-80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим...
Сравнительный анализ методов производства формалина, Неполное окисление метана и его гомологов - Аналитический обзор получения формалина