Буферні розчини, їх склад і суть дії - Теоретичні основи аналітичної хімії
Буферними розчинами Називають розчини су мушу слабкої кислоти (або слабкої основи) і її солі. Такою, наприклад, є суміш оцтової кислоти і ацетату натрію.
При дії на буферний розчин сильної кислоти або сильної основи змінюється концентрація слабкої кислоти. Проте рН розчину практично не змінюється. Отже, і концентрація водневих іонів буферної суміші під впливом сильної основи або сильної кислоти практично не змінюється.
У хімії, біології, медицині, у промисловому виробництві в результаті тих чи інших процесів часто можуть поглинатись або виділятись водневі іони. Щоб процес відбувався при сталому значені рН, у розчин вводять буферні суміші, які поглинають водневі або гідроксильні іони, і значення рН розчину практично не змінюється.
Слабкі кислоти (слабкі основи), які є складовими частинами буферних сумішей, у водних розчинах частково дисоціюють на іони. У розчині буферної суміші, крім вільної слабкої кислоти, є ще її сіль, яка практично повністю дисоціює на іони. Аніони, які утворюються в результаті дисоціації солі, значно зменшують дисоціацію слабкої кислоти. Тому можна допустити, що в розчинах суміші слабкої кислоти і її соді концентрація аніонів практично дорівнюватиме концентрації солі: [A-] = Cc. З другого боку, справедливим буде також припущення, що концентрація недисоційованих молекул практично дорівнюватиме загальній концентрації кислоти: [HA] = Ck
Тому:
РН = рКк+lg (Cc/Ck)
З рівняння: рН буферного розчину залежить лише від співвідношення концентрації солі й кислоти і не залежить від розведення.
Буферні розчини використовують в якісному аналізі, коли треба провести реакцію за цілком певної величини концентрації водневих іонів.
Буферними сумішами є розчини ацетату натрію і оцтової кислоти, гідроксиду і хлориду амонію, борної кислоти й борату натрію, одно - і двозаміщених фосфатів калію, винної або лимонної кислот та їх солей тощо.
Для кількісного аналізу буферні розини мають велике значення у випадку з титруванням слабких основ і слабких кислот, бо в цих випадках наприкінці титрування утворюються солі слабких кислот або основ і трохи вільної кислоти або вільної основи.
При використанні буферних сумішей треба звертати увагу на концентрацію компонентів, що входять до їх складу. Кожний буферний розчин має певну буферну ємність, яка характеризується здатністю цього розчину зберігати сталу величину рН при добавлянні кислот або лугів. Мірою буферної ємності є кількість еквівалентів кислоти (або лугу), яку треба добавити, що величина рН 1л буферного розчину змінилася на одиницю. Велику буферну ємність мають розчини з високою концентрацією слабкої кислоти та її солі; для цього потрібно також, щоб співвідношення концентрацій цієї кислоти і солі було близьким до одиниці.
Властивості буферних розчинів:
-чим менша концентрація солі в буферній суміші, тим менше сильної кислоти треба добавляти для повного зв'язування аніонів солі. Після повного зв'язування аніонів солі в молекули, буферна суміш втрачає свою буферну здатність протистояти дії сильних кислот;
Обчислення рН розчину (обчилюється геометричним методом)
1. Слабкі кислоти:
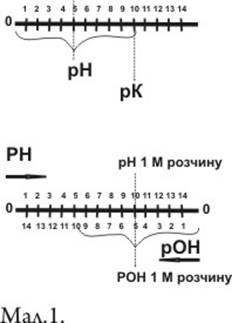
РН = (0+рК)/2 - рН - геометричне місце між точками 0 і рК (мал..1,а)
2. Слабкі основи:
РОН 1 н. розчину слабкої основи буде геометричним місцем між точками 0 і рК основи (мал..1,б)
Знаючи рОН, обчислюють рН=14-рОН.
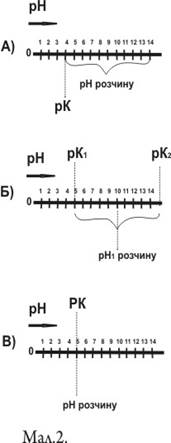
3. Розчин середньої солі слабкої кислоти:
РН = (14+рК)/2 - рН 1 н розчину - геометрична точка між 14 і рКк, (мал..2,а)
4. Розчин кислої солі:
РН = (рК 1+рК 2)/2 - рН - середина між рК 1 і рК 2. (мал..2,б).
5. Розчини буферної суміші (концентрація вільної кислоти дорівнює концентрації солі):
РН буде в точці рК (мал..2,в)
Застосування буферних розчинів
Буферні розчини використовуються в аналітиці для проведення реакцій окислення-відновлення, осадження сульфідів, гідроокисів, карбонатів, хроматів, фосфатів та інш. Наприклад:
- 1. Ацетатний буфер (pH?5) застосовують для осадження осадів, що не осаджуються у кислих та лужних розчинах. 2. Форміатний буфер (HCOOH+HCOONa, pH ? 2) застосовують для виділення іонів цинку, що осаджуються у вигляді ZnS при наявності іонів Co2+, Mn2+, Ni2+, Fe2+, Al3+, Cr3+. 3. Аміачно-амонійний буфер (pH ? 9) використовують для осадження сульфідів Ni2+, Co2+, Zn2+, Mn2+ та інш.
Похожие статьи
-
Обчислення [H+], [ОH-], рН, рОН розчинів - Теоретичні основи аналітичної хімії
Концентрація водневих іонів розчинів кислот і основ. Сильні кислоти - Це кіслоти, які в розведених розчинах практично повністю дисоціюють на іони. У...
-
Електролітична дисоціація води. Водневий показник рН - Теоретичні основи аналітичної хімії
Електролітична дисоціація. Розчинення речовини є першим етапом аналізу. Розчинником звичайно є вода. Це пояснюється не тільки великою поширеністю воли в...
-
Класифікація методів аналізу - Теоретичні основи аналітичної хімії
Хімічні й фізико хімічні методи аналізу. Загальна схема хімічних і фізико-хімічних методів аналізу зводиться до того, що досліджувану речовину переводять...
-
Предмет аналітичної хімії - це методи визначення хімічного складу речовин . Аналітична хімія має два основних розділи - якісний та кількісний аналіз....
-
Нехай ми маємо вибірку значень випадкової величини Х= x1, x2, .... xN, з кількістю спостережень - N. Розіб'ємо весь діапазон можливих значень...
-
Теоретичні основи оптимізаційних рішень Умови оптимальності у формі принципу максимуму дають, узагалі говорячи, достатню інформацію для рішення задачі...
-
Об'єктом дослідження послужив сучасний осад мінералізований відібраний в літній час по глибині мулової колонки в інтервалі 50-100 см (мінералізація води...
-
Сировина для виробництва поліетилену Поліетилен виробляється з етилену, який, у свою чергу може бути отриманий різними методами, зокрема термічним...
-
Складні ліпіди, Основні реакції ліпідів - Будова та класифікація ліпідів
Фосфоліпіди (фосфатиди). Характерною особливістю цієї групи ліпідів є наявність в їх молекулі залишків фосфорної кислоти (СН3РО4) і азотистої основи....
-
Матриці. Дії над матрицями Матриця вперше з'явилась в середині ХІХ століття в роботах англійських математиків У. Гамільтона і А. Келі [У. Гамільтон,...
-
Реакції іонного обміну - Дисоціація
Кожна хімічна властивість, що проявляється сильними електролітами в розчинах - це властивість іонів, на які він розпався. А тим часом реакції обміну між...
-
СУЛЬФАТНА КИСЛОТА - Неметали та їхні сполуки
Сульфатна кислота H2SO4 (безводна, 100% - ва) - важка безбарвна оліїста рідина. Густина її концентрованого розчину (w(H2SO4) == 98%) за звичайних умов...
-
Готуємо розчин НСІ з С = 0,1 моль/дм3 об'ємом 1 дм3 з фіксаналу, у відповідності з правилами, наведеними вище. Стандартизація приготовленого розчину...
-
СУЛЬФАТНА КИСЛОТА - Загальні відомості про елементи
Сульфатна кислота H2SO4 (безводна, 100 %-ва) --важка безбарвна оліїста рідина. Густина її концентрованого розчину (w(H2SO4) == 98 %) за звичайних умов...
-
Хімічний склад маргарину - Характеристика харчової цінності жирів
На відміну від олії і тваринних топлених жирів, які мають природній жирнокислотний склад і біологічно активні речовини, маргарин моделюється, виходячи з...
-
З'ясування впливу автокореляції даних на точність економічного прогнозу за допомогою коефіцієнта Дарбіна-Уотсона Одним з основних припущень класичного...
-
Застосування парної лінійної регресії до прогнозування економічних показників Прогноз - це ймовірностне, науково обгрунтоване судження щодо перспектив,...
-
Хімічний склад твердих топлених жирів - Характеристика харчової цінності жирів
За біологічною цінністю тваринні топлені жири поступаються оліям, це зумовлено меншим вмістом в них поліненасичених незамінних біологічно цінних жирних...
-
Теоретичні відомості - Вивчення математичного пакету MathСad
Засоби редагування + - хрестоподібний курсор; використовується для розміщення нових виразів, графіків тощо на новому місці; L - маркер введення;...
-
Похідна. Її фізична (механічна) і геометрична інтерпретація - Основи вищої математики
І. Вважаючи, що X 0, розглянемо в даній фіксованій точці " Х " відношення приросту функції в цій точці до відповідного приросту аргументу Х . (7.1) (7.1)...
-
Диференціал, Визначення диференціала. - Основи вищої математики
Визначення диференціала. Формули й правила диференціювання. Використання диференціала для наближених обчислень. Основні теореми диференціального...
-
Точки розриву і їхня класифікація. Теореми про безперервні функції - Основи вищої математики
Якщо функція F така, що для неї існують межі F ( А +0) і F ( А --0), однак F ( А ) F ( А +0) F ( А --0), то, мабуть, вона нерозривна (не безперервна) у...
-
Теореми про межі. Чудові межі - Основи вищої математики
Будемо розглядати сукупність функцій, які залежать від того самого аргументу Х , при цьому Ха або Х . Доведення проводиться для одного із цих випадків,...
-
Нескінченно мала й нескінченно велика величини - Основи вищої математики
Визначення . Змінна N , що має межу рівну 0, називається нескінченно малою величиною, якщо для кожного > 0 знайдеться n 0 таке, що | N |< ( N > N 0) ....
-
Межа функції - Основи вищої математики
Розглянемо деякі випадки зміни функції або прагнення аргументу Х до деякої межі " А " або до. Визначення 1: Нехай функція y=f(х) визначена в деякій...
-
Системи лінійних алгебраїчних рівнянь - Основи вищої математики
1. Будемо розглядати систему з "m" лінійних алгебраїчних рівнянь із "n" невідомими (8.1) Рішенням такої системи називається такий набір чисел Х 1, Х 2,...
-
Визначення : Скалярний добуток двох векторів і дорівнює добутку модулів цих векторів на косинус кута між ними . (6.1) Таким чином, скалярний добуток двох...
-
Значення хімії у створенні нових матеріалів
Нові матеріали потрібні для квантових генераторів, лазерів, які породжують могутні промені, здатні різати, плавити, випаровувати, свердлити і посилати...
-
Поверхность палетки - Сравнение методов вычисления объемов насыпных складов и отвалов
Метод палетки предназначен, главным образом, для построения модели поверхности, а не для расчета объемов. Для детального отображения поверхности нужна...
-
ВУГЛЕКИСЛИЙ ГАЗ ТА ЙОГО ВЛАСТИВОСТІ - Склад повітря
Вивчаючи "Склад повітря" ми проводили дослід, зображений на малюнку 41. Через те, що вапняна вада помутніла ми зробили висновок, що у повітрі є...
-
Отличие результата вычисления объема путем представления его в виде суммы призм, от результата вычисления объема путем простого усреднения всех высотных...
-
Рассмотрим случай, когда граница раздела проходит по хребту, т. е. высотные отметки точек на границе имеют максимальные значения среди всех остальных...
-
Алюминий - самый распространенный в земной коре металл. На его долю приходится 5,5-6,6 мол. доли % или 8 масс. %. Главная масса его сосредоточена в...
-
Для аналізу відбираємо проби різних мінеральних вод в об'ємі 100 см3 за допомогою мірної колби. Переносимо в конічну колбу на 250 см3, додаємо 5 см3...
-
Фізичні властивості, ХІМІЧНІ ВЛАСТИВОСТІ - Амінокислоти: одержання, властивості, роль у біології
Амінокислоти-безбарвні кристалічні речовини з високими температурами плавлення, які мало відрізняються для цих кислот і тому не характерні. Плавлення...
-
Гідроліз солей - Електролітична дисоціація солей та лугів
Як вам відомо, солі утворюються в результаті нейтралізації кислот і основ. Можна припустити, що розчин солей на відміну від розчинів кислот і лугів,...
-
Рівняння дисоціації кислот, лугів і солей - Дисоціація
Електролітичну дисоціацію виражають рівняннями, як і будь-які інші хімічні реакції. Записуючи ці рівняння, звичайно не зазначають формул молекул води,...
-
Рівняння дисоціації кислот, лугів і солей - Електролітична дисоціація солей та лугів
Електролітичну дисоціацію виражають рівняннями, як і будь-які інші хімічні реакції. Записуючи ці рівняння, звичайно не зазначають формул молекул води,...
-
Стандартизація робочого розчину Трилону Б - Питні мінеральні води
Точну концентрацію розчину Трилону Б можна визначити шляхом титрування розчинами хімічно чистих речовин: магній сульфату, кальцій хлориду або металевим...
-
Засоби вимірювання - мірні колби на 50, 100, 250 см3; - терези аналітичні та важки до них; - терези технохімічні та важки до них; - циліндри на 10, 25...
Буферні розчини, їх склад і суть дії - Теоретичні основи аналітичної хімії