Хімічні властивості - Загальна характеристика, номенклатура та ізомерія оксигеновмісних органічних сполук
Реакції, в які вступають спирти, супроводжуються розривом зв'язків О-Н або С-О.
1. Кислотні властивості спиртів. Утворення алкоголятів.
Спирти не змінюють колір лакмусового паперу, проте виявляють слабкі кислотні властивості. Кислотний характер спиртів обумовлений високою полярністю зв'язку в гідроксильній групі. Атом Оксигену, як більш електронегативний, зміщує на себе спільну пару електронів від атома Гідрогену; на останньому виникає частковий позитивний заряд:
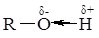
Спирти взаємодіють з лужними металами, утворюючи Алкоголяти:
2СН3СН2ОН + 2Na > 2СН3СН2ONa + Н2-
Натрій етилат
Під дією води алкоголяти розкладаються з утворенням спирту та лугу, оскільки вода виявляє сильніші кислотні властивості:
СН3СН2ОNa + H2O > СН3СН2OH + NaOH
З лугами спирти практично не взаємодіють, оскільки серед продуктів реакції з'являється вода, яка розкладає утворений алкоголят:
СН3СН2ОH + NaOH - СН3СН2ONa + H2O
Для зміщення рівноваги в бік утворення алкоголяту, з реакційної суміші слід видаляти воду.
2. Взаємодія з карбоновими кислотами.
При нагріванні спиртів з карбоновими кислотами в присутності концентрованої сульфатної кислоти утворюються естери (складні ефіри).
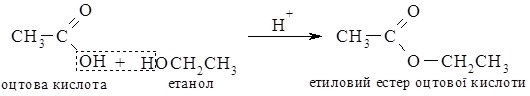
Це - Реакція еcтерифікації.
3. Взаємодія з галагеноводнями.
При взаємодії спиртів з галогеноводневими кислотами відбувається заміщення гідроксильної групи на атом галогену.
СН3СН2ОН + HCl > СН3СН2Cl + Н2O
Хлоретан
4. Дегідратація спиртів.
Залежно від умов реакції, відщеплення молекули води може відбуватися внутрішньомолекулярно або міжмолекулярно. Внутрішньо-молекулярна дегідратація спиртів відбувається за температури близько 1800 С у присутності концентрованих сульфатної або фосфатної кислот, алюміній оксиду. При цьому утворюються алкени.
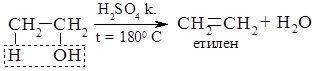
При нижчій температурі та наявності каталітичної кількості мінеральної кислоти відбувається міжмолекулярна дегідратація:

В результаті відщеплення молекули води від двох молекул спирту, утворюються Етери.
Етери - органічні сполуки, у молекулах яких два вуглеводневих радикали з'єднані між собою через атом Оксигену. Їх загальна формула R-O-R.
Діетиловий етер або ефір (С2Н5ОС2Н5) одна із перших речовин, яку почали застосовувати у медицині, як препарат для загального наркозу. Ще у 1832 р. Лонг (США) застосував ефір як анестезуючий засіб при хірургічних втручаннях.
5. Реакції окиснення. Первинні, вторинні та третинні спирти окиснюються по-різному. Первинні та вторинні спирти легко окиснюються з утворенням карбонільних сполук - відповідно альдегідів чи кетонів. Як окисники використовують калій перманганат або хромову суміш, які оксинюють спирти вже за кімнатної температури.
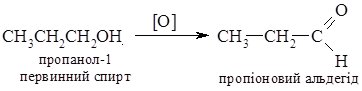
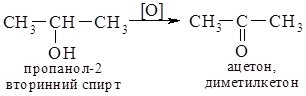
Третинні спирти за цих умов не окиснюються. В більш жорстких умовах оксиснення супроводжується розривом С-С зв'язків з утворенням суміші карбонових кислот.
При горінні спиртів утворюється карбон (IV) оксид та вода:
С2Н5ОН + 3О2 > 2СО2 + 3Н2О
Похожие статьи
-
1. Гідроліз галогенопохідних. При обробці галагенопохідних водним розчином лугу, іде заміщення галогену на гідроксил. СН3СН2Br + NaOH > СН3СН2OH +...
-
Загальна формула одноатомних спиртів R-OH. Залежно від того, з яким атомом Карбону (первинним, вторинним чи третинним) зв'язана гідроксильна група,...
-
Вступ - Загальна характеристика, номенклатура та ізомерія оксигеновмісних органічних сполук
Всі органічні речовини передусім складаються з атомів карбону і гідрогену. Але, поряд з тим, відомо багато речевин містить також атоми оксигену. Із...
-
Горіння простих і складних речовин: А) С + О2 СО2 2Сu + O2 = 2CuO (окислення, крім благородних металів) Б) СН4 + 2О2 СО2 + 2Н2О 2. Розклад під час...
-
Фізичні та хімічні властивості - Натрій: історія, властивості
Фізичні властивості. Оскільки в атомах лужних металів один зовнішній електрон доводиться на 4 і більше вільні орбіталі, а енергія іонізації атомів...
-
Оксиди, їх класифікація. Номенклатура - Оксиди, загальна характеристика
Оксидами називаються складні речовини, до яких входять два елементи, один з яких оксиген. Майже всі хімічні елементи утворюють оксиди. І досі ще не...
-
ЙОД Сировиною для промислового одержання йоду служать нафтові бурові води, морські водорості, а також маткові розчини чилійської (натрієвої) селітри, що...
-
ХІМІЧНІ ВЛАСТИВОСТІ КИСНЮ І СІРКИ - Неметали та їхні сполуки
Ви вже знаєте, що кисень - дуже реакційноздатна речовина. Він реагує з багатьма металами, неметалами багатьма складними речовинами, виявляючи властивості...
-
Фізичні властивості, ХІМІЧНІ ВЛАСТИВОСТІ - Амінокислоти: одержання, властивості, роль у біології
Амінокислоти-безбарвні кристалічні речовини з високими температурами плавлення, які мало відрізняються для цих кислот і тому не характерні. Плавлення...
-
Вступ - Типові неметали - галогени, їх характеристика, властивості і сполуки
До головної підгрупи VII групи періодичної системи елементів Д. І. Менделєєва входять: Фтор F, Хлор Cl, Бром Br, Йод J та Астат At. Загальна назва цієї...
-
ХІМІЧНІ ВЛАСТИВОСТІ КИСНЮ І СІРКИ - Загальні відомості про елементи
Ви вже знаєте, що кисень -- дуже реакційноздатна речовина. Він реагує з багатьма металами, неметалами багатьма складними речовинами, виявляючи...
-
АМІНОКИСЛОТИ, ІЗОМЕРІЯ. НОМЕНКЛАТУРА - Амінокислоти: одержання, властивості, роль у біології
Органічні сполуки, що містять в молекулі карбоксильну та аміно групи, називають - амінокислотами. Амінокислоти мають надзвичайно велике значення в...
-
ЙОД ЙОД - І хімічний елемент VII групи періодичної системи Менделєєва, належить до галогенів (у літературі зустрічається також символ J); атомний номер...
-
СПГ зберігається в спеціальних кріоцістернах, влаштованих за принципом посудини Дюара. Транспортується СПГ на спеціалізованих морських суднах - танкерах,...
-
Номенклатура спиртов - Химические свойства и характеристики спиртов
Для распространенных спиртов, имеющих простое строение, используют упрощенную номенклатуру: название органической группы преобразуют в прилагательное (с...
-
Понятие и классификация спиртов СПИРТЫ (алкоголи) - класс органических соединений, содержащих одну или несколько группировок С-ОН, при этом гидроксильная...
-
ЗАГАЛЬНА ХАРАКТЕРИСТИКА ОКСИГЕНУ І СУЛЬФУРУ - Неметали та їхні сполуки
Історичні відомості. Про історію відкриття кисню, молекули якого складаються з елемента Оксигену, ви довідалися ще у 8 класі. Тепер ознайомтеся з деякими...
-
Хімічні сполуки титану - Титан та його властивості
З одновалентними галогенами (фтором, бромом, хлором і йодом) він може утворювати ди - три - і, тетраз'єднання, із сіркою й елементами її групи (селеном,...
-
ЗАГАЛЬНА ХАРАКТЕРИСТИКА ОКСИГЕНУ І СУЛЬФУРУ - Загальні відомості про елементи
Історичні відомості. Про історію відкриття кисню, молекули якого складаються з елемента Оксигену, ви довідалися ще у 8 класі. Тепер ознайомтеся з деякими...
-
Применение спиртов - Химические свойства и характеристики спиртов
Способность спиртов участвовать в разнообразных химических реакциях позволяет их использовать для получения всевозможных органических соединений:...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Загальна характеристика ТОВ "Цегельний завод ім. М. Г Миндру" Загальні положення Товариство з обмеженою відповідальністю "Цегельний завод ім. М. Г...
-
Висновок - Типові неметали - галогени, їх характеристика, властивості і сполуки
Всі галогени дуже отруйні. Вдихання їхньої пари викликає подразнення органів дихання, а у великих кількостях вони викликають задуху. Особливо отруйним є...
-
Загальна характеристика прийнятого методу оцінки проектних рішень і його основних показників Головною метою розрахунку показників економічної...
-
Загальна характеристика інформаційного забезпечення Інформаційне забезпечення будь-якої системи являє собою методи класифікації та кодування інформації,...
-
Властивості природного газу - Зріджений природний газ: його характеристика
У природному стані газ представлений у вигляді окремих скупчень. Їх прийнято називати газовими покладами, які накопичуються в земних надрах, як газові...
-
Загальна характеристика підприємства ТОВ "МегаТоп" є спеціалізованим підприємством з виробництва спеціальних видів взуття. Виробництво зазначеного взуття...
-
ТЕОРЕТИЧНА ЧАСТИНА, Характеристика досліджуваного об'єкту - Питні мінеральні води
Титрування кальцій магній мінеральний Характеристика досліджуваного об'єкту Питні мінеральні води - як правило підземні води, що характеризуються...
-
Водораствроримые витамины Большинство водорастворимых витаминов, поступающих с пищей или синтезируемых кишечными бактериями, проявляют активность после...
-
Или N экв.1=n экв.2 для газообразных ве-в наряду с понятием молярного V (22,4 моль/л), исп-ся понятие - молярный объем эквивалента-это V одного моль...
-
Хімічний склад маргарину - Характеристика харчової цінності жирів
На відміну від олії і тваринних топлених жирів, які мають природній жирнокислотний склад і біологічно активні речовини, маргарин моделюється, виходячи з...
-
Порівняльна характеристика харчової цінності жирів - Характеристика харчової цінності жирів
Порівняно з іншими продуктами жири мають найвищу калорійність і є основним джерелом енергії. Енергетичні витрати людини забезпечуються за рахунок жирів...
-
Это метод который нашел мировое применение для анализа лекарствнных средств. Он основан на свойстве галогенидов количественно осаждаться нитратом серебра...
-
ШЛЯХИ ОТРИМАННЯ АМІНОКИСЛОТ - Амінокислоти: одержання, властивості, роль у біології
Розроблено багато шляхів отримання - амінокислот. Найважливіші з них три: 1. Дія аміаку на солі хлорзамісних кислот:...
-
1. Спирты реагируют со щелочными металлами (Na, K и т. д.) с образованием алкоголятов: 2R--OH + 2Na 2R--ONa + H2 Реакция протекает не так бурно, как при...
-
Нехай функція F (х) задана на відрізку [a, b] . Розіб'ємо цей відрізок на N частин точками ділення А = х0 < x1 < x2 < ... < хn = b У кожному...
-
КАУЧУК І ГУМА, ДЖЕРЕЛА НАТУРАЛЬНОГО КАУЧУКУ, ВЛАСТИВОСТІ КАУЧУКУ - Каучук і гума
Каучук - речовина, що одержується з каучуконосних рослин, що ростуть у тропіках і утримуючих молочну рідину (латекс) у коренях, стовбурі, гілках, чи...
-
Фізичні і механічні властивості титану - Титан та його властивості
Титан дуже тугоплавкий метал. Довгий час вважався, що він плавиться при 1800° С, однак у середині 50-х рр. англійські вчені Діардорф і Хейс установили...
-
Їдкі луги - Натрій: історія, властивості
Їдкими лугами називаються добре розчинні у воді гідроксиди. Найважливіші з них NaOH і KOH. Гідроксид натрію - білий, непрозорий, тверда кристалічна...
-
Визначення : Скалярний добуток двох векторів і дорівнює добутку модулів цих векторів на косинус кута між ними . (6.1) Таким чином, скалярний добуток двох...
Хімічні властивості - Загальна характеристика, номенклатура та ізомерія оксигеновмісних органічних сполук