Выбор системы электродов для проведения анализа, Выбор индикаторных электродов для химических реакций разного типа - Электрохимические методы анализа
В каждом конкретном случае проведения анализа с использованием метода потенциометрии химик-аналитик должен обоснованно выбрать электродную систему.
Индикаторный электрод выбирается в соответствии с требованиями к нему и в зависимости от:
- § типа химической реакции; § природы определяемых ионов.
Электрод сравнения выбирается в соответствии с требованиями к нему. В аналитической химии чаще всего в такой роли используют Хлоридсеребряный электрод. Он выпускается серийно, входит в комплект к прибору и представляет собой электрод II рода. Основные сведения о нем приведены в табл.2.
Таблица 2 Основные сведения о хлоридсеребряном эдектроде
|
Схема электрода: |
Ag, AgCl / KCl (нас.) |
|
Электродная реакция: |
AgCl + з = AgO +Cl- |
|
Уравнение Нернста: |
Выбор индикаторных электродов для химических реакций разного типа
1. Кислотно-основное титрование, определение рН раствора.
В этом случае индикаторный электрод должен реагировать на активность ионов Н+ (или величину рН раствора). К таким электродам относится, Например, стеклянный электрод.
2. Окислительно-восстановительное титрование, определение потенциала раствора.
В этом случае в качестве индикаторных используют металлические инертные электроды. Они выполняют роль переносчиков электронов. Например, при титровании раствора Со2+ раствором K3[Fe(CN)6] протекает реакция:
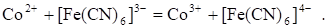
Индикаторным электродом является инертный платиновый электрод. Его потенциал До т. э. определяется наличием пары Co3+/Co2+, т. к. в растворе имеется еще неоттитрованный Co2+ и образовавшийся продукт реакции - Co3+. Следовательно, уравнение Нернста для платинового электрода до т. э. запишется в виде
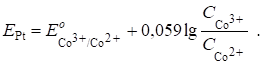
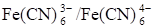
После т. э. в растворе образуется новая окислительно-восстановительная пара - - за счет наличия продукта реакции и появления избытка титранта. Теперь она определяет потенциал платинового электрода:
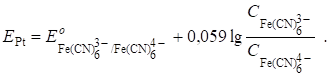
3. Осадительное титрование.
В этом случае в качестве индикаторных используют электроды, обратимые к определяемому иону или к титранту:
- § электроды I рода; § электроды II рода; § ИСЭ.
Например, для титрования ионов Cl - раствором AgNO3 можно взять серебряный электрод Ag/Ag+ (электрод I рода, реагирует на активность ионов титранта Ag+) или хлоридсеребряный электрод Ag, AgCl / KCl (электрод II рода, реагирует на активность определяемых ионов Cl-).
Кроме того, при проведении осадительного титрования можно воспользоваться инертным платиновым электродом, если искусственно создать в растворе окислительно-восстановительную пару. Например, при титровании раствора Zn2+ раствором K4[Fe(CN)6] протекает реакция осаждения:
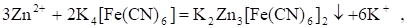
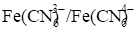
В ходе которой ни один элемент не меняет степени окисления, т. е. ни одной окислительно-восстановительной пары в растворе нет и платиновый электрод использовать невозможно. Но если добавить в раствор до начала титрования немного K3[Fe(CN)6], то в нем появляется Пара . При титровании концентрация одного из компонентов (K3[Fe(CN)6]) остается постоянной, а концентрация другого компонента (K4[Fe(CN)6]) меняется. Следовательно, меняется отношение их концентраций и потенциал платинового электрода тоже будет меняться.
4. Комплексометрическое титрование.
В этом случае в качестве индикаторных используют электроды, обратимые к определяемому иону:
- § электроды I рода; § ИСЭ.
Кроме того, так же, как и при проведении осадительного титрования, можно воспользоваться инертным платиновым электродом, если искусственно создать в растворе окислительно-восстановительную пару. Например, при титровании ионов Fe3+ раствором комплексона III в раствор вводят немного Fe2+ и берут платиновый электрод.
Похожие статьи
-
Электроды в потенциометрии. Назначение - Электрохимические методы анализа
Электроды, которые используются в потенциометрии, различаются по Назначению и по Принципу действия . В зависимости от назначения электроды бывают...
-
Если ИСЭ погрузить в раствор, содержащий определяемые ионы А, то на внешней и внутренней поверхности мембраны будет происходить обмен ионами А: А(м)...
-
Электроды в потенциометрии. Принцип действия - Электрохимические методы анализа
В зависимости от принципа действия различают Электронообменные (металлические) и Мембранные (ионоселективные) электроды. Сравнительная характеристика...
-
Стеклянный электрод - Электрохимические методы анализа
Одним из ионоселективных электродов, очень широко используемым в аналитической практике, является Стеклянный электрод . Стеклянный электрод - это ИСЭ,...
-
Потенциометрия, Способы проведения анализа в потенциометрии - Электрохимические методы анализа
Метод возник в 1893 г., когда немецкий химик Р. Беренд впервые провел потенциометрическое титрование. Потенциометрический метод анализа основан на...
-
Кривые кондуктометрического титрования - Электрохимические методы анализа
В ходе титрования электропроводность будет заметно меняться, если вводить или удалять ионы с высокой подвижностью. Чаще всего продуктом реакции является...
-
Кондуктометрическое титрование - Электрохимические методы анализа
Сущность метода заключается в том, что измеряют электрическую проводимость раствора в ходе титрования и строят кривую титрования. Кривая титрования...
-
Прямая кондуктометрия - Электрохимические методы анализа
Сущность метода Прямой кондуктометрии заключается в том, что концентрацию вещества определяют по результатам измерения электрической проводимости (или...
-
Ионоселективные электроды - Электрохимические методы анализа
Ионоселективные электроды (ИСЭ) - это датчики, позволяющие избирательно определять активность одних ионов в присутствии других. ИСЭ состоят из следующих...
-
При кипячении с разведенной хлороводородной кислотой происходит процесс гидролиза с образованием бензгидрола: Обнаружение димедрола методом ТСХ....
-
Выбор оптимальных условий проведения реакций - Химическая кинетика, равновесия, термодинамика
Если наша цель - получить максимальный выход продукта за определенное небольшое время, а реакция медленная и обратимая, то нужно одновременно учитывать...
-
Электрохимические процессы, Электродный потенциал - Систематика химических элементов
Электродный потенциал Электрохимические процессы - Это процессы взаимного превращения химической и электрической форм энергии. Их можно разделить на две...
-
Полярографический метод анализа
Полярография -- метод качественного и количественного химического анализа, основанный на получении кривых зависимости величины тока от напряжения в цепи,...
-
Методы кондуктометрии - Электрохимические методы исследования
Контактные методы. Измерения проводят с помощью контактных ячеек (рис. 3, а). При этом используют электроды из Pt, Ti, нержавеющей стали и др. Для...
-
Кондуктометрия, Основные узлы приборов - Электрохимические методы анализа
Кондуктометрия является старейшим, самым простым и наименее селективным из электрохимических методов анализа. Метод возник в 1885 г., когда Кольрауш...
-
Алгоритмы метода Монте-Карло для решения интегральных уравнений второго рода Пусть необходимо вычислить линейный функционал , Где, причем для...
-
Реакция с реактивом Марки. К сухому остатку на фарфоровой чашке добавляют 1 каплю реактива Марки, наблюдают лимонно-желтое окрашивание, переходящее при...
-
Этаминал-натрий дает фиолетовую окраску с солями кобальта и изопропиламином. Выполнение реакции. К 2 мл хлороформного раствора исследуемого вещества...
-
Время, отведенное на лекции - 2 часа. Цель лекции: Формирование знаний студентов об осадительном титровании, классификация методов титрования и...
-
Основные электрохимические характеристики ИСЭ - Электрохимические методы анализа
Основными Электрохимическими характеристиками любого ИСЭ являются: § интервал выполнения электродной функции; § крутизна электродной функции; § предел...
-
Составление химических реакций и проведение опытов в фармакологии
Задание 1. Назовите процесс, который происходит с субстанцией "Цинка сульфата" при ее неправильном хранение. Укажите, как повлияет этот процесс на...
-
Задачи и методы количественного анализа - Основы аналитической химии
Количественный анализ - это совокупность химических, физико-химических и физических методов определения количественного соотношения компонентов, входящих...
-
Количественный анализ - это совокупность, химических, физико-химических и физических методов определения количественного соотношения компонентов,...
-
Методы получения и химические свойства спиртов - Типы связей в органической химии
Спирты - это производные углеводородов, в которых один или несколько атомов водорода замещены на соответствующее число гидроксильных групп (-ОН). Общая...
-
Основные условия проведения реакции иода с тиосульфатом. - Йодометрия
Заключительным этапом многих йодометрических определе-ний является реакция титрования иода тиосульфатом натрия. Йодометрические титрования выполняют на...
-
Допустим, реакция aA + bB <> хХ + yY - гомогенная и идет в одну стадию. Тогда скорость прямой реакции vПр = KПр [A]A{B]B, а скорость обратной...
-
(а) Зависят ли энергия активации и предэкспоненциальный множитель от природы реагентов? от их концентраций? от температуры? от присутствия посторонних...
-
Конденсационные методы получения коллоидных систем - Методы очистки и получения коллоидных растворов
Из классификации дисперсных систем по размеру частиц следует, что коллоидные растворы (золи) занимают промежуточное положе-ние между молекулярными и...
-
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов,...
-
Стандартные методы, как правило, предусматривают использование количественного анализа, позволяющего установить точное содержание отдельных элементов и...
-
Это метод который нашел мировое применение для анализа лекарствнных средств. Он основан на свойстве галогенидов количественно осаждаться нитратом серебра...
-
Применение H2O2 связано с его окислительными свойствами и безвредностью продукта его восстановления (H2O). Его использую для отбеливания тканей и мехов,...
-
МЕТОДЫ СРАВНИТЕЛЬНОГО ШКАЛИРОВАНИЯ - Многомерный статистический анализ
Шкалирование методом попарного сравнения - Это метод сравнительного шкалирования, при котором респонденту дается два объекта для выбора по определенному...
-
Один из способов повысить селективность - это правильно подобрать катализатор. Рассмотрим этот метод, на примере получения анизола и крезола. Анизол и...
-
Стандартный водородный потенциал. Водородная шкала потенциалов ЭДС гальванического элемента равна разности равновесных потенциалов электродов: EЭ = цК -...
-
Пероксид водорода представляет собой бесцветную вязкую жидкость с плотностью 1,46 г/см3, замерзающую при t = -0.48c и кипящую при t = 152c. В лаборатории...
-
Кондуктометрическое титрование - Электрохимические методы исследования
Несомненно, большими аналитическими возможностями обладает кондуктометрическое титрование. Титрование позволяет восполнить недостаток селективности...
-
Выбор метода получения 1 способ Готовят отдельно два раствора: 9 г хлорида кобальта (II) в 25 мл воды (раствор 1) , 10 г хлорида аммония и 14 г нитрата...
-
В большинстве реальных больших систем не обойтись без учета "состояний природы" -- воздействий Стохастического типа, случайных величин или случайных...
-
В общем случае все этапы кластерного анализа взаимосвязаны, и решения, принятые на одном из них, определяют действия на последующих этапах. Аналитику...
Выбор системы электродов для проведения анализа, Выбор индикаторных электродов для химических реакций разного типа - Электрохимические методы анализа