Составление химических реакций и проведение опытов в фармакологии
Задание 1. Назовите процесс, который происходит с субстанцией "Цинка сульфата" при ее неправильном хранение. Укажите, как повлияет этот процесс на количественное содержание цинка сульфата. Какой фактор внешней среды способствует изменению его строения? В чем состоят эти изменения? Как повлияет этот процесс на количественное содержание цинка сульфата в субстанции?
Решение.
Согласно ГФ Х (с. 738) сульфат цинка (Zinci sulfas) ZnSO4-7H2O хранят в хорошо укупоренной таре. Причиной этого является, что сульфат цинка на воздухе выветривается. Водный раствор имеет кислую реакцию среды в следствии гидролиза.
Цинка сульфат образован сильной кислотой и слабым основанием, поэтому при гидролизе дает кислую реакцию среды
Zn2+ + 4H2О ? [Zn(H2O)4]2+
[Zn(H2O)4]2+ + H2О ? [ZnOH(H2O)3]+ + H3O+
Таким образом, не правильное хранение уменьшает количественное содержание сульфата цинка в препарате. Верхний предел содержания сульфата цинка (не более 101.1%), связан с тем, что ГФ регламентирует степень выветривания кристаллизационной воды.
Задание 2. Сопоставляем. Ж. Натрия сульфид, коричнево-черный
Висмута нитрат основной - это смесь BiNO3(ОH), ВiОNО и ВiOOН, после взаимодействия с нитратной кислотой образуется нитрат висмута.

Растворы солей висмута, слегка подкисленные кислотой хлороводородной, дают коричневато-черный осадок с сульфид ионом:
- 2Bi(NO3)3 + 3Na2S = Bi2S3v + 6HNO3 2Bi3+ + 3S2? > Bi2S3v
Согласно ОФС 42-0085-08 реакция подлинности на ион висмута выполняется согласно методике А. Указанное в частной фармакопейной статье количество лекарственного средства (около 50 мг висмут-иона) взбалтывают с 3 мл хлористоводородной кислоты разведенной 8,3 % и фильтруют. К фильтрату прибавляют 1 мл 2 % раствора натрия сульфида или сероводорода.
Внешний эффект: образуется коричневато-черный осадок, растворимый при прибавлении равного объема азотной кислоты концентрированной.
Bi2S3 + 8HNO3 > 2Bi(NO3)3 + 2NO^ + 2Sv + 4H2O
Задание 3. Соотнесите ЛС с реактивом и цветом осадка в фармакопейных реакциях доказательства подлинности субстанций по аниону. Напишите химизм реакций и укажите условия, которые необходимо соблюдать при проведении химических реакций.
Серебра нитрат.
Решение.
Сопоставляем. З. Дифенниламин, синее окрашивание.
Химизм реакции.
Основанная на окислении этого реактива (в присутствии нитратов) в среде концентрированной кислоты серной до дифенилдифенохинондиимина гидросульфата.
AgNO3 - Ag+ + NO3?
2C6H5-NH-C6H5 > C6H5-NH-C6H4-NH-C6H5 + 2H+ + 2e

Согласно ОФС 42-0085-08 реакция подлинности на нитрат-ионы (методика А) К лекарственному средству (около 1 мг нитрат-иона) прибавляют 2 капли раствора дифениламина.
Внешний эффект, появляется синее окрашивание.
Задание 4. Обоснуйте возможность окисления йодид-иона калия перманганатом, исходя из величин окислительно-восстановительных потенциалов. Приведите химизм реакции на примере калия йодида.
Решение.
2I- - 2e > I2 ц = 0.54 B
MnO4? + 8H+ + 5e > Mn2+ + 4H2O ц = 1.52
10I? + 2MnO4? + 16H+ > 5I2 + 2Mn2+ + 8H2O
ДцО = цООк - цОВс = 1,52 - 0.54 = 0,98 В
Если ДцО > 0, реакция в стандартных условиях протекает в прямом направлении; если ДцО < 0, то в обратном. В этом случае реакция происходит в прямом направлении.
10KI + 2KMnO4 + 8H2SO4 = 5I2 + 6K2SO4 + 8H2O + 2MnSO4
Задание 5. Приведите расчет навески соли (М. м. натрия гидрокарбоната 84,01) исходя из чувствительности иона (И. м. иона натрия 22,99) для доказательства подлинности натрия гидрокарбоната по катиону натрия по методике А. укажите навеску для испытания, объем воды в котором она будет растворена. Дайте обоснование методике, приведите химизм, укажите внешний эффект
Согласно ОФС 42-0085-08 определение подлинности иона натрия по методике А. К 2 мл раствора натриевой соли (7-10 мг натрий-иона) прибавляют 2 мл 15 % раствора калия карбоната и нагревают до кипения; осадок не образуется. К раствору прибавляют 4 мл раствора калия пироантимоната и нагревают до кипения. Охлаждают в ледяной воде и при необходимости потирают внутренние стенки пробирки стеклянной палочкой; образуется плотный осадок белого цвета.
Химизм реакции.
NaНСО3 + K[Sb(OH)6] > Na[Sb(OH)6]v + KНСО3
Na+ + [Sb(OH)6]? > Na[Sb(OH)6]v
Расчет навески (M) проводиться с учетом молекулярной натрия гидрокарбоната (NaНСО3 - 84,01) и иона натрия (22,99). Для этого составляются пропорции, для расчета навесок:
84,01 г натрия гидрокарбоната содержит 22,99 г ионов натрия.
Минимальная навеска гидрокарбоната натрия должна содержать 0,007 г иона натрия, а максимальная навеска натрий гидрокарбоната должна содержать 0,01 г иона натрия.
Исходя из этого проводят расчеты:

MMin = = 0.025 г

MMax = = 0.036 г
Навеску лекарственного вещества натрия гидрокарбоната, в пределах от 0,025 г до 0,036 г растворяют в 2 мл воды, прибавляют 2 мл 15 % раствора калия карбоната и нагревают до кипения; осадок не образуется. К раствору прибавляют 4 мл раствора калия пироантимоната и нагревают до кипения. Охлаждают в ледяной воде и при необходимости потирают внутренние стенки пробирки стеклянной палочкой. Внешний эффект, образуется плотный осадок белого цвета.
Задание 6. Установите соответствие. Укажите ответ в виде соответствующей буквы с полным обоснованием выбора ответа и написанием химизма реакции. Примесь, обнаруживаемая в воде, полученной дистилляцией. Кальций и магний (ФС ГФ XII)
Решение.
Сопоставляем. М) буферный раствор аммония хлорида, протравный черный, 0,01 М раствор натрия эдетата, чисто голубая окраска.
Обоснование. Согласно ФС 42-0324-09 примесь кальция и магния определяется согласно методике: к 100 мл воды очищенной прибавляют 2 мл буферного раствора аммония хлорида рН 10,0 50 мг индикаторной смеси протравного черного и 0,5 мл 0,01 М раствора натрия эдетата, должна наблюдаться чисто голубая окраска.
Химизм реакции:
В щелочной среде (рН 8-11) ионы Са2+ и Mg2+ образуют с протравным черным комплексы красного цвета менее прочные, чем комплексонаты этих металлов с эдетатом натрия. При взаимодействии пробы воды с эдетатом натрия в присутствии эриохрома черного красные комплексы кальция и магния разрушаются, образуются комплексонаты этих металлов с эдетатом натрия, не имеющие окраски. Поэтому в точке эквивалентности красная окраска раствора переходит в синюю, обусловленную окраской аниона индикатора Ind2-. Приняв условно молекулу протравного черного H2Lnd, можно записать:
H2Ind = 2H+ + Ind2-
Темно-лиловый Синий
Ca2+ + Ind2- = Calnd
Вишнево-красный (рН 8-11)
CdInd + Na2H2Edta = CaH2Edta + 2Na+ + Ind2-
Бесцветный Синий (рН 8-11)
Задание 7. Дайте обоснование определению примеси сульфатов в воде очищенной (см. приложение с.55). Укажите ее допустимость и приведите принцип обнаружения
Решение.
Согласно (ФС 42-0324-09)Примесь сульфатов определяется по методике. К 10 мл воды очищенной прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 % и 1 мл 5 % раствора бария хлорида, перемешивают и оставляют на 10 мин. Не должно быть помутнения.
Химизм реакции.
Сульфаты с растворимыми солями бария дают белый осадок нерастворимый в кислотах и щелочах:
SO42? + Ba2+ > BaSO4v
По условию задачи дано: V / А = 10, Р = 1, концентрация эталонного раствора сульфат-иона (Сэ) равна 0,001%.
После подстановки данных в уравнение имеем
СН = СЭ-V-Р / А = 0,001-10-1 = 0,01%.
Не более 0,01% в препарате.
Предельная чувствительность реакции 0,003 мг (3 мкг) сульфат-иона в 1 мл раствора. 0,01 мг (10 мкг) сульфат-иона в 1 мл раствора дает при этой реакции через 10 мин заметную муть.
Эталонный раствор сульфат-иона. 1,814 г сульфата калия, высушенного при температуре от 100 до 1050С до постоянной массы, растворяют в воде в мерной колбе вместимостью 1 л и доводят объем раствора водой до метки (раствор А) 10 мл раствора А помещают в мерную колбу вместимостью 1 л и доводят объем раствора водой до метки (раствор Б). Этот раствор содержит 0,01 мг (10 мкг) сульфат-иона в 1 мл.
К 10 мл испытуемого раствора прибавляют применяемые для каждой реакции реактивы, указанные в методике, кроме основного реактива, открывающего данную примесь. Затем раствор делят на две равные части: к одной из них прибавляют указанный в статье основной реактив и оба раствора сравнивают между собой. Между ними не должно быть заметной разницы. В этом случае делают заключение об отсутствии данной примеси в лекарственном веществе.
Задание 8. Соотнесите испытания, проводимые при установлении прозрачности, степени мутности и окраски водных растворов с раствором сравнения. Обоснуйте ответ. Определение прозрачности ОФС 42-0051-07 (ГФ XII).
Решение.
Сопоставляем. Б. Вода очищенная или эталон I.
Обоснование. Согласно ОФС 42-0051-07 (ГФ XII). Испытуемую жидкость считают прозрачной, если она по прозрачности не отличается от воды или растворителя, используемого при приготовлении испытуемой жидкости, или выдерживает сравнение с эталоном I, т. е. ее опалесценция (мутность) не превышает опалесценцию (мутность) эталона I при просмотре в таких условиях. Испытание проводят в пробирках с притертой пробкой из прозрачного бесцветного стекла с внутренним диаметром около 15 мм. Для сравнения берут равные объемы эталона и испытуемой жидкости (5 или 10 мл). Испытание проводят при освещении электрической лампой матового стекла мощностью 40 Вт, расположенной над образцом, просматривая растворы перпендикулярно вертикальной оси пробирок на черном фоне через 5 мин. после приготовления эталона.
Задание 9. Обоснуйте определение свободного хлора в хлористоводородной кислоте по методике ГФ Х (ст. 17): 5 мл препарата смешивают с 5 мл воды, добавляют 1 мл раствора йодида калия, 1 мл хлороформа и взбалтывают. В течение 1 минуты хлороформный слой не должен окрашиваться в розовый или фиолетовый цвет. Ответ подтвердите химизмом реакций
Решение.
Методика основана на взаимодействии свободного хлора с йодидом калия, согласно схеме:
Cl2 + 2KI > I2 + 2KCl
Реакция проводится в присутствии хлороформа, который окрашивается в розовый или фиолетовый цвет от выделившегося йода.
Задание 10. Дайте обоснование комплеконометрическому методу количественного определения цинка оксида (ГФ XII, ч. 3, ФС 42-, см. приложение с. 68). Напишите химизм реакций, рассчитайте титр анализируемого вещества по 0,05 М титрованному раствору. М. в. 81,39
Решение.
Согласно ГФ XII, ч. 3, ФС 42- количественное определение цинка оксида проводят по методике. Количественное определение. Около 0,7 Г Субстанции (точная навеска) помещают в мерную колбу емкостью 100 Мл, Растворяют в 50 Мл Разведенной 8,3 % хлористоводородной кислоты и доводят объем раствора водой до метки. 10,0 Мл Полученного раствора переносят в колбу вместимостью 250 Мл, Нейтрализуют 10 % раствором аммиака в присутствии 1 капли 0,1 % спиртового раствора метилового красного, прибавляют 5 Мл Буферного раствора аммония хлорида (рН=10), 90 Мл Воды и титруют 0,05 М Раствором натрия эдетата до синего окрашивания (индикатор - кислотный хром черный специальный).
1 Мл 0,05 М Раствора натрия эдетата соответствует 4,069 мГ ZnO, которой в препарате должно быть не менее 99,0 %
Количественное определение цинка оксида выполняют комплексонометрическим методом. Титрант - трилон Б (натрия эдетата)

2. Метод основан на свойстве катионов цинка образовывать с трилоном Б, бесцветное, прочное, растворимое соединение.
Среда - слабощелочная.
Индикатор - металлохромный : хром черный специальный. Индикация основана на свойстве иона цинка образовывать с индикатором окрашенное, но в другой по сравнению с индикатором цвет соединение, по устойчивости уступающее комплексу цинка с натрия эдетатом. В точке эквивалентности наблюдается переход окраски из вишнево-красной в синюю.
- 3. Химизм 4.

5. Расчет титра раствора трилона Б по цинка оксиду

Расчет содержания цинка оксида в препарате

Задание 11. Дайте оценку качества субстанции натрия тиосульфата по количественному содержанию, если при йодометрическом определении на навеску 0,5012 г израсходовалось 20,2 мл 0,01 М раствора йода УЧ = Ѕ (К= 1,0075).
Методика. Около 0,5 Г Субстанции (точная навеска) растворяют в 25 Мл Воды и титруют 0,1 М раствором йода (индикатор - крахмал). Содержание натрия тиосульфата пентагидрата в субстанции должно быть не менее 99,0% и не более 102,0%. М. м. 248,18.
Решение.
- 1. Количественное определение натрия тиосульфата выполняют йодометрическим методом. 2. Метод основан на окислительных свойствах йода. Индикатор - крахмал. Индикация основана на свойстве крахмала образовывать с молекулами йода окрашенное в синий цвет комплексное соединение. 3. Химизм
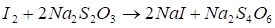
4.


5. Расчет титра раствора йода по натрия тиосульфату.

6. Формула расчета содержания действующего вещества в субстанции

7. Находим содержание Na2S2O3 - 5H2O в препарате

Согласно ГФ XII препарат должен содержать не менее 99,0 % и не более 102,0 % Na2S2O3 - 5H2O.
Из сравнения делаем вывод, что данный препарат по количественному содержанию Na2S2O3 - 5H2O не удовлетворяет требованиям ГФ XII.
Задание 12. Приведите общий метод количественного определения кальциевых солей карбоновых кислот на примере кальция глюконата
Решение.
Соли органических кислот диссоциируют в водных растворах и могут определяться реакциями на соответствующие катионы и анионы.
Для исследования большинства органических веществ применяют методы, в основу которых положены реакции, основанные на химических свойствах функциональных групп, содержащихся в этих веществах.
Кальция глюконат определяют по иону кальция комплексонометрически. Согласно ФС 42-0238-07 количественное определения производят согласно методике. Около 0,4 Г Субстанции (точная навеска) растворяют при подогревании в 20 Мл Воды. По охлаждении прибавляют 10 Мл Аммиачного буферного раствора, и титруют 0,05 М Раствором натрия эдетата до сине-фиолетового окрашивания (индикатор - 0,5 мл раствора кислотного хромового темно-синего).
Метод основан на свойстве катионов кальция образовывать с натрием эдетатом, бесцветное, прочное, растворимое соединение.

Среда - слабощелочная. Титрант - натрия эдетат (динатриевая соль этилендиаминтетрауксусной кислоты) (сокращенно, ).
Индикация основана на свойстве иона кальция образовывать с индикатором окрашенное, но в другой по сравнению с индикатором цвет соединение, по устойчивости уступающее комплексу кальция с трилоном Б. В точке эквивалентности наблюдается переход окраски из вишнево-красной в синюю.
3. Химизм

>


+ 2СН2(ОН)-СН(ОН)-СН(ОН)-СН(ОН)-СН(ОН)-СООН
Задание 13. Соотнесите функциональную группу, реактивы и внешний эффект с типом реакции, используемой для доказательства подлинности ЛС. Напишите химизм реакции. R-CO-NH2(пирацетам, натрия гидроксид, нагревание, запах аммиака)
Решение.
Соотносим. К
Согласно ФС 42-0269-07 подлинность пирацетама определяется согласно методике. 0,2 г субстанции нагревают с 2 мл раствора натрия гидроксида; выделяется аммиак, обнаруживаемый по запаху и по посинению влажной красной лакмусовой бумаги.
Обоснование. Все амиды при нагревании с растворами щелочей, концентрированной соляной или серной кислотами гидролизуются и превращаются в соответствующие кислоты; при кипячении с щелочами выделяется аммиак.
Химизм реакции. При нагревании пирацетама с раствором гидроксида натрия выделяется аммиак, который обнаруживают по запаху и посинению красной лакмусовой бумаги.

Внешний эффект запах аммиака.
Задание 14. Поясните определение растворимости в соответствии с условными терминами (ФС), обоснуйте реакции на подлинность, испытание на чистоту, количественное определение ЛС по нормативной документации (ФС), приведенной в приложении. При описании реакций на подлинность, испытаний на чистоту приведите химизм реакций, для количественного определения приведите химизм реакции, вывод коэффициента стехиометричности, фактора эквивалентности. Обоснуйте хранение ЛС или применение
Кислота глютаминовая (ФС 42-0229-07).
Растворимость в воде.
Реакции на подлинность с нингидрином
Испытание на чистоту: удельное вращение, тяжелые металлы в сульфатной золе.
Количественное определение, применение.
Решение.

Acidum glutaminicum. Кислота глутаминовая Кислота б-аминоглутаровая.
Растворимость в воде.
Согласно ФС 42-0229-07, глутаминовая кислота мало растворима в воде. То есть, для растворения 1 г препарата необходим объем воды от 100 до 1000 мл. Для подтверждения подлинности и доброкачественности навеску предварительно растертой глутаминовой кислоты массой 1,00 г вносят в 100 мл воды и непрерывно встряхивают в течение 10 мин при 20 ± 2°С. Препарат считают растворившимся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества. В случае неполного растворения препарата постепенно небольшими порциями прибавляют воду (до объема 1000 мл) при непрерывном встряхивании. Если навеска полностью растворится в объеме воды от 100 до 1000 мл, то делают вывод о доброкачественности препарата.
Подлинность с нингидрином.
Согласно ФС 42-0229-07 подлинность глутаминовой кислоты определяется согласно методике.
0,02 Г Субстанции растворяют при нагревании в 1 Мл Свежепрокипяченной воды, прибавляют 1 Мл Свежеприготовленного раствора нингидрина и нагревают; появляется сине-фиолетовое окрашивание.
Химизм реакции.

С избытком щелочного раствора нингидрина глутаминовая кислота (как и другие б-кислоты) при нагревании дает сине-фиолетовое окрашивание.
Испытание на чистоту. Удельное вращение.
Удельное вращение. От +30,5 до +32,5° в пересчете на сухое вещество (10% раствор субстанции в 1 М растворе хлористоводородной кислоты).
ГФ XII требует определить угол вращения (б) 10% раствора и рассчитать удельное вращение по формуле:

Где: С - концентрация раствора
L - длина трубки поляриметра
При определении [б] в растворах оптически активного вещества необходимо иметь ввиду, что найденная величина может зависит от природы растворителя и концентрации оптически активного вещества. Замена растворителя может привести к изменению [б] не только по величине, но и по знаку. Поэтому, приводя величину [б], необходимо указывать растворитель и выбранную для измерения концентрацию раствора.
Тяжелые металлы в сульфатной золе.
Методика. Сульфатная зола из 1 Г Субстанции не должна превышать 0,1% и должна выдерживать испытание на тяжелые металлы (не более 0,001% в субстанции).
Испытуемый раствор. Зольный остаток, полученный после сжигания 1 г (если не указано иначе в частной фармакопейной статье) испытуемого образца в присутствии серной кислоты концентрированной, обрабатывают при нагревании на сетке 2 мл насыщенного раствора аммония ацетата, нейтрализованного раствором натрия гидроксида, прибавляют 3 мл воды и фильтруют в пробирку через беззольный фильтр, предварительно промытый 1 % раствором уксусной кислоты, а затем горячей водой. Тигель и фильтр промывают 5 мл воды, пропуская ее через тот же фильтр в ту же пробирку. Эталонный раствор. В тигель помещают серную кислоту концентрированную в количестве, взятом для сжигания испытуемого образца, и далее поступают, как с испытуемым образцом, но промывание тигля и фильтра производят лишь 3 мл воды, после чего к фильтрату прибавляют 2 мл стандартного раствора свинец-иона (5 мкг/мл). Контрольный раствор. Готовят так же, как и испытуемый раствор, но без испытуемого образца.
Количественное определение.
- 1. Количественное определение глутаминовой кислоты выполняют алкалиметрическим методом. Титрант - 0,1 М раствор натрия гидроксида. 2. Метод основан на нейтрализации карбоксильной группы в г-положении. 3. Среда - рН 6,0 - 7,6, способ титрования - прямой. Индикатор - бромтиоловый синий 4. Химизм реакции. Кислоту глутаминовую титруют 0,1 М раствором гидроксида натрия. Реакция происходит по схеме.

Методика. Около 0,3 Г Субстанции (точная навеска) растворяют при нагревании в 50 Мл Свежепрокипяченной воды, охлаждают и титруют 0,1 М натрия гидроксида до перехода желтой окраски в голубовато-зеленую. Параллельно проводят контрольный опыт.

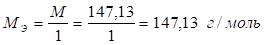
5. Расчет титра раствора натрия гидроксида по глутаминовой кислоте
Т = МЭ - СН = 147,13 - 0,1 = 14,71 мг
6. Расчет содержания глутаминовой кислоты в препарате

,

С учетом контрольного опыта
Применение. Средство, регулирующее метаболические процессы в ЦНС; оказывает ноотропное, дезинтоксикационное, связывающее аммиак действие. Заменимая аминокислота, играющая роль нейромедиатора с высокой метаболической активностью в головном мозге, стимулирует окислительно-восстановительные процессы в головном мозге, обмен белков.
Задание 15. Дайте оценку качества субстанции цистеина (М. м. 121,16) по количественному содержанию с учетом требования ВФС 42-2633-95 (цистеина должно быть не менее 98,5 %), если при анализе к навеске массой 0,2510 г прибавлено 25 мл 0,1 М раствора йода У/Ч (1/2 I2). А остаток йода оттитровали 0,1 М раствора натрия тиосульфата (К = 0,9978), которого израсходовалось 4,39 мл. На контрольный опыт израсходовалось 25,10 мл 0,1 М раствора натрия тиосульфата
Решение.
Количественное определение.
- 1. Количественное определение цистеина выполняют йодометрическим методом. Титрант - 0,1 М раствор йода. 2. Метод основан на окислении сульгидрильной группы до дисульфидной. 3. Среда - кислая, способ титрования - обратный. Индикатор - крахмал. 4. Химизм реакции. цистеин реагирует с йодом по реакции:

Избыток йода оттитровывают стандартным раствором натрия тиосульфата.
- 2Na2S2O3 + I2 = 2NaI + Na2S4O6 4. (с учетом коэффициентов и УЧ)

Окисление металл коллоид раствор
5. Расчет титра раствора йода по цистеину

Расчет содержания цистеина в препарате с учетом контрольного опыта

С = = = 99,78 %

Согласно ВФС 42-2633-95 препарат должен содержать не менее 98,5% цистеина.
Из сравнения делаем вывод, что данный препарат по количественному содержанию цистеина удовлетворяет требованиям ВФС 42-2633-95.
Задание 16. Напишите химическую формулу ЛС, исходя из рационального названия - 2-изопропил-5-метилфенол. Назовите функциональные группы, обоснуйте условия хранения в зависимости от их свойств этих групп
Решение.

Thymolum. Тимол. 2-изопропил-5-метилфенол. Фенолы можно рассматривать как ароматические спирты у которых одна или несколько гидроксильных групп связаны непосредственно с ароматическим ядром. Этим обусловлены главные отличия фенолов от алифатических спиртов. Благодаря наличию фенольного гидроксила под воздействием прямого света тимол окисляется

Кроме того, тимол имеет температуру плавления 49-51 єС.
С учетом этого тимол хранят пи температуре не выше 25 єС в хорошо укупоренной таре, предохраняя от действия света, чтобы не допустить окисления.
Задание 17. Поясните определение растворимости в соответствии с условными терминами (ФС), обоснуйте реакции на подлинность, учитывая свойства функциональных групп, испытание на чистоту, количественное определение ЛС по нормативной документации (ФС, ФСП, ОФС), приведенной в приложении. При описании реакций на подлинность, испытаний на чистоту приведите химизм реакций, для количественного определения приведите химизм реакции, вывод коэффициента стехиометричности, фактора эквивалентности. Обоснуйте хранение ЛС или применение.
Сульфацил-натрий. (ФС 42-2714-90) с. 91.
- 1. Растворимость в спирте. 2. Реакция на подлинность Б и В. 3. Испытание на чистоту: цветность раствора, хлориды. 4. Количественное определение и хранение.
Решение.

N-Аминобензолсульфонилацетамид-натрий.
Растворимость в спирте.
Растворимость веществ в ГФ XI выражается либо в частях, либо в условных терминах.
Условный термин соответствует определенному интервалу объемов растворителя (мл), в пределах которого должно происходить полное растворение 1 г препарата.
ГФ XI допускает следующие условные термины: "очень легко растворим", "легко растворим", "растворим", "умеренно растворим", "мало растворим", "очень мало растворим", "практически не растворим".
Согласно ФС 42-2714-90, сульфацил-натрий легко растворим в спирте метиловом. То есть, для растворения 1 г препарата необходим объем спирта метилового от 1 до 10 мл.
Для подтверждения подлинности и доброкачественности навеску предварительно растертого сульфацил-натрия массой 1,00 г вносят в 1 мл спирта метилового и непрерывно встряхивают в течение 10 мин при 20 ± 2°С.
Препарат считают растворившимся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества.
В случае неполного растворения препарата постепенно небольшими порциями прибавляют растворитель (до объема 10 мл) при непрерывном встряхивании.
Если навеска полностью растворится в объеме растворителя от 1 до 10 мл, то делают вывод о доброкачественности препарата.
Реакция на подлинность
Методика Б. 0,1 г препарата растворяют в 3 мл воды и прибавляют 1 мл раствора сульфата меди, образуется осадок голубовато-зеленого цвета, который не изменяется при стоянии.
За счет кислотных свойств бензолсульфониламиды и их производные взаимодействуют с солями тяжелых металлов: меди, серебра, железа, кобальта. В результате реакции образуются комплексные соединения, как правило, не растворимые в воде, имеющие характерную окраску. Взаимодействие с меди (II) сульфатом имеет дифференцирующее значение и применяется для подтверждения подлинности лекарственных веществ данной группы. Реакция проводится в умеренно-щелочной среде, при этом бензолсульфониламиды нейтрализуют 0.1 н раствором щелочи по тимоловому синему.
Методика В. Препарат дает характерную реакцию Б на натрий (ГФ XI, вып. 1, с. 159).
Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Испытание на цветность раствора.
Оценку доброкачественности препарата проводят путем сравнения раствора препарата с эталонами.
Вначале проводят приготовление исходных растворов.
Раствор А.
Около 6,00 г (точная навеска) растертого хлорида кобальта (II) растворяют в растворе серной кислоты (0,1 моль/л) в мерной колбе вместимостью 100 мл, перемешивают и доводят объем раствора раствором серной кислоты (0,1 моль/л) до метки. Объем раствора хлорида кобальта разбавляют таким образом, чтобы содержание хлорида кобальта (II) в 1 мл составляло 0,060 г.
Раствор Б.
0,4900 г растертого бихромата калия растворяют в растворе серной кислоты (0.1 моль/л) в мерной колбе вместимостью 100 мл и доводят объем раствора раствором серной кислоты (0,1 моль/л) до метки.
Раствор В.
Около 6,00 г (точная навеска) растертого сульфата меди (II) растворяют в растворе серной кислоты (0,1 моль/л) в мерной колбе вместимостью 100 мл и доводят объем раствора раствором серной кислоты (0,1 моль/л) до метки. Объем раствора сульфата меди (II) разбавляют таким образом, чтобы содержание сульфата меди (II) в 1 мл составляло 0,060 г.
Раствор Г.
Около 4,50 г (точная навеска) хлорида железа (III) растворяют в мерной колбе вместимостью 100 мл в растворе серной кислоты (0,1 моль/л) и доводят объем раствора раствором серной кислоты
Основные растворы получают смешением исходных растворов хлорида кобальта (II), бихромата калия, сульфата меди (II) и хлорида железа (III) с раствором серной кислоты (0,1 моль/л) в следующих соотношениях.

Для приготовления эталона № 6 б смешивают 3,10 мл основного раствора II и 96,90 мл раствора серной кислоты (0,1 моль/л).
Навеску сульфацил-натрия массой 1,5 г растворяют в 5 мл воды. По 5 мл приготовленных растворов сульфацил-натрия и эталонов помещают в пробирки одинакового стекла, одного и того же диаметра. Испытание проводят при дневном отраженном свете на матово-белом фоне.
Препарат считают доброкачественным, если испытуемый раствор сульфацил-натрия при рассматривании невооруженным глазом выдерживает сравнение с эталонами № 6 б (не превышает по цвету).
Испытание на хлориды
Наличие в препарате хлорид-ионов определяют по реакции с ионами серебра (по образованию хлорида серебра).

Растворы хлоридов в зависимости от их концентрации образуют с раствором нитрата серебра белый творожистый осадок, белую муть или опалесценцию, не исчезающие от прибавления азотной кислоты.
Вначале готовят эталонный раствор, содержащий 0,002 мг хлор-иона в 1 мл.
- 0,659 г прокаленного хлорида натрия растворяют в воде в мерной колбе вместимостью 1 л и доводят объем раствора до метки водой (раствор А). 5 мл раствора А пипеткой помещают в мерную колбу вместимостью 1 л и доводят объем раствора водой до метки (эталонный раствор Б).
Для приготовления эталона к 10 мл эталонного раствора Б прибавляют 0,5 мл азотной кислоты, 0,5 мл раствора нитрата серебра и перемешивают.
Для приготовления испытуемого раствора навеску сульфацил-натрия массой 0,2 г встряхивают в течение 2 мин. с 10 мл воды и фильтруют. К фильтрату прибавляют 0,5 мл азотной кислоты, 0,5 мл раствора нитрата серебра и перемешивают.
Через 5 мин по 10 мл испытуемого раствора и эталона помещают в пробирки из бесцветного стекла, одного и того же диаметра с притертыми пробками. Сравнение растворов проводят на черном фоне при освещении электрической лампой матового стекла мощностью 40 Вт при вертикальном расположении пробирок.
Опалесценция, появившаяся в испытуемом растворе, не должна превышать эталон.
Количественное определение
- 1. сульфацил натрия определяют нитритометрическим методом. Титрант - 0,1 М раствор нитрита натрия. 2. Метод основан на диазотировании первичной ароматической аминогруппы нитритом натрия в кислой среде при охлаждении раствора. 3. Химизм

+ HNO2 + HCl >

Точку эквивалентности определяют электрометрическими методами или с использованием йодкрахмальной бумаги.

4.

5. Титр раствора натрия нитрита по сульфацил натрия


6. Расчет содержания сульфацила натрия в препарате
Применение.
Сульфаниламидный продукт. Препарат эффективен при стрептококковых, гонококковых, пневмококковых и колибациллярных инфекциях.
Задание 18. Дайте оценку качества субстанции парацетамола (М. м. 151,17) по количественному содержанию с учетом требования ГФ X, ст. 506 (парацетамола в одной таблетке должно быть 0,19 - 0,21, считая массу одной таблетки). Если на навеску 0,2480 г порошка растертых таблеток, израсходовалось 10,45 мл 0,1 М раствора натрия нитрита (К=0,9945). На контрольный опыт израсходовалось 0,05 мл титранта. Средняя масса 1 таблетки 0,310 г.
Решение.
- 1. Парацетамол определяют нитритометрическим методом (после кислотного гидролиза). 2. Метод основан на диазотировании первичной ароматической аминогруппы нитритом натрия в кислой среде при охлаждении раствора. Используется 0,1 моль/л раствор нитрита натрия. Точку эквивалентности устанавливают по внешнему индикатору - йодкрахмальной бумаге. 3. Химизм



Около 0,25 г (точная навеска) субстанции кипятят с обратным холодильником с 10 мл 50 % раствора серной кислоты в течение 1 ч. Холодильник промывают 30 мл воды, количественно переносят содержимое колбы в сосуд для диазотирования, разбавляют водой до 80 мл, прибавляют 1 г калия бромида и титруют нитритометрически. Конец титрования устанавливают по йодкрахмальной бумаге.
4.

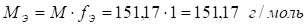
5. Расчет титра раствора натрия нитрита по парацетамолу

6. Расчет содержания парацетамола в препарате

Где:
Поправочный коэффициент к концентрации раствора натрия нитрита;
Масса навески, г.
Р - средняя масса таблетки, с учетом контрольного опыта


Согласно ГФ X, таблетка парацетамола (средняя масса 0,310) должна содержать 0,19 - 0,21 г парацетамола.
Из сравнения делаем вывод, что данный препарат по количественному содержанию парацетамола удовлетворяет требованиям ГФ X, ст. 506.
Фарм. Технология. к. р. 1: задания 5, 11, 29, 49, 68, 71, 82. К. р. 2: задания 9, 21, 40, 49, 63, 74. К. р. 3: задания 5, 26, 35, 48, 58, 79, 88, 102, 110.
Задание 19. Масса 20 капель 0,1% раствора адреналина гидрохлорида по нестандарт-ному каплемеру 0,74 г. Сколько капель раствора нужно отпустить, если в рецепте выписано: 20 капель; 0,5 мл?
Дозирование каплями в условиях аптеки проводится эмпирическим каплемером. Калибровка эмпирического каплемера ведется согласно указаниям ГФ XI, с. 134.
По ГФ XI количество капель в 1г и в 1 мл 0,1% раствора адреналина гидрохлорида равен 25капель.
20 капель 0,1% раствора адреналина гидрохлорида =0,74г
Х =1,0
Х=27 капель
- 25стандартных капель 0,1% раствора адреналина гидрохлорида = 27 нестандартных капель 0,1% раствора адреналина гидрохлорида 1 стандартная капля = 1,08 нестандартным каплям
В рецепте выписано 20 капель; то по нестанадртному каплемеру мы должны отпустить: 20х1,08=21,6 =22 капли
Находим число не стандартных капель в 1 мл 0,1% раствора адреналина гидрохлорида
В 1 мл 0,1% раствора адреналина гидрохлорида содержится 25 стандартных 1мл -25ст. капли
- 1ст. кап=1,08 не ст. кап. 25ст. кап.=х
Х=25*1,08=27 не ст. капель
1мл 0,1% раствора адреналина гидрохлорида содержит 27 не ст. капли
Если выписано 0,5 мл, необходимо отпустить: 0,5*27=13,5=14 капель
Ответ: по рецепту следует отпустить 22 капли 0,1% раствора адреналина гидрохлорида; 14 капель 0,1% раствора адреналина гидрохлорида
11. Возьми: Атропина сульфата 0,00025
Димедрола 0,02
Сахара 0,3
Смешай, пусть будет сделан порошок.
Дай таких доз числом 10.
Обозначь. Принимать по 1 порошку 3 раза в день
Rp.: Atropini sulfatis 0,00025
Dimedroli 0.02
Saсchari 0.3
Misce fiat pulvis
Da tales doses № 10
Signa. По 1 порошку 3 раза в день.
Анализ рецепта
Рецепт содержит ядовитое и сильнодействующее вещество находящееся на предметно количественном учете, форма бланка № 148-1/у, согласно МЗ РФ № 110 от 12.02.07 "О порядке назначения и выписывания лекарственных средств, изделий медицинского назначения и специализированных продуктов лечебного питания". Норма отпуска атропина сульфата не регламентирована.
Рецепт на данную лекарственную форму остается в аптеке больному выписывается сигнатура.
Ингридиенты прописи фармакологически, физико-химически и химически совместимы. Пропись содержит вещества списка А и Б.
Характеристика лекарственной формы:
Выписана всесторонне свободная дисперсная система без дисперсионной среды, твердая лекарственная форма, сложный дозированный порошок для внутреннего применения. Рецепт выписан распределительным способом.
Порошки для внутреннего применения. Порошки твердая лекарственнпя форма обладающая свойством сыпучести.
Физико-химические свойства лекарственных и вспомогательных веществ
Атропина сульфат (Atropini sulfas) - белый кристаллический или зернистый порошок без запаха. Растворимость : легко растворим в воде, мало в спирте. Не растворим в эфире и хлороформе. Хранение: в хорошо укупоренной таре. Список "А". ВРД - 0,001; ВСД - 0,003.
Димедрол (Dimedrolum) белый мелкокристалический порошок без запаха или с едва уловимым запахом. Горького вкуса, вызывает чувство онемения на языке. Гигроскопичен. Растворимость: очень легко растворим воде, легко в спирте и хлороформе, не растворим в эвире и бензоле. Хранение: Список "Б" ВРД -0,1; ВСД - 0,25
Сахар (Saccharum lactis) белый или слегка с желтоватым оттенком кристаллический порошок без запаха, сладкого вкуса. Растворимость: легко растворим в воде, мало растворим в спирте, не растворим в эфире, хлороформе. Хранение: в хорошо укупоренной таре, сухом месте.
Проверка доз
Атропина сульфат
РД = 0,00025 < ВРД=0,001
СД= 0,00075 < ВСД=0,003
Димедрол
РД =0,02 < ВРД = 0,4
СД 0,06 < ВСД = 1,2
Дозы лекарственных веществ по прописи не завышены.
Паспорт письменного контроля (ППК)
Оборотная сторона ППК
Атропина сульфата 0,00025 х 10= 0,0025 <0,05
Тритурации атропина сульфата (1:100) 0,0025=0,25
Димедрола 0,02 х 10=0,2
Сахара 0,3 х 10 = 3,0 - 0,25 = 2,75
MОбщ = 0,25+2,75+0,2=3,2
М1= 3,2/10=0,32
Теоретическое обоснование технологии изготовления
Ѕ Количество атропина сульфата по прописи менее 0,05 необходимо использовать тритурацию атропина сульфата (1:100).
Ѕ Вещества, находящиеся на предметно количественном учете получают у провизора-технолога ответственного за хранение и отпуск данной группы
Ѕ Общая масса порошков приближенна к оптимальной загрузке для ступки №4, время измельчения 1,5 минуты.
Ѕ Поры ступки и пестика затирают сахаром, так как он в данном случае является наполнителем (фармакологически индифферентным веществом), относительные потери не рассчитывают.
Ѕ Ведение тритурации проводят в соотношении не более 1:2. Тритурацию дополнительно не измельчают.
Технология изготовления
На ВР-1 отвешивают сахар, затирают поры ступки и пестика, добавляют димедрол, смешивают и измельчают в течение 1,5 минут, смесь отсыпают на капсулу. В пустую ступку, получают у провизора-технолога тритурацию атропина сульфата (1:100), добавляют к тритурации приблизительно 0,25-0,5 смеси порошков, смешивают. Затем по частям добавляют порошки с капсулы, перемешивают до однородности. Развешиваем по 0,32 на 10 доз.
Упаковка
Дозы порошка упаковывают в вощенные капсулы. Укладывают в коробку в 2 ряда по 5 штук, или бумажный пакет.
Оформление
Наклеивают основную этикетку "Внутреннее. Порошки" с указанием: № аптеки, № рецепта, Ф. И.О. пациента, способа применения (по 1 порошку 3 раза в день), даты (число, месяц, год), цены. Предупредительные надписи "Беречь от детей "Обращаться осторожно", "Хранить в сухом, защищенном от света месте"
Срок годности: 10 суток (пр. № 214).
Лекарственная форма опечатывается и хранится у провизора-технолога отвечающего за хранение и отпуск наркотических, ядовитых и сильнодействующих веществ в аптеке
Лицевая сторона ППК:
Дата № рецепта
Sacchari 2.75
Dimedroli 0.2
Trituratio Atropini sulfatis (1:100) 0.25
MОбщ =3,2
М1=0,32
№ 10
Приготовил (подпись) Проверил (подпись)
Расфасовал (подпись) Отпустил (подпись)
- - органолептический (однородный порошок без видимых включений, белого цвета, без запаха, вкус не определяется, так как содержит ядовитые вещества) - контроль при отпуске.-
Порошки упакованы в парафинированные капсулы с учетом физико-химических свойств, входящих в них лекарственных веществ. Порошки уложены ровными рядами, отдельный порошок при переворачивании не высыпается.
Указанные в рецепте дозы атропина сульфата, димедрола не завышены. Номера на рецепте и номера на этикетке, фамилия больного на квитанции фамилия на этикетке, рецепте или копии соответствуют. Сигнатура рецепта соответствует прописи рецепта. Основные и дополнительные этикетки наклеены правильно, аккуратно,
- физический.
Допустимые нормы отклонения
Массе одного порошка находиться в пределе от 0,3 до 1,0 отклонения составляют 5% (в соответствии с приказом МЗ РФ № 305 от 16.10.97 "О нормах отклонений при изготовлении лекарственных средств и фасовке промышленной продукции в аптеках").
Расчет отклонений
- 100% - 0,32 5% - х х = 0,016
[0.3 0.34]
- - химический. Проводят полный химический анализ - опросный. Проводят выборочно
Вывод: Лекарственная форма приготовлена удовлетворительно согласно с действующими НД.
Задание 20. Выберите правильный ответ (ответ подтвердите расчетами)
Количество тритурации (1:100 или 1:10) для изготовления порошков и масса одного порошка по рецепту:
Возьми: Атропина сульфата 0,00025
Папаверина гидрохлорида 0,02
Сахара 0,25
Смешай, пусть будет сделан порошок.
Дай таких доз числом 6.
Обозначь. Принимать по 1 порошку 3 раза в день.
- 0,015 0,27 0,15 0,27 0,15 0,25 0,25 0,32
ОТВЕТ: В
Расчеты по прописи:
Атропина сульфата 0,00025*6=0,0015 <0,05
Тритурации атропина сульфата (1:100)*0,0015 = 0,15
Папаверина гидрохлорида 0,02*6=0,12
Сахара 0,25*6=1,5 - 0,15=1,35
Масса общая 0,15+0,12+1,35=1,62
Масса одного 1,62/6=0,27
Выберите правильный ответ (ответ подтвердите расчетами):
Количество сухого экстракта красавки для изготовления порошков и масса одного порошка по рецепту:
Возьми: Экстракта красавки 0,015
Магния сульфата
Магния карбоната основного поровну по 0,3
Смешай, пусть будет сделан порошок.
Дай таких доз числом 20
Обозначь. Принимать по 1 порошку 3 раза в день.
- 0,6 0,63 0,3 0,61 0,6 0,62 0,3 0,63
ОТВЕТ: А
Расчеты:
Экстракта красавки сухого (1:2) 0,03*20=0,6
Магния сульфата 0,3*20=6,0
Магния карбоната основного 0,3*20=6,0
Масса общая 0,6+6,0+6,0=12,6
Масса одного 12,6/20=0,63
Задание 21. Возьми: Глюкозы 10% - 100 мл
Эуфиллина 0,3
Калия йодида 2,0
Сиропа сахарного 5 мл
Смешай. Дай.
Обозначь. Принимать по 1 столовой ложке 3 раза в день
Rp. Sol. Glucosi 10% 100 ml
Euphylini 0,3
Kalii iodidi 2.0
Sirupi saccharis 5 ml
Misce. Da.
Signa. Принимать по 1 столовой ложке 3 раза в день.
Анализ рецепта
Рецепт выписан на бланке № 107-у, согласно МЗ РФ № 110 от 12.02.07 "О порядке назначения и выписывания лекарственных средств, изделий медицинского назначения и специализированных продуктов лечебного питания".
Ингредиенты прописи фармакологически, физико-химически и химически совместимы. Рецепт выписан массо-объемным способом.
Анализ лекарственной формы
Выписана всесторонне свободная комбинированная дисперсная система с жидкой дисперсионной средой. Дисперсная фаза представлена ионами, молекулами лекарственных веществ. Дисперсная среда вода. Недозированная лекарственная форма для внутреннего применения. Микстура.
Описание входящих ингридиентов.
Глюкоза (Glucosum) - Бесцветные кристаллы или белый мелкокристаллический порошок без запаха, сладкого вкуса. Растворимость: легко растворим в воде, трудно в спирте, не растворим в хлороформе. Хранение: в хорошо укупоренной таре. В защищенном от света месте.
Эуфиллин (Euphyiinum) - Белый или с желтоватым оттенком кристаллический порошок, с слабым аммиачным запахом. На воздухе поглощает углекислоту при этом растворимость уменьшается.. Растворимость: легко растворим в воде, водные растворы имеют щелочную реакцию. Хранение: в хорошо укупоренной, заполненной доверху таре предохраняющей от действия света. Список "Б" ВРД-0,5, ВСД - 1,5.
Калия иодид (Kalii iodidum) - Бесцветные или белые кубические кристаллы, или белый кристаллический порошок без запаха, солен-горького вкуса. На воздухе сыреет. Растворимость: легко растворим в воде, растворим в спирте, глицерине. Хранение: хорошо укупоренной таре оранжевого стекла.
Сироп сахарный (Sirupus sacharis) - вязкая бесцветная или слегка желтоватая жидкость без запаха сладкого вкуса. Содержание сахарозы до 80%.
Проверка доз
Определяем общий объем микстуры V Общ 100+5=105 мл
Определяем общее число приемов 105/15 = 7
Определяем разовую дозу эуфиллина 0,3/7= 0,04<0,5
Определяем суточную дозу эуфиллина 0,04х3 = 0,12<1,5
Дозы эуфиллина не завышены
Вывод лекарственную форму изготавливать можно.
Расчеты по прописи (лицевая сторона ППК)
Вариант 1 изготовление из сухих веществ
V Общ 100+5 = 105 мл
Глюкозы (влажность 10%) 10*100/100-10=11,11 КУО - 0,69 Смакс=3/0,69=4,34%
Эуфиллина 0,3
Калия иодида 2,0 КУО-0,25
Сиропа сахарного 5 мл
Концентрация сухих веществ 11,11+0,3+2,0=13,4%
Воды очищенной 100 - (11,11*0,69+2*0,25=91,8 мл
Вариант 2 изготовление с использованием концентрированных растворов
V Общ 100+5 = 105 мл
Эуфиллина 0,3 С%=0,28%
Р-ра Глюкозы 20% (1:5) *10=50 мл
Р-ра калия иодида 20% (1:5)*2,0=10 мл
Сиропа сахарного 5 мл
Воды очищенной 100 - 50-10=40 мл.
Теоретическое обоснование технологии изготовления
- - Изготовление ведут массо-объемным способом - Эуфиллин вещество списка "Б", проводят проверку доз. - Суммарное содержание порошкообразных веществ в общем объеме: > 3%, для предотвращения отклонения объема микстуры от допустимых значений используют коэффициенты увеличения объема. - Количество эуфиллина по прописи менее 1,0 , оно не будет оказывать существенного влияния на изменение объема микстуры, КУО эуфиллина можно не учитывать. - Глюкоза содержит 10% влаги - проводят перерасчет на увеличение массы глюкозы, согласно "Инстр. по приготовлению ЖЛФ в аптеках №308). - Так как все вещества легко растворимые в воде, растворение ведут, начиная с веществ выписанных в большем количестве. - Растворение начинают с вещества списка " Б"
Технология изготовления - вариант 1
В подставку отмеривают 92 мл воды очищенной, помещают в нее эуфиллин, растворяют, добавляют глюкозу, растворяют, смешивают. Затем в раствор вводят калия иодид, растворяют, смешивают. Проверяют полноту растворения.
Полученный раствор процеживают через марлевый тампон в отпускной флакон оранжевого стекла на 100 мл. Непосредственно в отпускной флакон добавляют сахарный сироп, тщательно перемешивают. Укупоривают и оформляют к отпуску.
Технология изготовления - вариант 2
В подставку отмеривают 40 мл воды очищенной, помещают в нее эуфиллин, растворяют. Проверяют полноту растворения.
Полученный раствор процеживают через марлевый тампон в отпускной флакон оранжевого стекла на 100 мл. К процеженному раствору добавляют 50 мл концентрированного раствора глюкозы 20%, перемешивают и добавляют 10 мл концентрированного раствора калия иодида 20%.перемешивают. Непосредственно в отпускной флакон добавляют сахарный сироп, тщательно перемешивают. Укупоривают и оформляют к отпуску.
Оформление
Основная этикетка "Внутреннее. Микстура", дополнительные этикетки: "Хранить в прохладном защищенном от света месте", "Беречь от детей"
Срок годности 3 суток, приказ № 214.
Оценка качества лекарственной формы
Обязательные виды контроля:
- письменный. После изготовления микстуры оформляют по памяти лицевую сторону.
Лицевая сторона ППК
Вариант1
Дата №рецепта
Aquae purificatae 92 ml
Euphyiini 0,3
Glucosi 11,11
Kalii iodidi 2.0
Sirupi saccharis 5 ml
VОбщ -105 ml
Приготовил (подпись) Проверил (подпись)
Расфасовал (подпись) Отпустил (подпись)
Лицевая сторона ППК
Вариант2
Дата №рецепта
Aquae purificatae 40 ml
Euphyiini 0,3
Sol. Glucosi 20% 50ml
Sol. Kalii iodidi 20% 10 ml
Sirupi saccharis 5 ml
VОбщ -105 ml
Приготовил (подпись) Проверил (подпись)
Расфасовал (подпись) Отпустил (подпись)
- - органолептический (микстура без цветная, без запаха, сладковато соленого вкуса Видимых механических включений не наблюдается) - контроль при отпуске.-
Микстура во флаконе оранжевого стекла. Флакон герметично укупорен пластиковой пробкой с навинчивающейся пластмассовой крышкой, При переворачивании флакона не наблюдается подтеканий.
Указанные в рецепте дозы эуфиллина не превышают ВРД и ВСД
Номера на рецепте и номера на этикетке, фамилия больного на квитанции фамилия на этикетке, соответствуют
Основные и дополнительные этикетки наклеены правильно, аккуратно.
- физический.
Заключается в измерении объема. Допустимые нормы отклонения для данного объема 3% (пр. №305).±3,15мл
- 105-3,15=101,85=102мл 105+3,15=108,15=108мл - химический. Проводят по выборке - опросный. Проводят выборочно
Вывод: Лекарственная форма приготовлена удовлетворительно согласно с действующими НД
Возьми: Натрия салицилата
Натрия бензоата поровну по 2,0
Нашатырно - анисовых капель 5мл
Сахарного сиропа 10 мл
Воды мятной до 150 мл
Смешай. Дай.
Обозначь. Принимать по 1 столовой ложке 3 раза в день.
Расчеты
Натрия салицилата 2,0
Натрия бензоата 2,0
С% сухих веществ (2,0+2,0)/100*150=2,7% менее 3%
Сиропа сахара 10 мл
Нашатырно-анисовых капель 5 мл
Воды мятной 150-10-5=135 мл
Vобщ =150 мл
Обоснование заполнения ППК
- - В данной микстуре растворителем будет являться мятная вода, поэтому в подставку для растворения ее помещаем первой. - Натрия бензоат и натрия салицилат хорошо растворимы в воде, согласно таблицы растворимости на растворение 1,0 натрия бензоата требуется 2 мл воды, а на растворение 1,0 натрия салицилат 1 мл поэтому растворение начинают с натрия бензоата - Сахарный сироп добавляют после растворения порошков, к уже процеженной микстуре. - Нашатырно-анисовые капли добавляют в последнюю очередь, в центр флакона, при тщательном перемешивании микстуры, во избежание попадания капель анисового масла на стенки флакона.
ППК
Aquae Menthae 135 ml
Natrii benzoatis 2.0
Natrii salicylatis 2.0
Sirupi sacchari 10 ml
Liquoris Ammonii anisatis 5 ml
V общ=150 мд
ОТВЕТ: 3
Задание 22. Для изготовления 1 л 20% раствора аммония хлорида взято 200 г препарата и 855 мл воды очищенной. Подтвердите эти количества соответствующими расчетами.
Расчеты
1. С использованием КУО
Аммония хлорида 20,0*1000/100=200,0
КУО аммония хлорида 0,72 мл/г (пр №308)
Воды очищенной 1000-200*0,72=856 мл
2. По плотности
Плотность 20% раствора аммония хлорида = 1,055г/см 3 (Пр. № 308).
Масса раствора 1000*1,055=1055,0
Аммония хлорида 20,0*1000/100=200,0
Воды очищенной 1055,0-200=855,0
Концентрированные растворы изготавливают:
A) в ассистентской комнате;
B) в массо-объемной концентрации;
C) на свежеприготовленной воде;
D) фильтруют;
E) определяют рН раствора
ОТВЕТ: В, С,D
В соответствии с Пр. № 308 от 21.10.97, "Об утверждении инструкции по изготовлению в аптеках жидких лекарственных форм", Концентрированные растворы изготавливают массо-объемным методом в мерной посуде в асептических условиях используя свежеполученную воду очищенную.
В случае отсутствия мерной посуды объем воды очищенной рассчитывают, используя значение плотности концентрата или коэффициент, соответствующий увеличению его объема при растворении 1 г лекарственного вещества.
Изготовленные растворы фильтруют, подвергают полному химическому контролю и проверяют на отсутствие механических включений.
Возьми: Кодеина фосфата 0,1
Настоя травы горицвета весеннего из 3,0-100 мл
Хлоралгидрата
Калия бромида поровну по 2,0
Смешай. Дай.
Обозначь. Принимать по 1 столовой ложке 3 раза в день.
Примечание: Сердечных гликозидов в сырье содержится 70 ЛЕД.
Recipe. Codeini phosphatis 0.1
Inf. Herbae Adonidis vernalis ex 3.0 100 ml
Chlorali hydrati
Kalii bromidi ana 2.0
Misce. Da.
Signa.
Принимать по 1 столовой ложке 3 раза в день
В рецепте выписана жидкая не дозированная лекарственная форма
Для внутреннего применения - микстура на основе водного извлечения. Настои и отвары - жидкие лекарственные формы, представляющие собой водные извлечения из лекарственного растительного сырья, а также водные растворы сухих или жидких экстрактов (концентратов). Это всесторонне свободные дисперсные системы с жидкой дисперсионной средой и различным характером дисперсной фазы.
Фармацевтическая экспертиза рецепта.
Пропись содержит кодеина фосфат - вещество списка "А", относящееся к списку II Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, утвержденного постановлением Правительства РФ от 30.06.1998 № 681.
Рецепт выписывают на специальном рецептурном бланке на наркотическое средство и психотропное вещество, который изготавливается на бумаге розового цвета с водяными знаками и имеет серийный номер.
Количество кодеина фосфата - 0,1 превышает предельно допустимое количество препарата на рецепт (0,2), согласно МЗ РФ № 110 от 12.02.07 "О порядке назначения и выписывания лекарственных средств, изделий медицинского назначения и специализированных продуктов лечебного питания".
Компоненты прописи совместимы.
Свойства ингредиентов.
Кодеина фосфат (Codeini phosphas) - белый кристаллический порошок, без запаха горького вкуса, выветривается на воздухе. Растворимость: легко растворим в воде, мало растворим в спирте, очень мало растворим в эфире и хлороформе Хранение: в хорошо закрытых банках оранжевого стекла, в защищенном от света месте. Сильнодействующее средство - ВРД - 0,2, ВСД - 0,3.
Трава горицвета ( Herbae Adonidis) ГФ ХI ст 43 стр.300
Кусочки стеблей, листьев, частей цветков и плодов различной формы, проходящих сквозь сито диаметром 7 мм. Цвет кусочков стеблей и листьев зеленый, цветков - золотисто-желтый. Запах слабый. Вкус не определяется.
Сырье содержит сердечные гликозиды. Хранение. В хорошо укупоренной таре. Биологическая активность 1 г травы должна быть 50-66 ЛЕД или 6,3-8 КЕД.
Хлоралгидрат (Chloralum hydratum) - бесцветные прозрачные кристаллы или мелко кристаллический порошок с характерным острым запахом и слегка горьковатым вкусом. Гигроскопичен, при повышенной влажности. На воздухе медленно улетучивается. Растворимость: очень легко растворим в воде, спирте, и эфире, легко растворим в хлороформе. Хранение: Сильнодействующее средство ВРД -- 2,0; ВСД -- 6,0. В хорошо укупоренной таре, предохраняющей от действия света, в прохладном месте.
Калия бромид (Kalii bromidum) - Бесцветные или Белые блестящие кристаллы или мелкокристаллический порошок, без запаха, соленого вкуса. Растворим в 1,7 ч. воды и м. р. в спирте. Хранение. В хорошо укупоренной таре, предохраняющей от действия света.
Aqua purificata (Вода очищенная) - Бесцветная, прозрачная жидкость, без запаха и вкуса, имеет значение pH = 5,0 - 7,0, не содержит хлоридов, сульфатов, нитратов, восстанавливающих веществ, кальция, углерода диоксида, тяжелых металлов, сухой остаток не более 0,001%, аммиака не более 0,00002%. В 1 мл воды очищенной не более 100 микроорганизмов при отсутствии Enterobacteriaceae, P. aeruginosa, S. aureus. Хранение. В асептических условиях не более 3 суток в закрытых емкостях.
Проверка доз.
Определяем общий объем микстуры V общ =100 мл
Определяем общее число приемов 100/15 =6
Определяем разовую дозу кодеина фосфата 0,1/6 = 0,017 < ВРД=0,2
Определяем суточную дозу кодеина фосфата 0,017х3 = 0,051 < ВСД=0,3
Определяем разовую дозу хлоралгидрата 2,0/6 = 0,33 < ВРД=2,0
Определяем суточную дозу кодеина фосфата 0,33х3 = 0,99 < ВСД=6,0
Дозы не завышены
Вывод лекарственную форму изготавливать можно.
Технология изготовления
А) из ЛРС.
Расчеты
Травы адониса 3,0 Квп= 2,8
Пересчет биологической активности сырья 3,0*66/70=2,8
Кодеина фосфата 0,1
Хлоралгидрата 2,0 КУО=0,76 мл/г
Калия бромида 2,0 КУО 0,27 мл/г
С% сухих веществ (0,1+2,0+2,0)*100/100=4,1% ?3%
Прирост объема 2,0*0,27+2,0*0,76=2,06=2,1
Воды очищенной 100+(2,8*2,8)-2,1 = 106 мл
Vобщ =100 мл
Особенности технологии.
Изготовление раствора проводят в соответствии с приказом МЗ РФ № 308 от 21.10.97, "Об утверждении инструкции по изготовлению в аптеках жидких лекарственных форм". Биологическая активность травы горицвета завышена, проводят пересчет на стандартное сырье.. Изготовление настоя ведут при строгом соблюдении температурного режима - настаивание в течении 15 мин, охлаждение 45 мин. Сердечные гликозиды - термолабильные вещества, и отклонение от установленного режима влечет за собой их расщепление до генинов, обладающих меньшей биологической активностью. Укорачивание срока охлаждения приготовленных настоев затрудняет переход в вытяжку горицвета - адонитоксина. Кодеина фосфат получают у провизора технолога, на обороте рецепта отмечают количество полученного вещества прописью.
Концентрация сухих веществ превышает 3%, изменение объема при растворении не будет укладываться в НДО. Прирост объема учитывают при расчете воды очищенной.
Расчеты
Технология изготовления
Сырье, при необходимости, просеивают от пыли и отвешивают на ВР - 5. В предварительно прогретую инфундирку помещают траву адониса, добавляют 106 мл воды очищенной комнатной температуры и настаивают на кипящей водяной бане в течение 15 минут при плотно закрытой инфундирке, после чего настой охлаждают в течение 45 минут. Извлечение фильтруют через двойной слой марли в подставку, сырье отжимают, при необходимости доводят до 100 мл. В настое растворяют 0,1 кодеина фосфата, затем 2,0 хлоралгидрата (кристаллогидрат) и 2,0 калия бромида, процеживают в отпускной флакон оранжевого стекла. Тщательно перемешивают, укупоривают, оформляют к отпуску.
Б) При использовании экстракта-концентрата горицвета жидкого 1:2 и концентрированного раствора калия бромида 20%
При использовании экстракта-концентрата травы горицвета, учитывают, что экстракт-концентрат содержит от 20 до 40 % этанола.
Расчеты:
Кодеина фосфата 0,1
Экстракта концентрата горицвета жидкого (1:2) * 3,0 = 6 мл
Раствора хлоралгидрата 20% (1:5)*2,0=10 мл
Раствора калия бромида 20% (1:5) *2,0 = 10 мл
Воды очищенной 100 - 6 -10-10 =74 мл
Vобщ =100мл
Технология изготовления
В подставку отмеривают 74 мл воды очищенной, растворяют в ней 0,1 кодеина фосфата, раствор процеживают через комбинированный фильтр в отпускной флакон темного стекла, добавляют 10 мл 20% концентрированного раствора хлоролгидрата и 10 мл 20% концентрированного раствора калия бромида. Тщательно перемешивают, укупоривают, оформляют к отпуску.
Упаковка
Флакон для отпуска оранжевого стекла вместимостью 100 мл, укупоривают пластмассовой пробкой с навинчивающимся колпачком. Опечатывают сургучом.
Оформление к отпуску
Основная этикетка "Внутреннее", дополнительные этикетки: "Хранить в прохладном месте, защищенном от света месте", "Перед употреблением взбалтывать", "Беречь от детей", "Обращаться с осторожностью". Лекарственный препарат хранят в сейфе до отпуска больному. (Единые правила оформления лекарств приготовляемых в аптечных учреждениях ...МУ, 1997; Пр МЗ РФ № 785).
Срок хранения 3 суток, (Приказ № 214 от 27.07.97).
Оценка качества лекарственной формы
Обязательные виды контроля:
- - письменный. После изготовления микстуры оформляют по памяти лицевую сторону. А) Лицевая сторона ППК
Дата №рецепта
Aquae purificatae 106 ml
Herbae Adonidis vernalis 3,0
Codeini phosphatis 0.1
Chlorali hydrati 2,0
Kalii bromidi 2,0
Vобщ = 100 ml
Приготовил (подпись)
Проверил (подпись)
Отпустил (подпись)
Б) Лицевая сторона ППК
Дата №рецепта
Aquae purificatae 74 ml
Codeini phosphatis 0.1
Sol. Chlorali hydrati 20% 10 ml
Sol. Kalii bromidi 20% 10 ml
Extr. Adonidis fluidi (1:2) 6 ml
Vобщ = 100 ml
Приготовил (подпись) Проверил (подпись)
Отпустил (подпись)
- органолептический - микстура светло-желтого цвета, без запаха, раствор прозрачный без видимых механических включений.
,- контроль при отпуске.
Микстура во флаконе вместимостью 100 мл. Флакон плотно укупорен пластиковой пробкой и пластмассовой завинчивающейся крышкой. При переворачивании флакона не наблюдается подтеканий. Флакон опечатан. Номера на рецепте и номера на этикетке, фамилия больного на квитанции фамилия на этикетке, соответствуют. Сигнатура выписана верно. Дозы кодеина фосфата и норма единовременного отпуска не завышены. Основные и дополнительные этикетки наклеены правильно, аккуратно,
- физический.
Заключается в измерении объема. Допустимые нормы отклонения для данного объема ±3% (пр. №305).
- 100% - 100мл 3% - х мл х=±3.0 мл [97 - 103 мл] - химический. Проводят полный химический анализ. - опросный. Проводят опросный анализ. (Приказ № 214 от 27.07.97).
Вывод: Лекарственная форма приготовлена удовлетворительно согласно с действующими НД
Задание 23. Выберите правильный ответ (ответ подтвердите расчетами)
1) Объем воды очищенной (мл), необходимый для изготовления микстуры по рецепту:
Возьми: Настоя травы пустырника 200 мл
Калия бромида 4.0
Настойки валерианы 10 мл
Смешай. Дай.
Обозначь. Принимать по 1 столовой ложке 3 раза в день.
А) из лекарственного растительного сырья:
А. 213
В. 200
С. 240
Д. 210
Е. 180
РАСЧЕТЫ:
Vобщ=200+10=210 мл
Травы пустырника (1:10) -20,0 Квп=2,0
Калия бромида 4.0
С %=4,0/100/210=1,9% С макс 2/0,27=7,4%
Настойки валерианы 10 мл
Воды очищенной 200+(20,0*2)=240 мл
ОТВЕТ: С.
Б) из жидкого стандартизованного экстракта пустырника при условии использования концентрированного раствора калия бромида 20%:
А. 160
В. 200
С. 180
Д. 140
Е. 210
РАСЧЕТЫ:
Жидкого стандартизированного экстракта пустырника (1:2)*20,0 =40мл
Раствора Калия бромида 20% (1:5)*4.0=20мл
Настойки валерианы 10 мл
Воды очищенной 200-(20-40)=140мл
Vобщ=210мл
ОТВЕТ: Д.
2) Выберите и обоснуйте правильные ответы:
Отвар изготавливают из:
А. Травы термопсиса
В. Листьев брусники
С. Коры крушины
Д. Листьев мяты
ОТВЕТ: В, С.
ОБОСНОВАНИЕ: Отвары изготавливают из сырья с плотной гистологической структурой растительных тканей, таких как коры, корни, плоды и семена, кожистые листья.
Задание 24. Возьми: Камфоры 2,0
Адонизида 5 мл
Настойки пустырника 10 мл
Воды очищенной 100 мл
Смешай. Дай.
Обозначь. Принимать по 1 столовой ложке 3 раза в день.
Recipe. Camphorae 2.0
Adonisidi 5 ml
Tincturae Leonuri 10 ml
Aquae purificatae 100 ml
Misce. Da
Signa. Принимать по 1 столовой ложке 3раза в день
В рецепте выписана гетерогенная лекарственная форма для внутреннего применения - суспензия. Суспензии жидкая лекарственная форма, содержащая в качестве дисперсной фазы одно или несколько измельченных
Порошкообразных лекарственных средств, распределенных в жидкой дис-персионной среде.
Фармацевтическая экспертиза прописи:
Компоненты прописи совместимы.
Проверка доз адонизида.
Общий объем 100 +10+5=115мл
Число приемов 115/15=7,7
РД = 5/7,7=0,65
1мл = 34 капли 0,65 мл=22 капли ВРД=40 капель
СД= 22*3=66 капель ВСД=120 капель
Дозы не завышены.
Свойства ингредиентов.
Камфора (Camphora) - бесцветный кристаллический порошок с сильным специфическим запахом, пряновато-горьким, затем охлаждающим вкусом. Растворимость. Мало растворим воде, легко растворим в спирте, эфире, хлороформе, жирных и эфирных маслах. Хранение. В хорошо укупоренной таре, прохладном месте.
Желатоза (Gelatosa) -- это продукт неполного гидролиза желатина. Представляет собой слегка желтоватый гигроскопический порошок, не обладает способностью желатинироваться, но имеет высокие эмульгирующие свойства. Ограниченно растворима в воде. Хранение в хорошо укупоренной таре.
Адонизид (Adonisidum) - Прозрачная жидкость слегка желтоватого цвета, своеобразного запаха, горького вкуса. Легко растворим в 1,5 ч. воды и умеренно растворим в спирте. Концентрация этанола в 1 мл конечного продукта - 20% этанола, 0,5% хлорбутанолгидрата и 23--27 ЛЕД.. Хранение. Сильнодействующее средство ВРД - 40 капель, ВСД - 120 капель 1 мл содержит 34 станд. капли. Хранить в прохладном, защищенном от света месте.
Настойка пустырника (Tinctura Leonuri) - Прозрачная жидкость зеленовато-бурого цвета, слабого ароматного запаха. Настойка из травы пустырника пятилопастного и пустырника обыкновенного на 70% этиловом спирте (1:5). Хранение в прохладном, защищенном от света месте.
Вода очищенная (Aqua purificata) - Бесцветная, прозрачная жидкость, без запаха и вкуса, имеет значение pH = 5,0 - 7,0, не содержит хлоридов, сульфатов, нитратов, восстанавливающих веществ, кальция, углерода диоксида, тяжелых металлов, сухой остаток не более 0,001%, аммиака не более 0,00002%. В 1 мл воды очищенной не более 100 микроорганизмов при отсутствии Enterobacteriaceae, P. aeruginosa, S. aureus. Хранение. В асептических условиях не более 3 суток в закрытых емкостях.
Расчеты:
Vобщ -115 ml
Камфоры 2,0
Желатозы 2,0
Сухих компонентов 2*100/115=1,7%
Адонизида 5 мл
Настойки пустырника 10 мл
Воды очищенной 100 мл
Особенности технологии.
Изготовление суспензии ведут согласно "Инструкции по изготовлению в аптеках жидких лекарственных форм", утвержденной приказом № 308 от 21.10.97. Концентрация сухих веществ не превышает 3%, изготовление ведут массо-объемным методом. Камфора относится к группе гидрофобных веществ с резко выраженными гидрофобными свойствами, для получения стойкой суспензии, необходимо добавлять стабилизатор. Стабилизатор для камфары в прописи не указан, можно использовать согласно желатозу, в количестве 1,0 на 1,0. Камфора относиться к трудно измельчаемым вещества, для улучшения диспергирования добавляют 95% этанол в количестве 10-15 капель на 1,0 камфары. Камфора - пахучее вещество ее отвешивают на специальных весах для пахучих веществ.
Изготовление суспензии ведут дисперсионным способом. Для измельчения порошка добавляют жидкость по правилу Дерягина в количестве равном Ѕ от массы сухих веществ с целью обеспечения расклинивающего действия
Технология изготовления.
В ступку отвешивают 2,0 камфары, смачивают 20 каплями 95% этанола и тщательно растирают и отодвигают на край ступки. В центр ступки отвешивают 2,0 желатозы, прибавляют 2 мл воды, растирают. К приготовленному эмульгатору небольшими порциями добавляют камфару. Смесь тщательно диспергируют в течении 2-3 минут. Первичную пульпу разбавляют частью воды, оставляя немного воды для ополаскивания ступки, и переносят в отпускной флакон. Ступку обмывают остатком воды и объединяют с готовой суспензию взбалтывают и добавляют 5 мл адонизида и 10 мл настойки пустырника. Флакон укупоривают и тщательно взбалтывают.
Упаковка
Флакон бесцветного стекла плотно укупоривают пластиковой пробкой с навинчивающимся пластмассовым колпачком.
Оформление к отпуску
Основная этикетка "Наружное", дополнительная этикетка "Перед употреблением взбалтывать", "Хранить в прохладном, защищенном от света месте". "Беречь от детей" (Единые правила оформления лекарств приготовляемых в аптечных учреждениях, МУ, 1997).
Срок годности 3 суток (Приказ № 214 от 27.07.97).
Оценка качества лекарственной формы
Обязательные виды контроля:
- письменный. После изготовления суспензии оформляют по памяти лицевую сторону.
ППК
Дата
№рецепта
Camphorae 2.0
Sp. aethylici 95% XХ gtts
Gelatosae 2.0
Aque purificatae 100 ml
Adonisidi 5 ml
Tincturae Leonuri 10 ml
V общ = 115 ml
Приготовил (подпись) Проверил (подпись)
Отпустил (подпись)
- - органолептический. Суспензия равномерно светло желтого цвета, без видимых механических включений, с запахом камфары. - Контроль при отпуске. Флакон герметично укупорен пластиковой пробкой с навинчивающейся пластмассовой крышкой, При переворачивании флакона не наблюдается подтеканий.
Номера на рецепте и номера на этикетке, фамилия больного на квитанции фамилия на этикетке, соответствуют. Основные и дополнительные этикетки наклеены правильно, аккуратно. Дозы адонизида не завышены.
- физический.
Заключается в измерении объема. Допустимые нормы отклонения для данного объема ±3% (пр. №305).
115 ± 3,5 мл [111,5- 118,5]
Выборочные виды контроля
Однородность частиц дисперсной фазы определяют при микроскопировании. В суспензиях не должно быть неоднородных, крупных частиц дисперсной фазы. Размер частиц не должен превышать показателей, указанных в частных статьях на суспензии отдельных лекарственных веществ. Обычно размер частиц не превышает 50 мкм.
Время отстаивания характеризует кинетическую устойчивость суспензии. Об устойчивости суспензии судят по величине отстоявшегося слоя.
Ресуспендируемость Характеризует способность суспензии восстанавливать свои свойства как гетерогенной системы при взбалтывании. При нарушении агрегативной устойчивости суспензий они должны восстанавливать равномерное распределение частиц по всему объему после 24 ч хранения при взбалтывании в течение 15-20 с, а после 3 суток хранения в течение 40-60с.
Сухой остаток проверяют с целью проверки точности дозирования суспензий. Для этого отмеривают необходимое количество суспензии, высушивают и устанавливают массу сухого остатка
- - Химический. Проводят по выборке - Опросный. Проводят выборочно
Вывод: Лекарственная форма приготовлена удовлетворительно согласно с действующими НД
Задание 25. Выберите и обоснуйте правильный(ые) ответ(ы)
Агрегативная устойчивость растворов защищенных коллоидов обеспечивается:
A. оболочкой из ВМВ
B. вязкостью среды
C. сольватным слоем
D. охлаждением раствора
Агрегативная устойчивость - способность частиц дисперсной фазы противостоять слипанию, агрегации. Агрегативная устойчивость обеспечивается наличием заряда на поверхности частиц; оболочкой из ВМС, ПАВ вокруг частиц дисперсной фазы, препятствующей слипанию. Кроме того, вокруг оболочки ПАВ ориентируются молекулы дисперсионной среды, т. е. образуется сольватный слой.
Защитный слой (белок) обеспечивает сольватацию частиц, что создает повышенную устойчивость системы. Вследствие малого размера частиц в растворах защищенных коллоидов в значительно большей степени выражено броуновское движение, что приводит к отталкиванию гибких макромолекул и повышает устойчивость системы.
Некоторые ВМС повышают вязкость среды, что способствует агрегативной устойчивости растворов защищенных коллоидов.
ОТВЕТ : А, Б, С.
Выберите признаки, характеризующие суспензию:
A. дисперсная фаза представлена мицеллами
B. под действием электролита происходит высаливание
C. высокое осмотическое давление
D. дисперсная фаза представлена твердыми частицами
Суспензии представляют собой микрогетерогенные дисперсные системы, состоящие из твердой дисперсной фазы и жидкой дисперсионной среды.
При добавлении в качестве стабилизаторов к суспензии ПАВ образуются частицы с нетральным зарядом, что способствует устойчивости суспензии.
Частички суспензий могут быть стабилизированы и добавлением электролитов, которые создают в пограничном слое дзета-потенциал определенного знака и величины. Возникновение дзета-потенциала в суспензиях объясняется так же, как и заряжение ядра мицеллы в гидрофобном золе: адсорбция ионов из раствора и диссоциация или гидролиз поверхностного слоя твердой фазы.
Однако электролиты стабилизируют суспензии только в определенных концентрациях. Если превышается концентрация электролита, то стабилизирующее действие электролита переходит в коагулирующее. Устойчивость нарушается за счет самопроизвольного слипания частиц, при добавлении электролитов (которые, гидратируясь, отнимают воду от мицеллы коллоидного раствора, то есть нарушается водная оболочка вокруг коллоидных частиц, в результате чего частицы укрупняются и происходит их оседание
Частицы дисперсной фазы суспензий, хотя и очень медленно, но непрерывно оседают, в связи с чем в них, в отличие от коллоидных золей, не наблюдается диффузионного распространения дисперсной фазы и нет осмотического давления.
ОТВЕТ: D, B
Количество стабилизатора (г) и оптимальное количество жидкости (мл), необходимое для получения пульпы и общий объем (масса) лекарственной формы по рецепту:
Возьми: Сульфадимезина 2,0
Натрия бензоата 0,5
Воды очищенной 100 мл
Смешай. Дай. Обозначь.

Расчеты
Сульфадимезина 2,0 С% 2,0*100/100=2%
Твина -80 0,1*2=0,2
Воды для первичной пульпы (2,0+0,2)/2=1,1 мл
Натрия бензоата 0,5 С% 0,5*100/100=0,5%
Воды очищенной 98,9 мл
V общ=100 мл
ОТВЕТ: В.
Задание 26. Возьми: Эмульсии масляной 180,0
Камфоры 2,0
Смешай. Дай.
Обозначь: Принимать по 1 столовой ложке 3 раза в день
- А) Студент растворил в фарфоровой чашке 2,0 камфоры в 18,0 подогретого до 45О С подсолнечного масла. В ступку к 100,0 свежеприготовленного 10% - го раствора крахмала, добавил небольшими порциями при перемешивании масляный раствор камфоры. Первичную эмульсию постепенно разбавил 62 мл воды очищенной. Профильтровал во флакон для отпуска через двойной слой марли. Б) Студент растворил в фарфоровой чашке 2,0 камфоры в 18,0 подогретого до 45О С персикого масла, охладил. В ступку поместил 9,0 крахмала, добавил 13,5 мл воды очищенной, заием масляный раствор камфоры, перемешал до характерного потрескивания. Разбавил постепенно 153 мл водой очищенной, профильтровал во флакон для отпуска через двойной слой марли.
Расчеты:
Мобщ=182,0
Масла подсолнечного (1:10)=18,0
Камфоры 2,0
Крахмала 2,0+18/2=10,0
Раствора крахмала 10% =100мл
Воды 182-18-2,0-100=62мл
ППК
Olei Helianthi 18.0
Camphorae 2.0
Sol. Amyli 10% 100 ml
Aquae purificatae 62 ml
М общ=182,0
ОТВЕТ А.
Задание 27.Выберите правильный ответ:
Количество воды очищенной (мл) для изготовления и разбавления корпуса эмульсии по рецепту: ( эмульгатор - желатоза)
Возьми: Камфоры 2,0
Эмульсии масляной 200,0
Смешай. Дай.
Обозначь. Принимать по 1 столовой ложке 3 раза вдень.
А. 16,5 152,5
B. 15 155
C. 15 185
D. 16,5 150,5
Е.16,5 180
Расчеты
Масла подсолнечного 20,0
Камфоры 2,0
Желатозы (20+2)/2=11,0
Воды для первичной эмульсии 33/2=16,5
Воды очищенной 202-20-2,0-11-16,5==152,5
ОТВЕТ А
Установите соответствие:
|
Лекарственное средство |
Способ введения в эмульсию |
|
А. растворяют в воде для получения корпуса эмульсии В. Растворяют в части воды для разбавления корпуса эмульсии С. растворяют в масле D. измельчают с готовой эмульсией Е. измельчают со стабилизатором и готовой эмульсией |
ОТВЕТ 1 В
- 2. В 3. E 4. В
Возьми: Анестезина 2,0
Ментола 0,2
Мази цинковой 30,0
Смешай. Дай.
Обозначь. Для нанесения на пораженные участки кожи.
Rp. Anaesthesini 2.0
Mentholi 0.2
Ung. Zinci 30.0
Misce.
Da. Signa. Для нанесения на пораженные участки кожи.
В рецепте выписана мягкая лекарственная форма - мазь. Мази - мягкая лекарственная форма для нанесения на кожу раны или слизистые оболочки. Мази относятся к свободным всесторонне дисперсным системам с упруго-вязкой дисперсионной средой.
Фармацевтическая экспертиза прописи:
Компоненты прописи совместимы.
Лекарственная форма для наружного применения дозы не проверяют..
Свойства ингредиентов.
Анестезин (Anaesthesinum) - белый кристаллический порошок без запаха, слабо-горького вкуса; вызывает на языке чувство онемения. 1 г растворим в 2500 мл воды, 5 мл этанола, 4 мл эфира, 2 мл хлороформа, в жирных маслах (от 30 до 50 мл). Хранение: в хорошо укупоренной таре Сильнодействующее средство ВРД - 0,5, ВСД - 1,5.
Ментол (Mentholum) - бесцветные кристаллы или белый порошок с специфическим запахом. Растворимость: мало растворим в воде, растворим в маслах, этаноле, эфире, ацетоне, хлороформе, уксусной кислоте, гексане. Хранение: в хорошо укупоренной таре в прохладном месте
Оксид цинка (Zinci oxydum). Белый или с желтоватым оттенком порошок, без запаха. Поглощает углекислоту воздуха. Не растворяется в воде и спирте, растворяется в слабых кислотах. Хранят в хорошо укупоренной таре.
Вазелин (Vaselinum) - густая мазеобразная масса, белого цвета без запаха и вкуса. Температура плавления -- 27-60 °C, вязкость -- 28-36 ммІ/с при 50 °C. Растворим в эфире и хлороформе, не растворим в воде и спирте, смешивается с любыми маслами, кроме касторового. Хранение в хорошо укупоренной таре.
Расчеты.
Анестезина 2,0 С%=2,0*100/30=6,7%
Ментола 0,2
Цинка оксида 3,0
Твердой фазы (2,0+3,0)*100/30=16,6% более 5%
Вазелина 27,0
М общ=32,2
Особенности технологии.
В рецепте выписана комбинированная мазь.
Ментол растворим в основе, образует мазь-раствор. Анестезин в концентрации 6,7% не раствориться в 27,0 вазелина, поэтому его вводят в мазь по типу суспензии. Оксид цинка образует суспензионную мазь. Предварительное измельчение оксида цинка лучше проводить в подогретой до 60С ступке. Концентрация суспензионных компонентов превышает 5% , измельчение проводят с Ѕ от массы порошков, расплавленного вазелина.
Технология изготовления.
В подогретую ступку отвешивают 3,0 оксида цинка и растирают в мельчайший порошок, добавляют анестезин, измельчают, затем дерматол, смешивают и измельчают. К измельченным порошкам добавляют около 2,5 вазелина, подплавляют под лампой и растирают в мельчайшую суспензию.
В фарфоровую чашку переносят оставшийся вазелин и расплавляют, затем при температуре не выше 40 С, растворяют ментол.
К полученной суспензионной массе, по частям добавляют раствор ментола. Массу перемешивают. Проверяют на однородность.
Мазь переносят в широкогорлый флакон, оформляют к отпуску.
Упаковка с укупоркой
Флакон закрывают пергаментным кружком и навинчивающейся крышкой.
Оформление.
Оформляют к отпуску этикеткой "Наружное. Мазь", дополнительной этикеткой "Хранить в прохладном месте", "Беречь от детей" (Единые правила оформления лекарств, МУ, 1997)
Срок годности - 10 дней (пр. № 214).
Оценка качества изготовленной лекарственной формы
Обязательные виды контроля
- письменный контроль. После изготовления мази по памяти заполняют лицевую сторону ППК.
ППК №
Дата № рецепта
Zinci oxydi 3.0
Anaesthesini 2.0
Vaselini 2,5
Vaselini 24,5
Mentholi 0.2
М общ = 32.2
Приготовил
Проверил
Отпустил
- органолептический - во флаконе мазь лимонно-желтого цвета без видимых механических включений.
Однородность смешивания. При рассмотрении с рассмотрения 25 -30 см, четырех проб мази в количестве 0,02-0,03 г, помещенных на предметное стекло, (по две пробы на каждое) прикрытых и прижатых вторым предметным стеклом, не наблюдается видимых частиц.
- контроль при отпуске.
Флакон герметично укупорен навинчивающейся пластмассовой крышкой с пергаментной прокладкой. Номера на рецепте и номера на этикетке, фамилия больного на квитанции фамилия на этикетке, соответствуют. Основные и дополнительные этикетки наклеены правильно, аккуратно,
- физический. Заключается в измерении массы. Допустимые нормы отклонения для данной массы 5% (пр. №305). 32,2±1,61
Масса макс.=33,81
Масса мин.=30,59
- - химический. По выборке - опросный. По выборке
Вывод: Лекарственная форма приготовлена удовлетворительно
Задание 28. Выберите и обоснуйте правильный(ые) ответ(ы)
К гидрофильным мазевым основам относятся:
A. гель метилцеллюлозы
B. желатин+глицерин+вода
C. крахмал+глицерин+вода
D. воск пчелиный+вазелин
ОТВЕТ А, В,С гидрофильные основы характерной особенностью является способность растворения в воде. Гидрофильные основы не оставляют жирных следов, лучше смываются с кожи и белья. Недостатком их является малая устойчивость к микробной контаминации. Сюда входят гели ВМ углеводов и белков, синтетических ВМС, неорганических веществ.
К липофильным мазевым основам относятся:
A. желатин+глицерин+вода
B. жир свиной+парафин+вазелин
C. воск пчелиный+масло персиковое+ланолин безводный
D. вазелин+парафин+масло вазелиновое
ОТВЕТ В, D Липофильные основы это разнородные в химическом отношении вещества, имеющие ярко выраженную гидрофобность. Сюда входят жиры и их производные, воски, углеводороды и силиконовые основы. (жиры гидрогенизированные - продукты, получаемые при каталитическом гидрогенизировании масел растительных. При этом непредельные глицериды переходят в предельные, и жидкие масла меняют консистенцию на мягкую и твердую в зависимости от степени гидрогенизации.
К липофильно-гидрофильным мазевым основам относятся:
A. вазелин+вода+эмульгатор Т-2
B. вазелин+ланолин безводный
C. гель натрий карбоксиметилцеллюлозы
D. ПЭО-400+ПЭО-1500+натрия лаурилсульфат
ОТВЕТ А, В, Д
Липофильно-гидрофильные основы представляют собой различные по составу искусственно созданные композиции, обладающие как липофильными, так и гидрофильными свойствами. Преимуществом является то, что в них можно легко вводить как водо-, так и жирорастворимые вещества, водные растворы лекарственных веществ. Основы обеспечивают высокую резорбцию лекарственных веществ из мазей, не препятствуют газо - и теплообмену кожных покровов, поддерживают ее водный баланс, обладают хорошими консистентными свойствами.
Различают абсорбционные (гидрофильные и гидрофобные) и эмульсионные (тип "вода -- масло" и "масло -- вода").
В качестве обязательного компонента в их состав входит эмульгатор -- ПАВ.
Применение вазелиново-ланолиновых основано на способности ланолина инкорпорировать более 150% воды не теряя при этом мазеобразной консистенции. С его помощью можно вводить в мази большое количество водных жидкостей
Установите соответствие:
Возьми: Эфедрина гидрохлорида 0,1
Новокаина гидрохлорида 0,5
Ланолина
Вазелина поровну по 10,0
Смешай. Дай.
Обозначь. Мазь для носа.
A. мазь-раствор
B. мазь-суспензия
C. мазь-эмульсия
D. мазь комбинированная
E. паста
Ответ С
Эфедрина гидрохлорид и новокаина гидрохлорид легко растворимы в воде, поэтому их вводят в основу, растворяя в минимальном количестве воды, полученный раствор смешивают с ланолином а затем с вазелином. Образуется эмульсионная мазь.
Оптимальное количество вспомогательной жидкости по рецепту:
Возьми:
Серы осажденной 5,0
Дегтя березового 2,0
Вазелина 20,0
Смешай. Дай.
Обозначь для повязки.
А. Глицерин 2,5
В. Масло вазелиновое 2,5
С. Вазелин расплавленный 2,5
D. Масло вазелиновое 5,0
Е. Вазелин расплавленный 5,0
Концентрация серы осажденной более 3%, поэтому в качестве вспомогательной жидкости берем основу в половинном количестве от действующего вещества, значит вазелина расплавленного 2,5 г, ответ С
Возьми: Кислоты борной
Стрептоцида поровну по 0,3
Фурацилина 0,02
Масла какао достаточное количество.
Смешай, чтобы получился суппозиторий. Дай таких доз № 12.
Обозначь. Вводить по 1 свече в прямую кишку на ночь.
Recipe : Acidi borici
Streptocidi ana 0.3
Furacillini 0.02
Olei Cacao quantum satis
Misce ut fiat suppositоrium
Da tales dosis numero 12
Signa. По 1 свече на ночь.
В рецепте выписана мягкая лекарственная форма - суппозитории. Суппозитории дозированная лекарственная форма, твердая при комнатной температуре и расплавляющаяся или распадающаяся при температуре тела, предназначенная для введения в различные полости тела, применяемые для введения в полости тела. Суппозитории относятся к свободным всесторонне дисперсным системам с упруго-вязкой дисперсионной средой.
Фармацевтическая экспертиза прописи:
Компоненты прописи совместимы.
Проверка доз
Разовая доза стрептоцида по прописи=0,3 < ВРД - 2,0
Суточная доза стрептоцида по прописи=0,3 < ВСД - 7,0
Разовая доза фурацилина по прописи=0,02 < ВРД - 2,0
Суточная доза фурацилина по прописи=0,3 < ВСД - 7,0
Дозы не завышены.
Свойства ингредиентов.
Кислота борная (Acidum boricum) - блестящие слегка жирные на ощупь чешуйчатые кристаллы или мелкокристаллический порошок без запаха. Растворимость: растворим в 25 частях воды, 4 ч. горячей воды, 25 частях спирта и медленно в 7 ч. глицерина. Хранение в хорошо укупоренной таре
Стрептоцид (Streptocidum) белый кристаллический порошок без запаха. Растворимость: мало растворим в воде, легко растворим в кипящей воде, трудно растворим в спирте, нерастворим в эфире и хлороформе. Хранение : в хорошо укупоренной таре. Сильнодействующее средство ВРД - 2,0, ВСД - 7,0.
Фурацилин (Furacillinum) - желтый или зеленовато-желтый мелко кристаллический порошок без запаха, горького вкуса. Растворимость. Очень мало растворим в воде 1:4200,мало растворим в спирте, практически не растворим в хлороформе. Хранение в хорошо укупоренной таре, прохладном, защищенном от света месте. Сильнодействующее средство ВРД-0,1; ВСД-0,5
Масло какао (Oleum Cacao) - Плотная однородная масса желтоватого цвета, слабого ароматного запаха какао и приятного вкуса, хрупкая при комнатной температуре и плавиться при температуре 30-34°С, превращаясь в прозрачную жидкость. Хранение. В хорошо укупоренной таре в прохладном защищенном от света месте.
Расчеты
М общ=3,0*12=36,0
Борной кислоты 0,3*12=3,6
Стрептоцида 0,3*12=3,6
Фурацилина 0,02*12=0,24
Масла какао 36-(3,6+3,6+0,24)=28,56
Сухих компонентов (3,6+3,6+0,24)*100/36.0=20.7%
Ланолина безводного для пластификации 1,0*36/30=1.2
МОбщ=36,0
М1=3,0
Особенности технологии.
Количество масла какао для изготовления одного суппозитория не указанно, согласно ГФХI, масса одного суппозитория должна быть равна 3,0. Фурацилин, борная кислота требуют большого количества воды для растворения, стрептоцид не растворим в воде, поэтому эти вещества вводят в суппозиторную массу по типу суспензии. Безводный ланолин в данной прописи требуется добавлять из-за большой концентрации суспензионных компонентов, с целью придания пластичности суппозиторной массе.
Стрептоцид и борная кислота относиться к трудно измельчаемым веществам, их измельчают в присутствии 5 капель 95% этанола на 1,0 вещества.
Технология изготовления
В ступку отвешивают стрептоцид и борную кислоту, смачивают 18 каплями 95% этанола и тщательно растирают, к влажной массе вводят фурацилин смешивают и измельчают. К полученной массе порошков добавляют приблизительно 3,72 измельченного масла какао, тщательно растирают. Затем начинают добавлять оставшееся масло какао понемногу вводя безводный ланолин. Уминают до получения однородной пластичной массы отстающей от стенок ступки и собирающееся на головке пестика.
Изготовленную массу собирают капсулаторкой, помещают на вощенную капсулу и взвешивают, отмечают на рецепте и паспорте письменного контроля.
Из сформированного шара на матовой поверхности стекла пилюльной машинки формируют максимально правильный брусок. При помощи ножа делят брусок на 12 равных доз. Каждую дозу скатывают сначала в шар, а затем формируют суппозиторий. Упаковывают в "кулечки" из вощеных капсул и укладывают в картонную коробку.
Оформление
Основная этикетка "Наружное", дополнительные этикетки "Хранить прохладном защищенном от света месте", "Беречь от детей", Срок годности - 10 дней (пр. № 214).
Оценка качества изготовленной лекарственной формы
- Письменный контроль. После изготовления суппозиториев по памяти заполняют лицевую сторону ППК.
ППК №
Дата № рецепта
Streptocidi 3.6
Acidi borici 3.6
Spiritus aethylici 95% XVIII gtts.
Furacillini 0.24
Olei Cacao 28,56
Lanolini anhydrici 1.2
Мобщ=36,0
М1=3,0
№ 12
Приготовил (подпись) Проверил (подпись)
Расфасовал (подпись) Отпустил (подпись)
- - Органолептический в вощеных капсулах суппозитории светло-желтого цвета конической формы, с запахом масла какао, без видимых механических включений. - Контроль при отпуске.
Каждый суппозиторий помещен в отдельный кулечек из вощеной капсулы. Суппозитории аккуратно уложены в картонную коробку.
Номера на рецепте и номера на этикетке, фамилия больного на квитанции фамилия на этикетке, соответствуют. Дозы фурацилина и стрептоцида не завышены. Основные и дополнительные этикетки наклеены правильно, аккуратно.
- физический.
Однородность. На продольном срезе суппозиторная масса однородна без вкраплений.
Отклонение в массе. Заключается в измерении средней массы одного суппозитория. Допустимые нормы отклонения для данной лекарственной формы 5% (ГФ ХII.).
- 100% - 3,0 5% - х гр х=0,15р [2,85-3,15]
Дополнительно Время полной деформации (согласно ГФ XII).
- - химический. Проводят выборочный химический анализ. - опросный. Проводят выборочно.
Вывод: Лекарственная форма приготовлена удовлетворительно согласно действующим НД.
Задание 29. Выберите правильный ответ (ответ подтвердите расчетами)
Количество основы по рецепту:
Возьми: ксероформа 0,5
Витепсола достаточное количество
Смешай, чтобы образовался суппозиторий.
Дай таких доз числом 20
Обозначь. Вводить по 1 суппозиторию 3 разав день в прямую кишку.
А. 59,9 В. 60,0 С.72,6 Д.53,7 Е.50,0
РАСЧЕТЫ:
М общ=3,0*20=60,0
Ксерофома 0,5*20=10,0 1/ЕЖ=0,63
Витепсола 60-10*0,63=53,7
ОТВЕТ Д
Задание 30. Возьми: Раствора новокаина гидрохлорида 1% - 50 мл
Простерилизуй!
Дай. Обозначь. Вводить в/м по 5 мл 3 раза в неделю
Recipe: Solutionis Novocaini 1% - 50ml
Sterilisetur!
Da. Signa. Вводить в/м по 5 мл 3 раза в неделю.
Инъекционные растворы - лекарственная форма представляющая собой водные и не водные растворы, вводимые в организм с нарушением целостности кожных и слизистых покровов.
По дисперсологической классификации инъекционные растворы это всесторонне свободная дисперсная система с жидкой дисперсионной средой. Дисперсная фаза представлена в виде молекул или ионов лекарственных веществ.
Растворы для инъекций должны быть: прозрачны, не содержать механических включений, быть стерильными, апирогенными, не токсичными. К растворам также предъявляется требование стабильности, точное содержание лекарственных веществ. Дополнительные требования: изотоничность, изогидричность, изоионичность.
Фармацевтическая экспертиза.
Компоненты прописи совместимы.
Свойства ингредиентов.
Новокаин (Novocainum) - белый кристаллический порошок без запаха, горького вкуса вызывает чувство онемения на языке. Растворимость. Очень легко растворим в воде, легко в спирте, практически не растворим в хлороформе. Хранение. В хорошо укупоренной таре оранжевого стекла. Сильнодействующее средство ВРД - 0,25; ВСД - 0,75.
Вода для инъекций (Aqua pro ingectionibus) - должна удовлетворять всем требованиям, предъявляемым к воде очищенной, а также должна быть Стерильной и Апирогенной. Стерильность воды определяется методами, изложенными в статье "Испытания на стерильность" ГФ ХI издания, с. 187-192. Испытание Пирогенности воды проводят биологическим методом, приведенным в статье "Испытание на пирогенность" ГФ ХI издания, с. 183-185.
Расчеты
Vобщ= 50 мл
Новокаина 1.0*50/100=0,5 КУО=0,33мл/г
С%=1% Смакс=4/0,33=12,12
Раствора хлористоводородной кислоты 0,1М -0,45 мл до рН 3,8-4,5
Воды для инъекций 49,55 мл
Особенности технологии.
При изготовлении инъекционных растворов руководствуются НД: Пр.№ 214 от 16.07.1997 "О контроле качества лекарственных средств изготовляемых в аптечных организациях"; Пр. № 308 от 21.10.97, "Об утверждении инструкции по изготовлению в аптеках жидких лекарственных форм"; Пр. № 309 от 21.10.1997 "Об утверждении инструкции по санитарному режиму аптечных организаций (аптек)", "Методических указаний по изготовлению стерильных растворов в аптеках, 1994"и др.
Пропись нормирована Пр. № 214, прил.2, пропись № 42.
Субстанцию новокаина используют марки "годен для инъекций". При отсутствии данной марки можно использовать марку "х. ч.", при этом субстанция должна быть стерильной и апирогенной.
Концентрация лекарственного вещества не превышает максимальную концентрацию, при которой увеличение объема при растворении сухого вещества будет укладываться в НДО пр.№ 305.
Новокаин - соль образованная слабым основанием и сильной кислотой, для предотвращения гидролиза при стерилизации, раствор стабилизируют 0,1 М раствором хлороводородной кислоты в количестве 9 мл на 1 литр раствора (до рН 3,8-4,5).
Добавление кислоты создает избыток водородных ионов, что понижает диссоциацию воды и подавляет гидролиз соли новокаина, сдвигая равновесие реакции гидролиза в обратную сторону.
Технология изготовления
1. Растворение
В стерильной подставке в 49,55 мл воды для инъекций растворяют 0,5 новокаина. Добавляют 0,45 мл 0,1 М хлористоводородной кислоты. Перемешивают.
Контроль: проверка полноты растворения. Химический контроль.
2. Фильтрование
После полного химического контроля раствор фильтруют через промытый комбинированный фильтр (складчатый бумажный фильтр с подложенным тампоном длинноволокнистой стерильной ваты) или через стеклянный фильтр № 3 или 4, в стерильный флакон на 50мл.
Контроль: отсутствие механических включений.
3. Упаковка с укупоркой
Флакон с раствором укупоривают стерильной резиновой пробкой и обкатывают металлическим колпачком.
Контроль: герметичность укупорки.
4. Подготовка к стерилизации
Укупоренный флакон обвязывают смоченной пергаментной бумагой, на "язычке" которой указывают: № требования, состав прописи, режим стерилизации, дату изготовления, подпись изготовившего.
5. Стерилизация (не позднее 3 часов с момента изготовления раствора). Насыщенным паром под давлением (120 0С) - 8 минут.
Контроль времени и температуры стерилизации. (Фиксируют в "Журнале регистрации режима стерилизации исходных лекарственных веществ, изготовленных лекарственных средств, вспомогательных материалов, посуды и прочее" - приказ № 214 от 16.07.97, прилож. Е.)
6. Оформление
Основная этикетка "Стерильно" с указанием № аптеки, № требования, ЛПУ, № анализа, способа применения, даты, цены. Предупредительные надписи "Хранить в прохладном месте", "Беречь от детей".
Срок хранения 30 суток.
4. Паспорт письменного контроля.
Дата
№
Aquae pro injectionibus 49.55 ml
Novocaini 0.5
Sol. Acidi hydrochloridi 0.1M 0.45 ml
VОбщ =50 ml
V1 = 50ml
№ 1
Приготовил Проверил
5. Контроль качества
Обязательные виды контроля.
1. Контроль на стадиях изготовления.
Фиксируют в "Журнале регистрации контроля отдельных стадий изготовления растворов для инъекций и инфузий" - приказ № 214 от 16.07.97, приложение Д.
2. Анализ документации
Фармацевтическая экспертиза проведена правильно. Номера препарата, требования и ППК соответствуют, расчеты сделаны правильно.
3. Оформление
Наклеена этикетка "Стерильно" с указанием № аптеки, № требования, состава прописи, способа применения, даты (число, месяц, год), № анализа, цены. Имеется отдельный рецептурный номер, предупредительные надписи "Хранить в прохладном месте", "Беречь от детей"
3. Упаковка с укупоркой
Укупорка герметична: металлический колпачок не прокручивается и при переворачивании флакона жидкость не подтекает.
- 4. Письменный контроль. ППК заполнен верно. 5. Органолептический контроль. Раствор прозрачный, механических включений нет. 6. Физический контроль.
Норма допустимых отклонений для данного объема =±4% = 50 ± 2 мл.
7. Химический анализ.
Дополнительные виды контроля
- 1. Микробиологический контроль растворов на стерильность и испытание растворов для инъекций и инфузий на пирогенность проводится в соответствии с требованиями ГФ XI стр. 187. 182 не реже 2 раз в квартал. 2. Опросный контроль.
Вывод: Лекарственная форма изготовлена удовлетворительно.
79. Возьми: Раствора калия хлорида 0.5% - 200 мл
Глюкозы достаточное количество,
Чтобы получился изотонический раствор
Простерилизуй!
Дай. Обозначь. Вводить в вену
Rp. Solutio Kalii chloride.5% - 200ml
Glucosi quantum satis
Ut fiat solution isotonica
Sterilisetur!
Da. Signa. Вводить в вену
Анализ рецепта
Рецепт выписан на бланк № 107-у, согласно МЗ РФ № 110 от 12.02.07 "О порядке назначения и выписывания лекарственных средств, изделий медицинского назначения и специализированных продуктов лечебного питания.
Ингредиенты прописи фармакологически, физико-химически и химически совместимы. Рецепт выписан массо-объемным способом. Лекарственная форма для инъекционного применения.
Анализ лекарственной формы
Выписана всесторонне свободная дисперсная система с жидкой дисперсионной средой. Истинный раствор для инъекционного применения. Инфузионный раствор.
Физико-химические свойства ингредиентов
Калия хлорид (Kalii chloridum)
Белый кристаллический порошок без запаха, соленого вкуса Растворимость. Растворим в 3 ч. воды, практически не растворим в 95% этаноле. Хранение. В хорошо укупоренной таре
Белый кристаллический порошок без запаха, солено-щелочного вкуса Растворимость. Растворим в воде, практически не растворим в 95% этаноле. Хранение. В хорошо укупоренной таре.
Глюкоза (Glucosum) - бесцветные кристаллы или белый мелкокристаллический порошок без запаза, сладкого вкуса. Дополнительное требование к лекарственному веществу "Глюкоза для инъекций" - апирогенность. Определенная навеска каждой партии синтезируемой глюкозы в виде 5% раствора должна выдерживать испытание на пирогенность, тест-доза 10 мл на 1 кг массы животного статья ГФ "Испытание на пирогенность". Хранят глюкозу в стерильной, хорошо укупоренной таре. В защищенном от света месте.
Проверка доз
Вещества общего списка дозы не проверяются
Расчеты по прописи (оборотная сторона ППК)
VНоминальный. =200мл
Калия хлорида 0,5-100
Х - 200 х = 1,0
Расчет изотоничности:
Натрия хлорида для изотонирования 200мл 0,9 - 100
Х - 200 х = 1,8
Изотонический эквивалент калия хлорида 0,76 1,0
Х 1,00 х = 0,76
Натрия хлорида для до изотонирования 1,8 - 0,78 = 1,02
Пересчет на глюкозу безводную 0,18 натрия хлор 1,0 глюкозы
1,02 х х = 5,7
Глюкозы водной 5,7х100/100-10 = 6,29 КУО - 0,69
Кислоты хлороводородной 0,1м - 10,2мл
Концентрация сухих компонентов (1,0+6,29)*100/200=3,65%
Воды для инъекций 200 - (6,29х0,69)-10,2 = 185 мл
Теоретическое обоснование технологии
- - Лекарственная форма предназначена для инъекционного применения - изготовление ведется в асептических условиях - Субстанции лекарственных веществ используют марки "годен для инъекций". При отсутствии данной марки можно использовать марку "х. ч.", при этом субстанции должны быть стерильны и апирогенны, Номинальный объем препарата превышает 50 мл необходимо фактическое увеличение объема на 2% (ГФ ХI) - Концентрация сухих веществ более 3% (3,68%) для предотвращения изменения объема после растворения используют КУО, количество калия хлорида по прописи менее 1,0, его изменение объема можно неучитывать - Растворы глюкозы стабилизируют реактивом Вейбеля состоящим из натрия хлорида и хлороводородной кислоты. Натрия хлорид стабилизатора Вейбеля способствует циклизации глюкозы, блокирует альдегидную группу в ациклической активной форме и препятствует окислению глюкозы. В кислой среде, поддерживаемой хлористоводородной кислотой, замедляются процессы окисления глюкозы. Количество стабилизатора берут - 5% от объема раствора. В данной прописи присутствует калия хлорид, который будет выполнять функцию натрия хлорида, поэтому для стабилизации добавляют 0,1м раствор хлороводородной кислоты - Для предотвращения окисления глюкозы кислородом, содержащимся в воде, необходимо заранее прокипятив воду для инъекций.
Технология по стадиям
1. Растворение
В стерильной подставке в 189 мл воды для инъекций растворяют калия хлорид, глюкозу, добавляют хлороводородную кислоту. Перемешивают. Контроль полноты растворения. Химический контроль.
2. Фильтрование
После полного химического контроля раствор фильтруют через промытый комбинированный фильтр (складчатый бумажный фильтр с подложенным тампоном длинноволокнистой стерильной ваты) или через стеклянный фильтр № 3 или 4 в стерильный флакон на 200мл.
Контроль на механические включения.
3. Упаковка с укупоркой
Флакон с раствором укупоривают резиновой пробкой и проверяют на отсутствие механических включений, обкатывают металлическим колпачком.
Контроль герметичности.
4. Подготовка к стерилизации
Укупоренный флакон обвязывают смоченной пергаментной бумагой, на "язычке" которой указывают: № рецепта, состав прописи, режим стерилизации, дату изготовления, подпись изготовившего.
5. Стерилизация (не позднее 3 часов с момента изготовления раствора). Насыщенным паром под давлением (120 0С) - 12 минут (объем от 100 до 500 мл).
Контроль температурного режима. Вторичный контроль на механические включения.
6. Оформление (маркировка)
Основная этикетка "Стерильно" с указанием № аптеки, № рецепта, Ф. И.О. пациента, состава прописи, № анализа, способа применения, даты, цены. Предупредительные надписи "Хранить в прохладном, месте", "Беречь от детей", отдельный рецептурный номер
Задание 31. Оценка качества изготовленной лекарственной формы Контроль на стадиях изготовления
Фиксируют в "Журнале регистрации контроля отдельных стадий изготовления растворов для инъекций и инфузий" - приказ № 214 от 16.07.97, приложение Д.
ЛВ растворены полностью. Проводят полный химический контроль (пр. № 214 от 16.07.97, пункт 8.5.1).
Контроль на отсутствие механических включений на УК-2. Флакон укупорен герметично (жидкость не подтекает, колпачок не прокручивается вокруг горлышка). Обвязка из пергамента плотно прилегает к колпачку, фиксирована нитками. Надпись на "язычке" выполнена карандашом (водостойкая) и содержит номер рецепта, состав прописи, режим стерилизации, дату, подпись изготовившего. Время и температуру стерилизации фиксируют в "Журнале регистрации режима стерилизации исходных лекарственных веществ, изготовленных лекарственных средств, вспомогательных материалов, посуды и прочее" - приказ № 214 от 16.07.97, прилож. Е.
Вторичный контроль на механические включения. Основная этикетка и предупредительные надписи соответствуют НД.
Контроль изготовленного препарата
1. Анализ документации
Фармацевтическая экспертиза рецепта проведена правильно. Номера препарата, рецепта и ППК соответствуют, расчеты сделаны правильно, ППК выписан верно.
2. Оформление
Наклеена этикетка "Стерильно" с указанием № аптеки, № рецепта, ФИО пациента, способа применения, даты (число, месяц, год), № анализа, цены. Имеется отдельный рецептурный номер, предупредительные надписи "Хранить в прохладном месте", "Беречь от детей"
3. Упаковка с укупоркой
Укупорка герметична: металлический колпачок не прокручивается и при переворачивании флакона жидкость не подтекает.
3.Письменный контроль. После изготовления раствора по памяти заполняют лицевую сторону ППК.
ППК №
Дата № рецепта
Aquae pro injectionibus 185ml
Kalii cloridi 1,0
Glucosi 6.9
Sol. Acidi chidrocloriсi 0.1M 10.2ml
VОбщ. =200мл
№ 1
Приготовил (подпись) Проверил (подпись)
Расфасовал (подпись) Отпустил (подпись)
- 4. Органолептический контроль. Раствор прозрачный, механических включений нет. 5. Физический контроль
Объем заполнения флакона соответствует ГФ XI, вып. 2, С. 141, табл. 6.
Норма допустимых отклонений для данного объема ±1%
1-100 200+2.04 =202,0
Х 200 х=2.04 200-2.04 = 198 [202 198
6. Микробиологический контроль растворов на стерильность и испытание растворов для инъекций и инфузий на пирогенность проводится в соответствии с требованиями ГФ XI стр. 187. 182 не реже 2 раз в квартал.
Вывод. Препарат изготовлен удовлетворительно согласно действующим НД.
Задание 32. Возьми: Раствора калия хлорида 0.5% - 200 мл
Глюкозы достаточное количество,
Чтобы получился изотонический раствор
Простерилизуй!
Дай. Обозначь. Вводить в вену
Rp. Solutio Kalii chloride.5% - 200ml
Glucosi quantum satis
Ut fiat solution isotonica
Sterilisetur!
Da. Signa. Вводить в вену
Анализ рецепта
Рецепт выписан на бланк № 107-у, согласно МЗ РФ № 110 от 12.02.07 "О порядке назначения и выписывания лекарственных средств, изделий медицинского назначения и специализированных продуктов лечебного питания.
Ингредиенты прописи фармакологически, физико-химически и химически совместимы. Рецепт выписан массо-объемным способом. Лекарственная форма для инъекционного применения.
Анализ лекарственной формы
Выписана всесторонне свободная дисперсная система с жидкой дисперсионной средой. Истинный раствор для инъекционного применения. Инфузионный раствор.
Физико-химические свойства ингредиентов
Калия хлорид (Kalii chloridum)
Белый кристаллический порошок без запаха, соленого вкуса Растворимость. Растворим в 3 ч. воды, практически не растворим в 95% этаноле. Хранение. В хорошо укупоренной таре
Белый кристаллический порошок без запаха, солено-щелочного вкуса Растворимость. Растворим в воде, практически не растворим в 95% этаноле. Хранение. В хорошо укупоренной таре.
Глюкоза (Glucosum) - бесцветные кристаллы или белый мелкокристаллический порошок без запаза, сладкого вкуса. Дополнительное требование к лекарственному веществу "Глюкоза для инъекций" - апирогенность. Определенная навеска каждой партии синтезируемой глюкозы в виде 5% раствора должна выдерживать испытание на пирогенность, тест-доза 10 мл на 1 кг массы животного статья ГФ "Испытание на пирогенность". Хранят глюкозу в стерильной, хорошо укупоренной таре. В защищенном от света месте.
Проверка доз
Вещества общего списка дозы не проверяются
Расчеты по прописи (оборотная сторона ППК)
VНоминальный. =200мл
Калия хлорида 0,5-100
Х - 200 х = 1,0
Расчет изотоничности:
Натрия хлорида для изотонирования 200мл 0,9 - 100
Х - 200 х = 1,8
Изотонический эквивалент калия хлорида 0,76 1,0
Х 1,00 х = 0,76
Натрия хлорида для до изотонирования 1,8 - 0,78 = 1,02
Пересчет на глюкозу безводную 0,18 натрия хлор 1,0 глюкозы
1,02 х х = 5,7
Глюкозы водной 5,7х100/100-10 = 6,29 КУО - 0,69
Кислоты хлороводородной 0,1м - 10,2мл
Концентрация сухих компонентов (1,0+6,29)*100/200=3,65%
Воды для инъекций 200 - (6,29х0,69)-10,2 = 185 мл
Теоретическое обоснование технологии
- - Лекарственная форма предназначена для инъекционного применения - изготовление ведется в асептических условиях - Субстанции лекарственных веществ используют марки "годен для инъекций". При отсутствии данной марки можно использовать марку "х. ч.", при этом субстанции должны быть стерильны и апирогенны, Номинальный объем препарата превышает 50 мл необходимо фактическое увеличение объема на 2% (ГФ ХI) - Концентрация сухих веществ более 3% (3,68%) для предотвращения изменения объема после растворения используют КУО, количество калия хлорида по прописи менее 1,0, его изменение объема можно неучитывать - Растворы глюкозы стабилизируют реактивом Вейбеля состоящим из натрия хлорида и хлороводородной кислоты. Натрия хлорид стабилизатора Вейбеля способствует циклизации глюкозы, блокирует альдегидную группу в ациклической активной форме и препятствует окислению глюкозы. В кислой среде, поддерживаемой хлористоводородной кислотой, замедляются процессы окисления глюкозы. Количество стабилизатора берут - 5% от объема раствора. В данной прописи присутствует калия хлорид, который будет выполнять функцию натрия хлорида, поэтому для стабилизации добавляют 0,1м раствор хлороводородной кислоты - Для предотвращения окисления глюкозы кислородом, содержащимся в воде, необходимо заранее прокипятив воду для инъекций.
Технология по стадиям
1. Растворение
В стерильной подставке в 189 мл воды для инъекций растворяют калия хлорид, глюкозу, добавляют хлороводородную кислоту. Перемешивают. Контроль полноты растворения. Химический контроль.
2. Фильтрование
После полного химического контроля раствор фильтруют через промытый комбинированный фильтр (складчатый бумажный фильтр с подложенным тампоном длинноволокнистой стерильной ваты) или через стеклянный фильтр № 3 или 4 в стерильный флакон на 200мл.
Контроль на механические включения.
3. Упаковка с укупоркой
Флакон с раствором укупоривают резиновой пробкой и проверяют на отсутствие механических включений, обкатывают металлическим колпачком.
Контроль герметичности.
4. Подготовка к стерилизации
Укупоренный флакон обвязывают смоченной пергаментной бумагой, на "язычке" которой указывают: № рецепта, состав прописи, режим стерилизации, дату изготовления, подпись изготовившего.
5. Стерилизация (не позднее 3 часов с момента изготовления раствора). Насыщенным паром под давлением (120 0С) - 12 минут (объем от 100 до 500 мл).
Контроль температурного режима. Вторичный контроль на механические включения.
6. Оформление (маркировка)
Основная этикетка "Стерильно" с указанием № аптеки, № рецепта, Ф. И.О. пациента, состава прописи, № анализа, способа применения, даты, цены. Предупредительные надписи "Хранить в прохладном, месте", "Беречь от детей", отдельный рецептурный номер
Оценка качества изготовленной лекарственной формы Контроль на стадиях изготовления
Фиксируют в "Журнале регистрации контроля отдельных стадий изготовления растворов для инъекций и инфузий" - приказ № 214 от 16.07.97, приложение Д.
ЛВ растворены полностью. Проводят полный химический контроль (пр. № 214 от 16.07.97, пункт 8.5.1).
Контроль на отсутствие механических включений на УК-2. Флакон укупорен герметично (жидкость не подтекает, колпачок не прокручивается вокруг горлышка). Обвязка из пергамента плотно прилегает к колпачку, фиксирована нитками. Надпись на "язычке" выполнена карандашом (водостойкая) и содержит номер рецепта, состав прописи, режим стерилизации, дату, подпись изготовившего. Время и температуру стерилизации фиксируют в "Журнале регистрации режима стерилизации исходных лекарственных веществ, изготовленных лекарственных средств, вспомогательных материалов, посуды и прочее" - приказ № 214 от 16.07.97, прилож. Е.
Вторичный контроль на механические включения. Основная этикетка и предупредительные надписи соответствуют НД.
Контроль изготовленного препарата
1. Анализ документации
Фармацевтическая экспертиза рецепта проведена правильно. Номера препарата, рецепта и ППК соответствуют, расчеты сделаны правильно, ППК выписан верно.
2. Оформление
Наклеена этикетка "Стерильно" с указанием № аптеки, № рецепта, ФИО пациента, способа применения, даты (число, месяц, год), № анализа, цены. Имеется отдельный рецептурный номер, предупредительные надписи "Хранить в прохладном месте", "Беречь от детей"
3. Упаковка с укупоркой
Укупорка герметична: металлический колпачок не прокручивается и при переворачивании флакона жидкость не подтекает.
3.Письменный контроль. После изготовления раствора по памяти заполняют лицевую сторону ППК.
ППК №
Дата № рецепта
Aquae pro injectionibus 185ml
Kalii cloridi 1,0
Glucosi 6.9
Sol. Acidi chidrocloriсi 0.1M 10.2ml
VОбщ. =200мл
№ 1
Приготовил (подпись) Проверил (подпись)
Расфасовал (подпись) Отпустил (подпись)
- 4. Органолептический контроль. Раствор прозрачный, механических включений нет. 5. Физический контроль
Объем заполнения флакона соответствует ГФ XI, вып. 2, С. 141, табл. 6.
Норма допустимых отклонений для данного объема ±1%
1-100 200+2.04 =202,0
Х 200 х=2.04 200-2.04 = 198 [202 198
6. Микробиологический контроль растворов на стерильность и испытание растворов для инъекций и инфузий на пирогенность проводится в соответствии с требованиями ГФ XI стр. 187. 182 не реже 2 раз в квартал.
Вывод. Препарат изготовлен удовлетворительно согласно действующим НД.
Задание 33. Опишите технологию глазных капель
Возьми: Раствора димедрола 0,5% - 10 мл
Дай. Обозначь. Закапывать по 2 капли в оба глаза 2 раза в день.
Recipe: Solutionis Dimedroli 0,5% - 10 ml
Da. Signa. По 2 капли в оба глаза 2 раза в день.
Анализ рецепта
Рецепт выписывают на рецептурном бланке формы N 148-1/у - согласно приказа МЗ РФ № 110 от 12.02.07 "О порядке назначения и выписывания лекарственных средств, изделий медицинского назначения и специализированных продуктов лечебного питания"
Ингредиенты прописи фармакологически, физико-химически и химически совместимы.
Рецепт выписан массо-объемным способом. Асептически изготовляемая лекарственная форма.
Пропись нормирована Пр. № 214 от 16.07.1997 "О контроле качества лекарственных средств изготовляемых в аптечных организациях", приложение 2, раздел 1.3, пропись № 73
Анализ лекарственной формы
Выписана всесторонне свободная дисперсная система с жидкой дисперсионной средой. Истинный раствор. Глазные капли.
Физико-химческие свойства лекарственных веществ.
Димедрол (Dimedrolum) белый мелкокристалический порошок без запаха или с едва уловимым запахом. Горького вкуса, вызывает чувство онемения на языке. Гигроскопичен. Растворимость: очень легко растворим воде, легко в спирте и хлороформе, не растворим в эфире и бензоле. Хранение:в хорошо укупоренной таре.
Aqua purificata (Вода очищенная) - Бесцветная, прозрачная жидкость, без запаха и вкуса, имеет значение pH = 5,0 - 7,0, не содержит хлоридов, сульфатов, нитратов, восстанавливающих веществ, кальция, углерода диоксида, тяжелых металлов, сухой остаток не более 0,001%, аммиака не более 0,00002%. В 1 мл воды очищенной не более 100 микроорганизмов при отсутствии Enterobacteriaceae, P. aeruginosa, S. aureus. Хранение. В асептических условиях не более 3 суток в закрытых емкостях.
Проверка доз
Лекарственная форма для наружного применения - дозы не проверяются
Расчеты по прописи (оборотная сторона ППК)
VОбщий. =10мл
Димедрола 0,05
Натрия хлорида для получения 10 мл изот-го раствора 0,9---100
Х --- 10 Х=0,09
0,2 натрия хлорида эквивалентно 1,0 димедрола
Х натрия хлорида 0,05димедрола х=0,01
0,01<0,09 гипотоничный раствор
Натрия хлорида для доизотонирования 0,09-0,01= 0,08
Воды очищенной стерильной 10 мл
Теоретическое обоснование технологии
- - Лекарственная форма в прописи офтальмологического назначения - изготовление ведется в асептических условиях, на стерильной воле или воде для инъекций - Одним из основных требований предъявляемых к глазным каплям - изотоничность. Согласно расчетам проводится доизотонирование раствора натрием хлоридом. - Капли выписаны в малом объеме - изготовление ведется методом двух цилиндров.
Технология изготовления
В асептических условиях в стерильную подставку отмеривают 5 мл стерильной воды очищенной и растворяют 0,05 димедрола и 0,08 натрия хлорида. Контроль полноты растворения. Химический контроль.
Раствор фильтруют в стерильный отпускной флакон нейтрального стекла через предварительно промытый стерильный бумажный фильтр (или стерильный стеклянный фильтр № 3) и через тот же фильтр профильтровывают оставшееся количество воды 5 мл (во избежание значительных потерь лекарственного вещества на фильтре). Флакон с раствором укупоривают стерильной резиновой пробкой, просматривают его на отсутствие механических включений. При наличии механических включений раствор фильтруют. Далее флакон обкатывают металлическим колпачком и проводят стерилизацию. Раствор стерилизуют паром под давлением при температуре 121°С в течение 8 минут. После стерилизации раствор вновь проверяют на отсутствие механических включений. Срок хранения 90 суток.
Контроль изготовленного препарата
1. Анализ документации
Фармацевтическая экспертиза рецепта проведена правильно. Номера препарата, рецепта и ППК соответствуют, расчеты сделаны правильно, ППК выписан, верно.
2. Оформление
Флакон оформляют этикеткой розового цвета "Глазные капли", на которой указывают номер аптеки, рецепта, дату изготовления, Ф. И.О. больного, способ применения. Наклеивают предупредительные этикетки "Хранить в прохладном и защищенном от света месте", "Беречь от детей"
3. Упаковка с укупоркой
Укупорка герметична: металлический колпачок не прокручивается и при переворачивании флакона жидкость не подтекает.
3.Письменный контроль. После изготовления раствора по памяти заполняют лицевую сторону ППК.
ППК №
Дата № рецепта
Aquae purificatae 5ml
Dimedroli 0,05
Natrii chloridi 0.08
Aquae purificatae 5ml
VОбщ. =10мл
№ 1
Приготовил (подпись) Проверил (подпись)
Расфасовал (подпись) Отпустил (подпись)
- 4. Органолептический контроль. Раствор прозрачный, механических включений нет. 5. Физический контроль
Норма допустимых отклонений для данного объема ±10%
10-100
Х - 10 х=1.0
10+1.0= 11.0 10-1= 9.0 [9.0---11.0]
Химический контроль: проводят по выборке.
Опросный контроль: проводят выборочно.
Вывод. Препарат изготовлен удовлетворительно согласно действующим НД.
Задание 34. Возьми: Раствора димедрола 0,5% -10 мл
Дай. Обозначь. Закапывать по 2 капли в оба глаза 2 раза в день.
Recipe: Solutionis Dimedroli 0,5% - 10 ml
Da. Signa. По 2 капли в оба глаза 2 раза в день.
Анализ рецепта
Рецепт выписывают на рецептурном бланке формы N 148-1/у - согласно приказа МЗ РФ № 110 от 12.02.07 "О порядке назначения и выписывания лекарственных средств, изделий медицинского назначения и специализированных продуктов лечебного питания"
Ингредиенты прописи фармакологически, физико-химически и химически совместимы.
Рецепт выписан массо-объемным способом. Асептически изготовляемая лекарственная форма.
Пропись нормирована Пр. № 214 от 16.07.1997 "О контроле качества лекарственных средств изготовляемых в аптечных организациях", приложение 2, раздел 1.3, пропись № 73
Анализ лекарственной формы
Выписана всесторонне свободная дисперсная система с жидкой дисперсионной средой. Истинный раствор. Глазные капли.
Физико-химческие свойства лекарственных веществ.
Димедрол (Dimedrolum) белый мелкокристалический порошок без запаха или с едва уловимым запахом. Горького вкуса, вызывает чувство онемения на языке. Гигроскопичен. Растворимость: очень легко растворим воде, легко в спирте и хлороформе, не растворим в эфире и бензоле. Хранение:в хорошо укупоренной таре.
Aqua purificata (Вода очищенная) - Бесцветная, прозрачная жидкость, без запаха и вкуса, имеет значение pH = 5,0 - 7,0, не содержит хлоридов, сульфатов, нитратов, восстанавливающих веществ, кальция, углерода диоксида, тяжелых металлов, сухой остаток не более 0,001%, аммиака не более 0,00002%. В 1 мл воды очищенной не более 100 микроорганизмов при отсутствии Enterobacteriaceae, P. aeruginosa, S. aureus. Хранение. В асептических условиях не более 3 суток в закрытых емкостях.
Проверка доз
Лекарственная форма для наружного применения - дозы не проверяются
Расчеты по прописи (оборотная сторона ППК)
Vобщий. =10мл
Димедрола 0,05
Натрия хлорида для получения 10 мл изот-го раствора 0,9---100
Х --- 10 Х=0,09
0,2 натрия хлорида эквивалентно 1,0 димедрола
Х натрия хлорида 0,05димедрола х=0,01
0,01<0,09 гипотоничный раствор
Натрия хлорида для доизотонирования 0,09-0,01= 0,08
Воды очищенной стерильной 10 мл
Теоретическое обоснование технологии
Лекарственная форма в прописи офтальмологического назначения - изготовление ведется в асептических условиях, на стерильной воле или воде для инъекций
Одним из основных требований предъявляемых к глазным каплям - изотоничность. Согласно расчетам проводится доизотонирование раствора натрием хлоридом.
Капли выписаны в малом объеме - изготовление ведется методом двух цилиндров.
Технология изготовления
В асептических условиях в стерильную подставку отмеривают 5 мл воды очищенной и растворяют 0,05 димедрола и 0,08 натрия хлорида.
Раствор фильтруют в стерильный отпускной флакон нейтрального стекла через предварительно промытый стерильный бумажный фильтр (или стерильный стеклянный фильтр № 3) и через тот же фильтр профильтровывают оставшееся количество воды 5 мл (во избежание значительных потерь лекарственного вещества на фильтре). Флакон с раствором укупоривают стерильной резиновой пробкой, просматривают его на отсутствие механических включений. При наличии механических включений раствор фильтруют. Далее флакон обкатывают металлическим колпачком и проводят стерилизацию. Раствор стерилизуют паром под давлением при температуре 121°С в течение 8 минут. После стерилизации раствор вновь проверяют на отсутствие механических включений. Срок хранения 90 суток.
Контроль изготовленного препарата
1. Анализ документации
Фармацевтическая экспертиза рецепта проведена правильно. Номера препарата, рецепта и ППК соответствуют, расчеты сделаны правильно, ППК выписан, верно.
2. Оформление
Флакон оформляют этикеткой розового цвета "Глазные капли", на которой указывают номер аптеки, рецепта, дату изготовления, Ф. И.О. больного, способ применения. Наклеивают предупредительные этикетки "Хранить в прохладном и защищенном от света месте", "Беречь от детей"
3. Упаковка с укупоркой
Укупорка герметична: металлический колпачок не прокручивается и при переворачивании флакона жидкость не подтекает.
3.Письменный контроль. После изготовления раствора по памяти заполняют лицевую сторону ППК.
ППК №
Дата № рецепта
Aquae purificatae 5ml
Dimedroli 0,05
Natrii chloridi 0.08
Aquae purificatae 5ml
Vобщ. =10мл
№ 1
Приготовил (подпись) Проверил (подпись)
Расфасовал (подпись) Отпустил (подпись)
- 4. Органолептический контроль. Раствор прозрачный, механических включений нет. 5. Физический контроль
Норма допустимых отклонений для данного объема ±10%
10-100
Х - 10 х=1.0
10+1.0= 11.0 10-1= 9.0 [9.0---11.0]
Химический контроль: проводят по выборке.
Опросный контроль: проводят выборочно.
Вывод. Препарат изготовлен удовлетворительно согласно действующим НД.
Задание 35. Установите соответствие
|
Вспомогательное вещество в глазых каплях |
Назначение |
|
А. изотонирующий компонент В. Консервант С. Стабилизатор (антиоксидант) Д. пролонгатор Е. стабилизатор (регулятор рН) |
ОТВЕТ:
- 1. Д 2. Д 3. А 4. С
Задание 36. Выберите и обоснуйте правильный(ые) ответ(ы)
При изготовлении глазных мазей и мазей с антибиотиками, учитывая область применения и свойства лекарственных веществ, отдают предпочтение основам:
A. липофильным
B. гидрофильным
C. дифильным (абсорбционным)
D. дифильным (эмульсионным)
При приготовлении мазей с антибиотиками особое внимание обращают на состав основы и способ введения антибиотиков.
Наиболее стабильны мази, приготовленные на безводных основах. Считается, что наиболее подходящая основа для глазных мазей смесь, состоящая из вазелина -- 9,0 г ("Для глазных мазей") и ланолина безводного -- 1,0 г.
Институт антибиотиков предлагает и другие сочетания: смесь из 4 частей ланолина безводного и 6 частей вазелина ("Для глазных мазей"); основа состава: парафина 30,0 г, масла подсолнечного 70,0 г. Предложены также полиорганосилоксановые основы (силиконы). Пенициллин на таких основах сохраняется длительное время (до трех месяцев и более).
Для приготовления мазей с антибиотиками рекомендуют применять безводную гидрофобную или же эмульсионные основы типа М/В или В/М. Например, стрептомициновая мазь с сульфаниламидами может быть приготовлена на эмульсионной основе такого состава: самоэмульгирующегося глицерина моностеарата 12,0 г, воска белого 3,0 г, глицерина 5,0 г, парафина жидкого 10,0 г, пропилгидроксибензоата 0,035 г, воды до 100 мл.
Ответ: А, С.
Особенностями изготовления раствора димедрола внутреннего применения для новорожденных являются:
A. фасовка в объеме 10 мл
B. изготовление только в концентрации 0,02%
C. термическая стерилизация
D. не стерилизуют термическим методом
В соответствии с приказом МЗ РФ № 214 от 29.10.2007, приложение 2 пропись № 138, 0,02% растворы димедрола для новорожденных детей следует использовать только в концентрации 0,02% в фасовке по 10 мл. Раствор стерилизуют при 1200С в течении 8 минут.
ОТВЕТ: А, В, С.
Похожие статьи
-
Выбор оптимальных условий проведения реакций - Химическая кинетика, равновесия, термодинамика
Если наша цель - получить максимальный выход продукта за определенное небольшое время, а реакция медленная и обратимая, то нужно одновременно учитывать...
-
Прогноз направления реакций и его экспериментальная проверка В тетради должны быть заранее выписаны необходимые константы (см. Приложение), проведены...
-
В предыдущих разделах рассмотрены отдельные аспекты кинетики, а теперь пора подвести общие итоги: от чего зависят скорости реакций и как можно ими...
-
Реагенты Продукты, Все химические реакции обратимы, Вопросы - Химическое равновесие
Все химические реакции обратимы Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом...
-
Пластичными массами называют материалы, полученные на основе полимеров, содержащие различные добавки и способные под влиянием температуры и давления,...
-
Бромистый этил представляет бесцветную прозрачную жидкость, обладающую эфирным запахом и сначала сладким, потом жгучим вкусом. Кипит при 38,4°С. В воде...
-
Составление химических уравнений, Расчеты по химическим уравнениям - Основные понятия и законы химии
Включает три этапа: 1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками "+" и "®" : HgO ®...
-
Общие понятия и определения. Термодинамический и кинетический критерий реакционной способности химической системы. Скорость химической реакции. Факторы,...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Винилхлорид -- достаточно активное химическое соединение, чьи химические свойства определяются как наличием двойной связи, так и атома хлора. Наибольший...
-
Реакция с реактивом Марки. К сухому остатку на фарфоровой чашке добавляют 1 каплю реактива Марки, наблюдают лимонно-желтое окрашивание, переходящее при...
-
Этаминал-натрий дает фиолетовую окраску с солями кобальта и изопропиламином. Выполнение реакции. К 2 мл хлороформного раствора исследуемого вещества...
-
Демонстрационные опыты - Химическая кинетика, равновесия, термодинамика
Как и в предыдущем разделе, здесь приходится заменить практикум лекционными демонстрациями. Оба опыта основаны на растворении твердого карбоната кальция...
-
(а) Зависят ли энергия активации и предэкспоненциальный множитель от природы реагентов? от их концентраций? от температуры? от присутствия посторонних...
-
Заготовьте в тетради заранее таблицу для записи исходных данных и результатов опытов. Сейчас в нее внесены некоторые предполагаемые объемы растворов, но...
-
Прототипом разработанной автором системы моделей служит "точечная" модель [1], представляющая собой пространственно осредненный вариант уравнений горения...
-
Синтез бромэтана проводили в соответствии с методикой, изложенной в источнике [2]. ХОД РАБОТЫ - Приготовление исходных реактивов и собирание прибора Рис....
-
Модель Лефевра-Николиса описывает колебательные процессы в следующей цепочке химических реакций: Предполагается, что концентрации веществ A, B, D, E...
-
Реакция с азотной кислотой (реакция нитрования) - Химические свойства насыщенных углеводородов
Концентрированная азотная кислота при нагревании окисляет насыщенные углеводороды, а на холоду - не действует на них. В 1889 г. М. И. Коновалов открыл,...
-
Необратимые и обратимые реакции. Химическое равновесие Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакцию считают...
-
Скорость химической реакции. Энергия активации химической реакции Химическая термодинамика изучает возможность, направление и пределы самопроизвольного...
-
При кипячении с разведенной хлороводородной кислотой происходит процесс гидролиза с образованием бензгидрола: Обнаружение димедрола методом ТСХ....
-
Это случай, наиболее похожий на гомогенную кинетику. Он реализуется, когда продукт гетерогенной реакции легко удаляется (растворяется, испаряется или...
-
Общие сведения Гетерогенные реакции еще труднее для изучения, чем гомогенные, и в обычных учебниках общей химии им уделяется мало внимания, хотя они...
-
Реакции ионного обмена - это реакции между ионами, образовавшимися в результате диссоциации электролитов. Правила составления ионных уравнений реакций 1....
-
Краткая теория В старом учебнике Глинки вопрос хорошо изложен на качественном уровне, но не хватает строго количественного описания влияния температуры...
-
Основные условия проведения реакции иода с тиосульфатом. - Йодометрия
Заключительным этапом многих йодометрических определе-ний является реакция титрования иода тиосульфатом натрия. Йодометрические титрования выполняют на...
-
(а) На основе уравнения ЗДМ объясните физический смысл константы скорости. (б) Зависит ли константа скорости от концентраций реагентов? от их природы? от...
-
Краткая теория Основное уравнение гомогенной кинетики - закон действующих масс, ЗДМ (хотя реально подставляются не массы, а молярные концентрации):...
-
К сожалению, многие учебники химии построены не вполне логично, в частности, одно и то же слово может использоваться в разных смыслах, поэтому...
-
На холоду даже дымящаяся серная кислота (олеум) почти не действует на предельные углеводороды, но при высокой температуре она может их окислять. При...
-
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов,...
-
Рассмотрим реакцию между веществами А и В, протекающую по схеме: А А + в В = с С + d D Количественно зависимость между скоростью реакции и концентрациями...
-
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа : При повышении температуры на каждые 10о скорость большинства реакций...
-
1.1. Освоить методику определения тепловых эффектов процессов. 1.2. Определить тепловой эффект при нейтрализации кислоты щелочью. 1.3. Вычислить тепловой...
-
Чтобы возникла поверхность раздела фаз, нужна затрата энергии - Еа зародышеобразования. А когда новая фаза уже появилась, ее дальнейший рост идет...
-
Система усовершенствованных моделей позволяет удовлетворительно воспроизводить кинетику СО-токсичности ДВС при изменении нагрузки, цикловой подачи...
-
Выполнение реакции: Реактив - хлорид железа (III) (раствор, содержащий иодид калия). Для его приготовления к 3 мл 10%-го раствора хлорида железа (III)...
-
В этой части практикума опыты качественные, без расчетов. Влияние температуры Предлагается запаянный двухколенный стеклянный сосуд, заполненный оксидом...
-
Энтальпия. Закон Гесса. Тепловой эффект химической реакции Атом валентность кристалл химический Примем, что единственным видом работы, которую совершает...
Составление химических реакций и проведение опытов в фармакологии