Стеклянный электрод - Электрохимические методы анализа
Одним из ионоселективных электродов, очень широко используемым в аналитической практике, является Стеклянный электрод.
Стеклянный электрод - это ИСЭ, чувствительный к ионам Н+.
Он состоит из следующих элементов (рис. 23):
- § стеклянной рН-чувствительной мембраны (1); § внутреннего раствора с постоянной концентрацией ионов Н+ (чаще всего - 0,1 М HCl или буферный раствор) (2); § внутреннего хлоридсеребряного электрода сравнения (3).
Мембрана изготовлена из специального сорта стекла. При погружении электрода в раствор сначала ионы щелочных металлов Ме+ (Ме+ = Na+, Li+) из стекла обмениваются на ионы Н+ из раствора:
Ме+(ст) + Н+(р) Ме+(р) + Н+(ст),
Затем на внутренней и внешней поверхностях стеклянной мембраны устанавливается равновесие:
Н+(ст) Н+(р). (3)
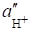
Если активности иона Н+ во внешнем и внутреннем растворах ( и ) неодинаковы, то возникает разность потенциалов:
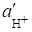
§ при 2 ? рН ? 9 уравнение Нернста для стеклянного электрода имеет вид:
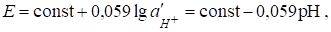
Гдеconst - постоянная величина, которая зависит от вида стекла, температуры и. В нее входят потенциалы внешнего и внутреннего электродов сравнения и Потенциал асимметрии.
Потенциал асимметрии - это разность потенциалов, которая возникает при = .
Причиной возникновения потенциала асимметрии, или "паразитного потенциала", является различие в структуре и составе внутренней и внешней поверхностей стеклянной мембраны. Этот потенциал меняется во времени, поэтому надо регулярно калибровать стеклянный электрод по буферным растворам.
§ при рН > 10 помимо основной реакции (3) начинает в заметной степени протекать побочная реакция:
Ме+(р) + Н+(ст) Ме+(ст) + Н+(р).
В этом случае уравнение Нернста для стеклянного электрода имеет вид
Похожие статьи
-
Если ИСЭ погрузить в раствор, содержащий определяемые ионы А, то на внешней и внутренней поверхности мембраны будет происходить обмен ионами А: А(м)...
-
Электроды в потенциометрии. Назначение - Электрохимические методы анализа
Электроды, которые используются в потенциометрии, различаются по Назначению и по Принципу действия . В зависимости от назначения электроды бывают...
-
Полярографический метод анализа
Полярография -- метод качественного и количественного химического анализа, основанный на получении кривых зависимости величины тока от напряжения в цепи,...
-
Потенциометрия, Способы проведения анализа в потенциометрии - Электрохимические методы анализа
Метод возник в 1893 г., когда немецкий химик Р. Беренд впервые провел потенциометрическое титрование. Потенциометрический метод анализа основан на...
-
Ионоселективные электроды - Электрохимические методы анализа
Ионоселективные электроды (ИСЭ) - это датчики, позволяющие избирательно определять активность одних ионов в присутствии других. ИСЭ состоят из следующих...
-
Электроды в потенциометрии. Принцип действия - Электрохимические методы анализа
В зависимости от принципа действия различают Электронообменные (металлические) и Мембранные (ионоселективные) электроды. Сравнительная характеристика...
-
Эквивалентная электропроводность и подвижность ионов - Электрохимические методы анализа
Эквивалентная электропроводность ( Л ) - это электропроводность раствора, содержащего 1 моль экв электролита, измеренная при расстоянии между электродами...
-
Электрохимические методы анализа - Электрохимические методы анализа
Электрохимические методы анализа (ЭХМА) основаны на использовании процессов, которые протекают на поверхности электродов или в приэлектродном...
-
Часто излом на кривых кондуктометрического титрования получается нечетким, закругленным. В этом случае для нахождения объема титранта в к. т. т....
-
Кривые кондуктометрического титрования - Электрохимические методы анализа
В ходе титрования электропроводность будет заметно меняться, если вводить или удалять ионы с высокой подвижностью. Чаще всего продуктом реакции является...
-
Кондуктометрическое титрование - Электрохимические методы анализа
Сущность метода заключается в том, что измеряют электрическую проводимость раствора в ходе титрования и строят кривую титрования. Кривая титрования...
-
Основные электрохимические характеристики ИСЭ - Электрохимические методы анализа
Основными Электрохимическими характеристиками любого ИСЭ являются: § интервал выполнения электродной функции; § крутизна электродной функции; § предел...
-
Кондуктометрия, Основные узлы приборов - Электрохимические методы анализа
Кондуктометрия является старейшим, самым простым и наименее селективным из электрохимических методов анализа. Метод возник в 1885 г., когда Кольрауш...
-
МЕТОДЫ СРАВНИТЕЛЬНОГО ШКАЛИРОВАНИЯ - Многомерный статистический анализ
Шкалирование методом попарного сравнения - Это метод сравнительного шкалирования, при котором респонденту дается два объекта для выбора по определенному...
-
Адсорбционные явления чрезвычайно широко распространены в живой и неживой природе. Толщи горных пород и почвы являются огромными колоннами с...
-
Качественные методы анализа - Разработка технологической схемы получения анизола и крезола
Рециркуляционных реакционно-ректификационных процессов. При анализе сложных ХТС, характеризующихся большим числом параметров и переменных необходимо...
-
Прямая кондуктометрия - Электрохимические методы анализа
Сущность метода Прямой кондуктометрии заключается в том, что концентрацию вещества определяют по результатам измерения электрической проводимости (или...
-
Электрохимические процессы, Электродный потенциал - Систематика химических элементов
Электродный потенциал Электрохимические процессы - Это процессы взаимного превращения химической и электрической форм энергии. Их можно разделить на две...
-
Задачи и методы качественного анализа - Основы аналитической химии
Обнаружение или, как иногда говорят, "открытие" отдельных элементов или ионов, входящих в состав веществ - это задачи качественного анализа. Качественный...
-
Легирование В настоящее время создано большое число нержавеющих сталей путем присадок к железу никеля, хрома, кобальта и др. Оказалось, что при...
-
Адсорбция активированный уголь Развитие теории адсорбционных сил еще не достигло такой стадии, когда по известным физико-химическим свойствам газа и...
-
Способы улучшения качества дизельного топлива - Сравнительный анализ методов обессеривания
Специальные присадки Понижение содержания серы в дизельном топливе, как правило, приводит к уменьшению его смазывающих свойств, поэтому для дизельных...
-
Адсорбционные методы исследования свойств поверхности позволяют количественно охарактеризовать происходящие при адсорбции межмолекулярные взаимодействия,...
-
Методы кондуктометрии - Электрохимические методы исследования
Контактные методы. Измерения проводят с помощью контактных ячеек (рис. 3, а). При этом используют электроды из Pt, Ti, нержавеющей стали и др. Для...
-
Количественный анализ - это совокупность, химических, физико-химических и физических методов определения количественного соотношения компонентов,...
-
Электрическое сопротивление - Электрохимические методы исследования
Основной константой, характеризующей электрические свойства вещества, является удельное электрическое сопротивление, зависящее от природы вещества и от...
-
По существу морская вода является хлоридно-сульфатно-натриево-магниевым раствором, в котором в виде следов и примесей находятся все остальные химические...
-
Следует отметить, что не существует особых сил, вызывающих адсорбцию. Адсорбция молекул на поверхности твердого тела происходит за счет сил притяжения со...
-
Удельная электропроводность как аналитический сигнал - Электрохимические методы анализа
Удельная электропроводность (ч) - это электропроводность 1 см3 раствора, находящегося между электродами с площадью S = 1 см2 и расстоянием между ними L =...
-
Метод наименьших квадратов - Корреляционно-регрессионный анализ
Для определения коэффициентов уравнения регрессии b применяют разные методы (графический, метод средних), однако наибольшее распространение получил метод...
-
Методика эксперимента. Простейшая электролитическая ячейка, которая может быть использована для снятия поляризационных кривых, представлена на рис. 2.5...
-
Метод дихотомии требует менее всего итераций цикла для получения корней уравнения с заданной точностью. Если расчет ведется без помощи ЭВМ, то это...
-
Показатели анализа ряда динамики - Методы анализа основной тендеции развития в рядах динамики
При изучении динамики общественных явлений возникает проблема описания интенсивности изменения и расчета средних показателей динамики. Анализ...
-
Методы анализа взаимосвязи - Статистическое изучение взаимосвязи социально-экономических явлений
Первым и обязательным этапом изучения взаимосвязи социально-экономических явлений является качественный анализ природы явления методами экономической...
-
Регрессия -- зависимость среднего значения какой-либо величины от некоторой другой величины или от нескольких величин. Задача регрессионного анализа...
-
Правила построения рядов динамики - Методы анализа основной тендеции развития в рядах динамики
При построении динамических рядов необходимо соблюдать определенные правила: основным условием для получения правильных выводов при анализе рядов...
-
Регрессионный метод оценки, апроксимационные модели - Корреляционно-регрессионный анализ
При изучении любого процесса (физического, социального) прихоится сталкиваться с необходимостью представлять его в качестве некоторой модели, т. е. в...
-
Вещество [Co] Лиганды и Комплексообразователь Координационное число 6 Для комплексов с координационным числом 6 характерно октаэдрическое расположение...
-
Задачи и методы количественного анализа - Основы аналитической химии
Количественный анализ - это совокупность химических, физико-химических и физических методов определения количественного соотношения компонентов, входящих...
-
В настоящее время производственные методы получения формальдегида большим разнообразием не отличаются. Так, в реакциях восстановления СО и СО2 Водой...
Стеклянный электрод - Электрохимические методы анализа