Сульфит - Свойства и формы содержания анионов металлов I аналитической группы
Водные растворы SO2 обладают кислотными свойствами (рКА,1 = 1,89; рКА,2 = 7,17). Молекулы H2SO3 существуют в растворах в чрезвычайно малых количествах. При растворении в воде возможны следующие равновесия:
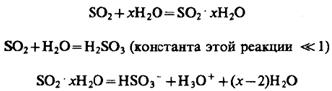
При кипячении раствора можно полностью удалить SO2. При охлаждении выделяется осадок кристаллогидрата SO2 * 7Н2О.
Большинство сульфитов нерастворимо в воде, но растворимо в НСl. В воде растворимы только сульфиты и гидросульфиты аммония и щелочных металлов.
В растворах гидросульфитов существуют два таутомера:
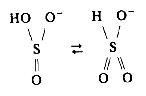
В водных растворах SO32- Постепенно окисляется до SO42-.
1. Хлорид бария с сульфит-ионом образует белый осадок BaSO3, растворимый в кислотах:
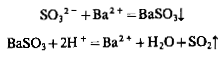
2. Минеральные кислоты разлагают как растворимые в воде, так и нерастворимые сульфиты с выделением SO2, который имеет запах горящей серы, является восстановителем, поэтому обесцвечивает растворы 12 и КМnО4:
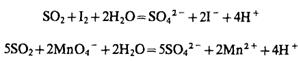
Обнаружению SO32- мсешают S2O32- и S2-: при подкислении S2O32- также выделяет SO2; S2- образует H2S, который обесцвечивает растворы 12 или КМnО4. При анализе смеси анионов SO32- обнаруживают в осадке, полученном при действии на исследуемый раствор нитрата стронция.
Похожие статьи
-
Сульфат - Свойства и формы содержания анионов металлов I аналитической группы
Анион кислота растворимость окислительный В водных растворах диссоциация H2SO4 по первой стадии протекает практически нацело; Р KА 2=1,92. Большинство...
-
Карбонат - Свойства и формы содержания анионов металлов I аналитической группы
Угольная кислота Н2СО3 существует только в водном растворе. Насыщенный при нормальных условиях (1 атм, 18 °С) водный раствор является 0,04 М относительно...
-
Фосфат - Свойства и формы содержания анионов металлов I аналитической группы
Фосфорная кислота в концентрированных растворах содержит тетраэдрические группы РО4, связанные водородными связями. В растворах с концентрацией ниже 50%...
-
Силикат - Свойства и формы содержания анионов металлов I аналитической группы
Свободная кремниевая кислота почти нерастворима в воде, но очень легко образует коллоидные растворы. При разрушении коллоидного раствора осаждается гель...
-
Арсенит и арсенат - Свойства и формы содержания анионов металлов I аналитической группы
Мышьяковистая кислота - слабая кислота: Р КА,1 = 8,10, Р КА,2 = 12,10 и Р КА,3 = 13,40. Она проявляет также слабоосновные свойства: Р К А ,4 = 14,30;...
-
Анионы образуются Р -элементами, т. е. элементами IV - VII групп 2-, 3-, 4- и реже 5- и 6-го периодов периодической системы элементов. В растворах в виде...
-
ХИМИЧЕСКИЕ СВОЙСТВА ТАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Мягкий металл синевато-белого цвета Конфигурация внешней электронной оболочки атома Tl 6s26р1; в соединениях имеет степень окисления +1 [Tl (I)] и +3 [Tl...
-
ХИМИЧЕСКИЕ СВОЙСТВА ИНДИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
В соответствии с электронной конфигурацией атома 4d105s255p1 индий в соединениях проявляет валентность 1, 2 и 3 (преимущественно). На воздухе в твердом...
-
Химические свойства Галлия. - Третья группа периодической системы
На воздухе при обычной температуре Галлий стоек. Выше 260° С в сухом кислороде наблюдается медленное окисление (пленка оксида защищает металл). В серной...
-
Химические свойства меди - Медь
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро - и теплопроводности медь уступает...
-
Использованная аппаратура и методика экспериментов В качестве растворителей при проведении фотолиза в работе использовались хлороформ (х. ч.) и...
-
ХИМИЧЕСКИЕ СВОЙСТВА ГАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
По химическим свойствам галлий сходен с алюминием. На воздухе Ga покрывается оксидной пленкой, предохраняющей от дальнейшего окисления. С мышьяком,...
-
Принципы получения гибридных соединений на основе квантовых точек и органических хромофоров В литературе для получения соединений, обладающих...
-
Технологические свойства формалина - Аналитический обзор получения формалина
Формалин - 37% водный раствор формальдегида, в нем формальдегид присутствует в виде гидрата HCHO-H2O и низкомолекулярных полимеров...
-
Способы получения и химические свойства оксидов - Основы химии
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. Окисление кислородом простых...
-
Нуклеиновые кислоты: Ш хорошо растворимы в воде Ш практически не растворимы в органических растворителях. Ш очень чувствительны к действию температуры и...
-
Химические свойства, Физиологическое воздействие - Золото
Золото -- самый инертный металл, стоящий в ряду напряжений правее всех других металлов, при нормальных условиях оно не взаимодействует с большинством...
-
Физические и химические свойства - Магний и его сплавы. Резиновые материалы. Быстрорежущая сталь
Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. На воздухе он покрывается тонкой...
-
Спектральные свойства нейтральной формы гибридного соединения QD-L На рис. 28 представлены спектры поглощения растворов исходных квантовых точек CdS...
-
Для получения модифицированной квантовой точки (гибридного соединения) были использованы квантовые точки CdS (КТ, QD) с диаметром 2,5 нм и...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Взаимодействие с галогенами При обычных условиях кремний довольно инертен, что объясняется прочностью его кристаллической решетки, непосредственно...
-
Физические свойства воды. В современной шкале измерений вода принята за эталон по очень многим показателям. Температурой таяния льда является 0 градусов...
-
С кислородом большинство металлов образует оксиды - амфотерные и основные: 4Li + O2 = 2Li2O, 4Al + 3O2 = 2Al2O3. Щелочные металлы, за исключением лития,...
-
Пероксид водорода представляет собой бесцветную вязкую жидкость с плотностью 1,46 г/см3, замерзающую при t = -0.48c и кипящую при t = 152c. В лаборатории...
-
При оценке состояния экосистемы важно учитывать загрязненность водного объекта токсичными веществами. Наибольшую опасность среди них представляют тяжелые...
-
Предельно допустимая концентрация (ПДК) _ утвержденный в законодательном порядке санитарно-гигиенический норматив. Под ПДК понимается такая концентрация...
-
Источники поступления тяжелых металлов (меди) в водоемы Основными загрязнителями окружающей среды являются тяжелые металлы. К ним относятся химические...
-
Химические свойства Бора. - Третья группа периодической системы
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С...
-
Физические свойства Таллия - Третья группа периодической системы
. Таллий мягкий металл, на воздухе легко окисляется и быстро тускнеет. Таллий при давлении 0,1 Мн/м2 (1 кгс/см2) и температуре ниже 233 °С имеет...
-
На воздухе галлий устойчив при обычной температуре, так как покрывается, подобно алюминию, прочной оксидной пленкой. Выше 260 C в сухом кислороде...
-
Физико-химические свойства хрома - Хром. Элемент периодической системы химических элементов
Хром является серебристо-белым, твердым, блестящим, но в то же время довольно хрупким металлом. Ранее считалось, что хром практически не обладает...
-
Теллур - Химия элементов VI группы
Теллур -- химический элемент 16-й группы, 5-го периода в периодической системе, имеет атомный номер 52; обозначается символом Te (лат. Tellurium) . Атом...
-
Строение и физико-химические свойства аскорбиновой кислоты - Аскорбиновая кислота
Аскорбиновая кислота (Acidumascorbinicum) - это белые кристаллы с резким кислым вкусом. Молекулярная масса = 176,13. Температура плавления аскорбиновой...
-
Алюминий - самый распространенный в земной коре металл. На его долю приходится 5,5-6,6 мол. доли % или 8 масс. %. Главная масса его сосредоточена в...
-
Определение мышьяка., Свойства мышьяка - Мышьяк, висмут и сурьма
Качественной реакцией на мышьяк является осаждение желтого сульфида As2S3 из солянокислых растворов. Следы определяют реакцией Марша или методом...
-
Что такое гравиметрический фактор F - Основы аналитической химии
Если мы знаем A - навеску анализируемой пробы, b - массу осадка и его состав, то мы можем вычислить содержание определяемого вещества X . X = a*F*100/b...
-
Гидролиз по катиону и аниону - Ионные реакции
Соли, образованные слабым основанием и слабой кислотой, гидролизуются и по катиону и по аниону: CH3COONH4 + H2O " CH3COOH + NH4OH Или в ионной форме:...
-
Окисление природного газа и низших парафинов - Аналитический обзор получения формалина
Одним из способов получения формальдегида является окисление природного газа и низших парафинов. Данный способ с точки зрения доступности и дешевизны...
-
Способы получения элемента. - Галлий
Даже такая, казалось бы, ничтожная концентрация этого элемента, как в золе каменных углей, считается вполне достаточной для его промышленного извлечения....
Сульфит - Свойства и формы содержания анионов металлов I аналитической группы