Тиосульфат - Свойства и формы содержания анионов металлов I аналитической группы
Тиосерная кислота H2S2O3 в водном растворе неустойчива и разлагается с выделением SO2 и S. По первой стадии она диссоциирует полностью, p. KA,2 = l,70. Графическое строение S2O32- можно представить так:
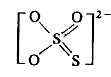
Хорошо растворимы соли щелочных металлов, Sr, Zn, Cd, Ni, Co, Mn и Fe(II). Малорастворимые тиосульфаты Ag(I), Cu(II), Hg(II), Bi(III) взаимодействуют с водой с образованием сульфидов.
1. Нитрат серебра Образует с тиосульфат-ионом белый осадок AgS2O3, который постепенно переходит в Ag2S; осадок быстро желтеет, буреет и становится черным (процесс ускоряется при нагревании):
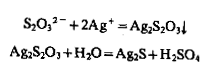
Черный осадок Ag2S при нагревании растворяется в разбавленной HNO3:
При большой концентрации S2O32- возможно образование комплексных анионов AgS2O3-, Ag(S2O3)23- и Ag(S2O3)35-. В равновесии с ними могут находиться также двухъядерные и полиядерные комплексы, например Ag2(S2O3)34-, Ag6(S2O3)810-. Поэтому необходимо брать избыток AgNO3. Обнаружению S2O32- мешает S2-, так как он сразу дает черный осадок Ag2S. При анализе смеси анионов S2O32- обнаруживают в растворе после осаждения S2- солями свинца в уксуснокислой среде или кадмия в нейтральной среде.
2. Кислоты разлагают тиосульфаты с выделением тиосерной кислоты, которая распадается на SO2 и S:
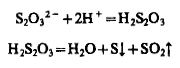
В растворе появляется белая муть серы. Этой реакцией можно обнаружить S2O32- в присутствии всех анионов. Не должны одновременно присутствовать SO32- и S2-, так как при подкислении идет реакция.
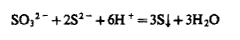
3. Раствор йода в кислой, нейтральной и слабощелочной (рН<8) средах окисляет S2O32- до тетратионат-иона:
В щелочном растворе (рН 8 - 9) 12 диспропорционирует:
Обнаружению S2O32- мешают SO32- и S2- .
Похожие статьи
-
Сульфат - Свойства и формы содержания анионов металлов I аналитической группы
Анион кислота растворимость окислительный В водных растворах диссоциация H2SO4 по первой стадии протекает практически нацело; Р KА 2=1,92. Большинство...
-
Сульфит - Свойства и формы содержания анионов металлов I аналитической группы
Водные растворы SO2 обладают кислотными свойствами (рКА,1 = 1,89; рКА,2 = 7,17). Молекулы H2SO3 существуют в растворах в чрезвычайно малых количествах....
-
Карбонат - Свойства и формы содержания анионов металлов I аналитической группы
Угольная кислота Н2СО3 существует только в водном растворе. Насыщенный при нормальных условиях (1 атм, 18 °С) водный раствор является 0,04 М относительно...
-
Арсенит и арсенат - Свойства и формы содержания анионов металлов I аналитической группы
Мышьяковистая кислота - слабая кислота: Р КА,1 = 8,10, Р КА,2 = 12,10 и Р КА,3 = 13,40. Она проявляет также слабоосновные свойства: Р К А ,4 = 14,30;...
-
Фосфат - Свойства и формы содержания анионов металлов I аналитической группы
Фосфорная кислота в концентрированных растворах содержит тетраэдрические группы РО4, связанные водородными связями. В растворах с концентрацией ниже 50%...
-
Анионы образуются Р -элементами, т. е. элементами IV - VII групп 2-, 3-, 4- и реже 5- и 6-го периодов периодической системы элементов. В растворах в виде...
-
Силикат - Свойства и формы содержания анионов металлов I аналитической группы
Свободная кремниевая кислота почти нерастворима в воде, но очень легко образует коллоидные растворы. При разрушении коллоидного раствора осаждается гель...
-
Рассмотрим химические свойства тиосульфата натрия. Изучим его окислительно-восстановительные свойства, взаимодействие с кислотами, комплексообразование....
-
ХИМИЧЕСКИЕ СВОЙСТВА ИНДИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
В соответствии с электронной конфигурацией атома 4d105s255p1 индий в соединениях проявляет валентность 1, 2 и 3 (преимущественно). На воздухе в твердом...
-
Физические свойства., Химические свойства. - Третья группа периодической системы
Алюминий в свободном виде -- серебристо-белый металл, обладающий высокой тепло - и электропроводностью. Алюминий имеет невысокую плотность -- примерно...
-
Химические свойства меди - Медь
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро - и теплопроводности медь уступает...
-
Вещество [Co] Лиганды и Комплексообразователь Координационное число 6 Для комплексов с координационным числом 6 характерно октаэдрическое расположение...
-
История открытия тиосульфата натрия, Строение молекулы и ее влияние на свойства - Тиосульфат натрия
Имя и время открытия тиосульфата натрия нам не известны. Во всяком случае в истории химии об этом не упоминается. Но в конце XVII и в начале XVIII века,...
-
ХИМИЧЕСКИЕ СВОЙСТВА БОРА. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Твердый, хрупкий, блестяще-черный полуметалл. Химически бор при обычных условиях довольно инертен взаимодействует активно лишь с фтором, причем...
-
Пероксид водорода представляет собой бесцветную вязкую жидкость с плотностью 1,46 г/см3, замерзающую при t = -0.48c и кипящую при t = 152c. В лаборатории...
-
Химические свойства Галлия. - Третья группа периодической системы
На воздухе при обычной температуре Галлий стоек. Выше 260° С в сухом кислороде наблюдается медленное окисление (пленка оксида защищает металл). В серной...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Использованная аппаратура и методика экспериментов В качестве растворителей при проведении фотолиза в работе использовались хлороформ (х. ч.) и...
-
Взаимодействие с галогенами При обычных условиях кремний довольно инертен, что объясняется прочностью его кристаллической решетки, непосредственно...
-
Принципы получения гибридных соединений на основе квантовых точек и органических хромофоров В литературе для получения соединений, обладающих...
-
Реагирует с неметаллами: 4Al + 3O2 > 2Al2O3 ; 2Al + 3Br2 > 2AlBr3 c оксидами металлов:2Al + Fe2O3 > Al2O3 + 2Fe (алюмотермия)c водой (если...
-
Химические свойства Бора. - Третья группа периодической системы
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С...
-
Физические свойства Таллия - Третья группа периодической системы
. Таллий мягкий металл, на воздухе легко окисляется и быстро тускнеет. Таллий при давлении 0,1 Мн/м2 (1 кгс/см2) и температуре ниже 233 °С имеет...
-
Физические свойства Очень чистый Na2O2 бесцветен, обычно полученный продукт чуть желтоватого цвета. Tпл = 6750 c (разлагается). Гексагональная...
-
ХИМИЧЕСКИЕ СВОЙСТВА ТАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Мягкий металл синевато-белого цвета Конфигурация внешней электронной оболочки атома Tl 6s26р1; в соединениях имеет степень окисления +1 [Tl (I)] и +3 [Tl...
-
Источники поступления тяжелых металлов (меди) в водоемы Основными загрязнителями окружающей среды являются тяжелые металлы. К ним относятся химические...
-
ХИМИЧЕСКИЕ СВОЙСТВА ГАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
По химическим свойствам галлий сходен с алюминием. На воздухе Ga покрывается оксидной пленкой, предохраняющей от дальнейшего окисления. С мышьяком,...
-
ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Легкий, мягкий, быстро окисляющийся металл серебристо-белого цвета Алюминий -- очень активный металл. В ряду напряжений он стоит после щелочных и...
-
Технологические свойства формалина - Аналитический обзор получения формалина
Формалин - 37% водный раствор формальдегида, в нем формальдегид присутствует в виде гидрата HCHO-H2O и низкомолекулярных полимеров...
-
Химические свойства - Титан и его физические свойства
Устойчив к коррозии благодаря оксидной пленке, но при измельчении в порошок горит на воздухе. Титан устойчив к разбавленным растворам многих кислот и...
-
Что такое гравиметрический фактор F - Основы аналитической химии
Если мы знаем A - навеску анализируемой пробы, b - массу осадка и его состав, то мы можем вычислить содержание определяемого вещества X . X = a*F*100/b...
-
Определение мышьяка., Свойства мышьяка - Мышьяк, висмут и сурьма
Качественной реакцией на мышьяк является осаждение желтого сульфида As2S3 из солянокислых растворов. Следы определяют реакцией Марша или методом...
-
Химические свойства Магния. - Химический элемент Магний
Химические свойства магния довольно своеобразны. Он легко отнимает кислород и хлор у большинства элементов, не боится едких щелочей, соды, керосина,...
-
Окисление природного газа и низших парафинов - Аналитический обзор получения формалина
Одним из способов получения формальдегида является окисление природного газа и низших парафинов. Данный способ с точки зрения доступности и дешевизны...
-
Температура плавления и плотность металлов и сплавов - Структура и свойства металлических расплавов
От температуры плавления металла зависит способ его плавки, материал футеровки плавильной печи или тигля и линейной формы. Температура плавления и...
-
Физические свойства воды. В современной шкале измерений вода принята за эталон по очень многим показателям. Температурой таяния льда является 0 градусов...
-
Методы расчета квантовых выходов - Свойства нейтральной формы гибридного соединения
В изучении фотоизомеризации часто случается так, что продукт реакции нельзя выделить в чистом состоянии, так как невозможно разделить реакционную смесь...
-
С кислородом большинство металлов образует оксиды - амфотерные и основные: 4Li + O2 = 2Li2O, 4Al + 3O2 = 2Al2O3. Щелочные металлы, за исключением лития,...
-
Изменение люминесценции гибридных систем, состоящих из квантовой точки и фотохромного лиганда, возможно не только за счет химического воздействия, но и...
-
Комплексообразующие свойства тиосульфатов - Тиосульфат натрия
Тиосульфат-ион - сильный комплексообразователь, использующийся в фотографии для удаления из фотопленки невосстановленного бромида серебра: Отметим, что...
Тиосульфат - Свойства и формы содержания анионов металлов I аналитической группы