Сульфат - Свойства и формы содержания анионов металлов I аналитической группы
Анион кислота растворимость окислительный
В водных растворах диссоциация H2SO4 по первой стадии протекает практически нацело; РKА 2=1,92. Большинство сульфатов и гидросульфатов хорошо растворимо в воде, причем гидросульфаты растворимы лучше сульфатов. Малорастворимые сульфаты образуют Pb(II), Ba(II), Sr(II), Ca(II), Ag(I) и Hg(I).
1. Хлорид бария с сульфат-ионом образует белый кристаллический осадок BaSO4, практически нерастворимый в кислотах:
Мешают обнаружению SO32-, S2O32- и смесь SO32- и S2-. При подкислении раствора, содержащего S2O32- и смесь SO32- и S2-, выделяется белый осадок серы, нерастворимый в кислотах, который можно принять за BaSO4;
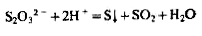
При анализе смеси анионов SO42 обнаруживают в осадке, полученном при действии на исследуемый раствор нитрата стронция.
2. Хлорид бария в присутствии КМnО4 образует с SO42- изоморфные кристаллы (BaSO4 и КМпО 4), окрашенные в розовый или розово-фиолетовый цвет. При добавлении к раствору с осадком восстановителей - Н2О2, Н2С2О4, NH2OH - раствор обеспечивается вследствие восстановления избытка МnО 4-, а осадок остается окрашенным. Если к раствору с осадком добавить 3 - 5 капель эфира, осадок флотируется на границе раздела фаз. Предел обнаружения сульфата - 50 мкг.
Реакция не специфична на SO42-, так как КМпО 4 может окислить все серосодержащие анионы (S2-, SCN-, SO32-, S2O32- и др.) до SO42-.
Похожие статьи
-
Фосфат - Свойства и формы содержания анионов металлов I аналитической группы
Фосфорная кислота в концентрированных растворах содержит тетраэдрические группы РО4, связанные водородными связями. В растворах с концентрацией ниже 50%...
-
Анионы образуются Р -элементами, т. е. элементами IV - VII групп 2-, 3-, 4- и реже 5- и 6-го периодов периодической системы элементов. В растворах в виде...
-
Силикат - Свойства и формы содержания анионов металлов I аналитической группы
Свободная кремниевая кислота почти нерастворима в воде, но очень легко образует коллоидные растворы. При разрушении коллоидного раствора осаждается гель...
-
Арсенит и арсенат - Свойства и формы содержания анионов металлов I аналитической группы
Мышьяковистая кислота - слабая кислота: Р КА,1 = 8,10, Р КА,2 = 12,10 и Р КА,3 = 13,40. Она проявляет также слабоосновные свойства: Р К А ,4 = 14,30;...
-
Карбонат - Свойства и формы содержания анионов металлов I аналитической группы
Угольная кислота Н2СО3 существует только в водном растворе. Насыщенный при нормальных условиях (1 атм, 18 °С) водный раствор является 0,04 М относительно...
-
ХИМИЧЕСКИЕ СВОЙСТВА ИНДИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
В соответствии с электронной конфигурацией атома 4d105s255p1 индий в соединениях проявляет валентность 1, 2 и 3 (преимущественно). На воздухе в твердом...
-
ХИМИЧЕСКИЕ СВОЙСТВА ТАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Мягкий металл синевато-белого цвета Конфигурация внешней электронной оболочки атома Tl 6s26р1; в соединениях имеет степень окисления +1 [Tl (I)] и +3 [Tl...
-
Химические свойства Галлия. - Третья группа периодической системы
На воздухе при обычной температуре Галлий стоек. Выше 260° С в сухом кислороде наблюдается медленное окисление (пленка оксида защищает металл). В серной...
-
Химические свойства Бора. - Третья группа периодической системы
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Взаимодействие с галогенами При обычных условиях кремний довольно инертен, что объясняется прочностью его кристаллической решетки, непосредственно...
-
Пероксид водорода представляет собой бесцветную вязкую жидкость с плотностью 1,46 г/см3, замерзающую при t = -0.48c и кипящую при t = 152c. В лаборатории...
-
Использованная аппаратура и методика экспериментов В качестве растворителей при проведении фотолиза в работе использовались хлороформ (х. ч.) и...
-
ХИМИЧЕСКИЕ СВОЙСТВА ГАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
По химическим свойствам галлий сходен с алюминием. На воздухе Ga покрывается оксидной пленкой, предохраняющей от дальнейшего окисления. С мышьяком,...
-
Физические свойства Таллия - Третья группа периодической системы
. Таллий мягкий металл, на воздухе легко окисляется и быстро тускнеет. Таллий при давлении 0,1 Мн/м2 (1 кгс/см2) и температуре ниже 233 °С имеет...
-
Химические свойства - Железо в деятельности человека
Основные степени окисления железа -- +2 и +3. При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной пленкой оксида,...
-
Способы получения и химические свойства оксидов - Основы химии
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. Окисление кислородом простых...
-
Вещество [Co] Лиганды и Комплексообразователь Координационное число 6 Для комплексов с координационным числом 6 характерно октаэдрическое расположение...
-
Химические свойства меди - Медь
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро - и теплопроводности медь уступает...
-
Нуклеиновые кислоты: Ш хорошо растворимы в воде Ш практически не растворимы в органических растворителях. Ш очень чувствительны к действию температуры и...
-
Исследование снегового покрова. Методика определения ионов Приготовление водной вытяжки Для определения ионов отбираются образцы снегового покрова. Снег...
-
Алюминаты. Алюминатные растворы - Алюминий и его свойства
Оксид алюминия - соединение амфотерное, т. е. обладающее одновременно основными и кислотными свойствами. Поэтому оксид, а также его гидроксиды...
-
Принципы получения гибридных соединений на основе квантовых точек и органических хромофоров В литературе для получения соединений, обладающих...
-
Химические свойства Алюминия. - Третья группа периодической системы
Внешняя электронная оболочка атома Алюминия состоит из 3 электронов и имеет строение 3s23р1. В обычных условиях Алюминий в соединениях 3-валентен, но при...
-
С кислородом большинство металлов образует оксиды - амфотерные и основные: 4Li + O2 = 2Li2O, 4Al + 3O2 = 2Al2O3. Щелочные металлы, за исключением лития,...
-
Применение H2O2 связано с его окислительными свойствами и безвредностью продукта его восстановления (H2O). Его использую для отбеливания тканей и мехов,...
-
Физические свойства., Химические свойства. - Третья группа периодической системы
Алюминий в свободном виде -- серебристо-белый металл, обладающий высокой тепло - и электропроводностью. Алюминий имеет невысокую плотность -- примерно...
-
ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Легкий, мягкий, быстро окисляющийся металл серебристо-белого цвета Алюминий -- очень активный металл. В ряду напряжений он стоит после щелочных и...
-
ХИМИЧЕСКИЕ СВОЙСТВА БОРА. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Твердый, хрупкий, блестяще-черный полуметалл. Химически бор при обычных условиях довольно инертен взаимодействует активно лишь с фтором, причем...
-
Спектральные свойства нейтральной формы гибридного соединения QD-L На рис. 28 представлены спектры поглощения растворов исходных квантовых точек CdS...
-
Для получения модифицированной квантовой точки (гибридного соединения) были использованы квантовые точки CdS (КТ, QD) с диаметром 2,5 нм и...
-
Методы расчета квантовых выходов - Свойства нейтральной формы гибридного соединения
В изучении фотоизомеризации часто случается так, что продукт реакции нельзя выделить в чистом состоянии, так как невозможно разделить реакционную смесь...
-
Физические свойства воды. В современной шкале измерений вода принята за эталон по очень многим показателям. Температурой таяния льда является 0 градусов...
-
Вода реагирует с некоторыми кислотными и основными оксидами, давая гидроксид - соответственно кислоту или основание: Н2О + CaO = Ca(OH)2 основание H2O +...
-
Реагирует с неметаллами: 4Al + 3O2 > 2Al2O3 ; 2Al + 3Br2 > 2AlBr3 c оксидами металлов:2Al + Fe2O3 > Al2O3 + 2Fe (алюмотермия)c водой (если...
-
Технологические свойства формалина - Аналитический обзор получения формалина
Формалин - 37% водный раствор формальдегида, в нем формальдегид присутствует в виде гидрата HCHO-H2O и низкомолекулярных полимеров...
-
Химические свойства, Физиологическое воздействие - Золото
Золото -- самый инертный металл, стоящий в ряду напряжений правее всех других металлов, при нормальных условиях оно не взаимодействует с большинством...
-
ДОПОЛНИТЕЛЬНЫЙ ОПЫТ. ПЕРИОДИЧЕСКАЯ РЕАКЦИЯ - Свойства галогенов
Приготовить в двух отдельных стаканчиках раствор 0,72 г иодата калия в 8 мл 2%-ной хлорной кислоты и раствор 0,3 г малоновой кислоты, 0,1 г сульфата...
-
Физико-химические свойства хрома - Хром. Элемент периодической системы химических элементов
Хром является серебристо-белым, твердым, блестящим, но в то же время довольно хрупким металлом. Ранее считалось, что хром практически не обладает...
-
Германиевая кислота, Водородные соединения германия - Свойства германия
H4GeO4 (H2GeO3-H2O) - метагерманиевая кислота. В свободном виде (как и мономерные кислородные кислоты углерода и кремния) не получена. При подкислении...
Сульфат - Свойства и формы содержания анионов металлов I аналитической группы