Арсенит и арсенат - Свойства и формы содержания анионов металлов I аналитической группы
Мышьяковистая кислота - слабая кислота: РКА,1 = 8,10, РКА,2 = 12,10 и РКА,3 = 13,40. Она проявляет также слабоосновные свойства: РКА,4 = 14,30; равновесие в водном растворе может быть выражено следующей схемой:
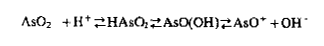
Мышьяковая кислота - более сильная кислота, чем мышьяковистая: рКА,1 = 2,19; рКА,2 = 6,94; рКА,3=11,50.
В воде растворимы арсениты и арсенаты щелочных металлов и аммония. Нерастворимые в воде соли растворяются в кислотах.
1. Нитрат серебра в нейтральной среде с арсенит-ионом образует желтый осадок Ag3As03, с арсенат-ионом - шоколадно-коричневый Ag3AsO4. Оба осадка растворимы в HNO3 HNH3:
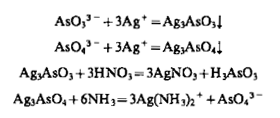
Предел обнаружения арсенита - 0,15 мкг. Предел обнаружения арсената - 2 мкг.
2. Раствор йода в нейтральной и слабощелочной среде окисляет AsO33- до AsO43-:

Для смещения равновесия вправо в раствор вводят NaHCO3, бурая окраска йода исчезает. Предел обнаружения арсенита - 5 мкг. В кислой среде KI окисляется арсенат-ионами до l2, т. е. идет обратная реакция. Можно добавить несколько капель крахмала; появится синее окрашивание, или экстрагировать l2 органическими растворителями - бензолом, СНС 13 или СС 14. Слой органического растворителя окрашивается в фиолетово-розовый цвет. Обнаружению AsO43- мешают окислители IO3-, СIO3- И NOr.
3. Восстановление арсенит - и арсенат-иоиов до AsH3 проводят металлическим Mg или Zn в 2 М НС 1 или 1 М H2SO4:
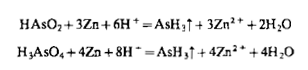
Обнаружить AsH3 можно по образованию окрашенных соединений с AgNO3. Вначале образуется осадок AsAg3, 3AgNO3 желтого цвета, который затем чернеет, переходя в Ag:
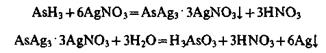
Предел обнаружения мышьяка - 20 мкг.
Вместо AgNO3 можно использовать HgBr2 или HgCl2. С HgBr2 Образуются AsH(HgBr)2 желтого цвета, As(HgBr)3 - коричневого цвета, As2Hg3 - черного цвета. С HgCl2 образуются хлормер-курарсины AsH2(HgCl), AsH(HgCl)2, As(HgCl)3 и, если мало AsH3, то As2Hg3.
Обнаружению As мешает Sb (образуется газообразный SbH3, который реагирует аналогично AsH3), сульфид-ионы (образуется H2S, который с AgNO3, HgBr2 и HgCl2 дает черные осадки сульфидов). В присутствии Sb(III) для восстановления вместо Mg или Zn применяют Sn. Тогда Sb(III) восстанавливается не до SbH3, а до Sb:
Еще можно восстанавливать мышьяк в щелочной среде металлическими Аl или Zn. В щелочной среде до AsH3 восстанавливается только AsO33-:
4. Магнезиальная смесь (раствор, содержащий MgCl2, NH4C1 и NH3) с арсенат-ионом образует белый кристаллический осадок MgNH4AsO4* 6Н 2О, растворимый в НСl, СН 3СООН, но нерастворимый в NH3:
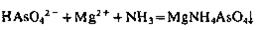
Аналогично реагируют с магнезиальной смесью фосфат-ионы. Арсенит-ионы магнезиальной смесью не осаждаются.
5. Молибденовая жидкость (раствор (NH4)2MoO4 в HNO3) образует с арсенат-ионом желтый кристаллический осадок 12-молибдоарсенат аммония (NH4)3As(Mo3O10)4-. Осадок легко растворяется в щелочах, NH3 и избытке арсената, но не растворяется в HNO3:
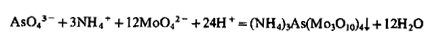
Предел обнаружения арсената - 10 мкг. Предел обнаружения понижается при введении твердого NH4NO3. Необходим избыток молибденовой жидкости и нагревание. Мешают восстановители - SO32-, S2O32- и S2-. Фосфат-ион в тех же условиях образует желтый осадок (NH4)3P(Mo3O10)4. Силикат-ион образует 12-молибдосиликат аммония (NH4)4Si(Mo3O10)4 желтого цвета, растворимый в HNO3.
Похожие статьи
-
Фосфат - Свойства и формы содержания анионов металлов I аналитической группы
Фосфорная кислота в концентрированных растворах содержит тетраэдрические группы РО4, связанные водородными связями. В растворах с концентрацией ниже 50%...
-
Анионы образуются Р -элементами, т. е. элементами IV - VII групп 2-, 3-, 4- и реже 5- и 6-го периодов периодической системы элементов. В растворах в виде...
-
Силикат - Свойства и формы содержания анионов металлов I аналитической группы
Свободная кремниевая кислота почти нерастворима в воде, но очень легко образует коллоидные растворы. При разрушении коллоидного раствора осаждается гель...
-
Карбонат - Свойства и формы содержания анионов металлов I аналитической группы
Угольная кислота Н2СО3 существует только в водном растворе. Насыщенный при нормальных условиях (1 атм, 18 °С) водный раствор является 0,04 М относительно...
-
Вещество [Co] Лиганды и Комплексообразователь Координационное число 6 Для комплексов с координационным числом 6 характерно октаэдрическое расположение...
-
ХИМИЧЕСКИЕ СВОЙСТВА ИНДИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
В соответствии с электронной конфигурацией атома 4d105s255p1 индий в соединениях проявляет валентность 1, 2 и 3 (преимущественно). На воздухе в твердом...
-
ХИМИЧЕСКИЕ СВОЙСТВА ТАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Мягкий металл синевато-белого цвета Конфигурация внешней электронной оболочки атома Tl 6s26р1; в соединениях имеет степень окисления +1 [Tl (I)] и +3 [Tl...
-
Пероксид водорода представляет собой бесцветную вязкую жидкость с плотностью 1,46 г/см3, замерзающую при t = -0.48c и кипящую при t = 152c. В лаборатории...
-
Химические свойства Галлия. - Третья группа периодической системы
На воздухе при обычной температуре Галлий стоек. Выше 260° С в сухом кислороде наблюдается медленное окисление (пленка оксида защищает металл). В серной...
-
Характеристика ионов хрома - Оценка показателей количественного содержания хрома в реке Москва
Соединения хрома являются тяжелыми металлами, в поверхностные воды попадают при выщелачивании из пород, некоторые количества поступают из почв в процессе...
-
Химические свойства меди - Медь
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро - и теплопроводности медь уступает...
-
Получение, Изотопы, Физические свойства, Химические свойства - Краткие сведения о кобальте
Кобальт получают в основном из никелевых руд, обрабатывая их растворами серной кислоты или аммиака. Также используется методы пирометаллургии. Для...
-
Взаимодействие с галогенами При обычных условиях кремний довольно инертен, что объясняется прочностью его кристаллической решетки, непосредственно...
-
Для получения модифицированной квантовой точки (гибридного соединения) были использованы квантовые точки CdS (КТ, QD) с диаметром 2,5 нм и...
-
ХИМИЧЕСКИЕ СВОЙСТВА ГАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
По химическим свойствам галлий сходен с алюминием. На воздухе Ga покрывается оксидной пленкой, предохраняющей от дальнейшего окисления. С мышьяком,...
-
Использованная аппаратура и методика экспериментов В качестве растворителей при проведении фотолиза в работе использовались хлороформ (х. ч.) и...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Химические свойства Бора. - Третья группа периодической системы
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С...
-
Физические свойства Таллия - Третья группа периодической системы
. Таллий мягкий металл, на воздухе легко окисляется и быстро тускнеет. Таллий при давлении 0,1 Мн/м2 (1 кгс/см2) и температуре ниже 233 °С имеет...
-
Оценка содержания висмута в организме проводится по результатам исследований биосубстратов - мочи, крови и биоптатов. При хронической интоксикации...
-
Физико-химические свойства - Свойства флавоноидов
Флавоноиды являются кристаллическими веществами с определенной температурой плавления, без запаха, имеющие желтый (флавоны, флавонолы, халконы и др.),...
-
Физические свойства, Общая химическая характеристика кадмия - История открытия и свойства кадмия
Кадмий _ Серебристо-белый , отливающий синевой Металл , тускнеющий на воздухе из-за образования защитной пленки оксида. Температура плавления - 321C,...
-
Определение мышьяка., Свойства мышьяка - Мышьяк, висмут и сурьма
Качественной реакцией на мышьяк является осаждение желтого сульфида As2S3 из солянокислых растворов. Следы определяют реакцией Марша или методом...
-
Что такое гравиметрический фактор F - Основы аналитической химии
Если мы знаем A - навеску анализируемой пробы, b - массу осадка и его состав, то мы можем вычислить содержание определяемого вещества X . X = a*F*100/b...
-
Методы анализа - Свойства флавоноидов
Качественное определение. Для обнаружения флавоноидов в ЛРС используют химические реакции и хроматографию. Химические реакции подразделяются на цветные и...
-
Нуклеиновые кислоты: Ш хорошо растворимы в воде Ш практически не растворимы в органических растворителях. Ш очень чувствительны к действию температуры и...
-
Применение H2O2 связано с его окислительными свойствами и безвредностью продукта его восстановления (H2O). Его использую для отбеливания тканей и мехов,...
-
Источники поступления тяжелых металлов (меди) в водоемы Основными загрязнителями окружающей среды являются тяжелые металлы. К ним относятся химические...
-
Принципы получения гибридных соединений на основе квантовых точек и органических хромофоров В литературе для получения соединений, обладающих...
-
ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Легкий, мягкий, быстро окисляющийся металл серебристо-белого цвета Алюминий -- очень активный металл. В ряду напряжений он стоит после щелочных и...
-
ХИМИЧЕСКИЕ СВОЙСТВА БОРА. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Твердый, хрупкий, блестяще-черный полуметалл. Химически бор при обычных условиях довольно инертен взаимодействует активно лишь с фтором, причем...
-
Физические свойства воды. В современной шкале измерений вода принята за эталон по очень многим показателям. Температурой таяния льда является 0 градусов...
-
Химические свойства Алюминия. - Третья группа периодической системы
Внешняя электронная оболочка атома Алюминия состоит из 3 электронов и имеет строение 3s23р1. В обычных условиях Алюминий в соединениях 3-валентен, но при...
-
Вода реагирует с некоторыми кислотными и основными оксидами, давая гидроксид - соответственно кислоту или основание: Н2О + CaO = Ca(OH)2 основание H2O +...
-
Для исследования гибридной системы в случае нахождения лиганда в протонированной форме, исходный раствор гибридного соединения разбавляли до необходимой...
-
Реагирует с неметаллами: 4Al + 3O2 > 2Al2O3 ; 2Al + 3Br2 > 2AlBr3 c оксидами металлов:2Al + Fe2O3 > Al2O3 + 2Fe (алюмотермия)c водой (если...
-
Структура мембраны МФ-4СК Твердый полимерный электролит Нафион (МФ-4СК) представляет собой фторуглеродный полимер, содержащий функциональные...
-
Методы расчета квантовых выходов - Свойства нейтральной формы гибридного соединения
В изучении фотоизомеризации часто случается так, что продукт реакции нельзя выделить в чистом состоянии, так как невозможно разделить реакционную смесь...
-
С кислородом большинство металлов образует оксиды - амфотерные и основные: 4Li + O2 = 2Li2O, 4Al + 3O2 = 2Al2O3. Щелочные металлы, за исключением лития,...
-
Физические свойства., Химические свойства. - Третья группа периодической системы
Алюминий в свободном виде -- серебристо-белый металл, обладающий высокой тепло - и электропроводностью. Алюминий имеет невысокую плотность -- примерно...
Арсенит и арсенат - Свойства и формы содержания анионов металлов I аналитической группы