Основные законы химии - Основные понятия и законы химии
Стехиометрия - это особый раздел химии, в котором изучают количественный состав веществ, а также количественные изменения, происходящие с ними при химических реакциях.
В основе стехиометрических расчетов лежат фундаментальные количественные законы химии.
Закон сохранения массы вещества (Ломоносов М. В., 1748, 1756; Лавуазье А., 1777): Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции. Объясняется это тем, что при химических превращениях атомы не разрушается, а только перегруппировываются с образованием новых веществ. Все расчеты по химическим уравнениям производят на основании этого закона. По уравнениям реакций в химическом производстве и в лабораториях рассчитывают, какое количество исходных веществ надо взять, чтобы получить заданное количество продукта, рассчитывают выход продукта и т. д.
Закон сохранения массы веществ М. В. Ломоносов связывал с законом сохранения энергии. Взгляды Ломоносова подтверждены современной наукой. Взаимосвязь массы и энергии выражается уравнением Эйнштейна (1905)
Е = m-C2,
Е - энергия, m - масса, С - скорость света в вакууме. Это уравнение может быть представлено в виде ?m = Е/С2
Что можно сформулировать так: если тело теряет (испускает) энергию, то одновременно имеет место эквивалентное уменьшение массы и наоборот. Однако это наблюдается лишь в процессах, сопровождающихся выделением или поглощением громадных количеств энергии, например, в ядерных и термоядерных реакциях. Поэтому химические реакции подчиняются закону сохранения массы, а ядерные и термоядерные реакции - закону сохранения массы и энергии.
Закон постоянства состава вещества (Ж. Л. Пруст, 1797): Вещества имеют постоянный качественный и количественный состав независимо от способа их получения. На этом законе основаны расчеты по химическим формулам. Зная химическую формулу вещества, можно рассчитать относительное содержание каждого элемента в образце вещества - так называемую массовую долю W(щ).
Дальнейшее развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. Первые соединения называются дальтонидами (в память английского химика и физика Дальтона), вторые - бертоллидами (в память французского химика Бертолле).
Дальтониды - это соединения молекулярной структуры, т. е. состоящие из молекул. Их состав выражается простыми формулами с целочисленными индексами, например: Н2О, ССl4, СО2 и др.
Бертоллиды - соединения с немолекулярной структурой (с атомной, ионной и металлической решеткой). Их состав изменяется и не отвечает стехиометрическим индексам. Например, оксид титана имеет состав от TiO0,7 до TiO1,3.
Закон постоянства состава позволил установить весовые соотношения, в которых химические элементы соединяются между собой. Дальтон ввел понятие эквивалент (в переводе означает "равноценный")
Эквивалент химического элемента (Э(х),моль) - это реальная или условная частица, соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Число, которое показывает, сколько эквивалентов содержится в одной формульной частице вещества (атоме, молекуле, ионе и т. д.) называется эквивалентным числом Z(x).
Число, обозначающее, какая доля реальной частицы является эквивалентом, называется фактором эквивалентности (fэкв)
Fэкв= 1/ Z(x), где
Для химических элементов Z(x) равно валентности (В) элемента
Z(x) = B(x)
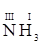
Например, в Z(N)=3; Z(H)=1.
Для сложных веществ эквивалентное число рассчитывается по формуле:
Z(х) = N(ФГ)-В(ФГ), где
N - номер функциональной группы (ФГ), В - валентность ФГ.
Функциональные группы:
У кислот - катионы водорода Н+; у оснований - гидроксид ионы ОН-;
У солей - катионы металлов Меn+; или NH; у оксидов - элемент, образующий оксид Эn+.
Например:
Z(3PO4)=3; Z(Ca(O)2)=2; Z(3(PO4)2)=6; Z(2O5)=10.
Молярная масса эквивалента (M(f(x)), г/моль) - это масса одного моля химического эквивалента.
Для элемента M(f(x))= Ar(x ) / B(x)
Для веществ M(f(x)) = fэкв - M(x)
Или Mэ(x)= 1/Z - M(x)
Например:
Z(2SO4)=2; M(H2SO4) = 98 г/моль; Мэ(H2SO4) =-98=49 г/моль.
Для вычисления объема моля газов (эквивалентный объем газа Vэ(х)) необходимо знать число молей эквивалентов в одном моле газа. Например, В(Н) = 1, тогда Z(Н) = 1 г/моль, что в 2 раза меньше молярной массы газа водорода М(Н2) = 2 г/моль = Мэ(Н2) = 2 г/моль. Следовательно, объем моля эквивалентов водорода в 2 раза меньше объема моля газа, т. е.
Vэ(Н2) = 22,4 :2 = 11,2 л.
Аналогично, для кислорода: В(О) = 2, Z(О) = 2, М(О) = 16 г/моль; Мэ(О) = Ѕ - 16 = 8 г/моль, так как молярная масса эквивалента кислорода (8 г/моль) меньше молярной массы кислорода в 4 раза (М(О2) = 32 г/моль), то объем одного моля эквивалентов кислорода в 4 раза меньше его молярного объема, т. е. Vэ(О2) = 22,4 : 4 = 5,6 л.
На основании понятия об эквиваленте формулируется один из основных законов химии - закон эквивалентов: Вещества или элементы взаимодействуют между собой в количествах, пропорциональных молярным массам их эквивалентов.
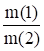
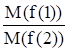
= ; где
M(1) и m(2)- массы реагирующих веществ; M(f(1) и M(f(2) - молярные массы их эквивалентов
Похожие статьи
-
Законы стехиометрии - Введение в химию
Основные законы стехиометрии, включающие законы количественных соотношений между реагирующими веществами с помощью уравнений химических реакций, вывод...
-
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Атомно-молекулярное учение этот закон объясняет следующим...
-
Закон постоянства состава - Основные понятия и законы химии
Впервые сформулировал Ж. Пруст (1808 г). Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное...
-
Внутренняя энергия термодинамическая функцция состояния системы, ее энергия, определяемая внутренним состоянием. Внутренняя энергия складывается в...
-
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ, Атомно-молекулярное учение - Основные понятия и законы химии
Химия - наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении. В настоящее время известно более 100 тыс....
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Электролиз - физико-химический процесс, состоящий в выделении на Электродах составных частей растворенных веществ или других веществ, который возникает...
-
Если два химических элемента дают несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же...
-
В данном разделе речь идет об особом уровне развития химических знаний, на котором главенствующую роль играет структура молекулы реагента. Свойства...
-
ВВЕДЕНИЕ - Основные законы электротехники и их использование
Электротехника - это наука о процессах, связанных с практическим применением электрических и магнитных явлений. Так же называют отрасль техники, которая...
-
Атомно-молекулярное учение. Основные понятия химии - Основные понятия неорганической химии
Все вещества сост. из атомов. В химию понятие атома ввел Ломоносов: ат. разные, ат. каждого вида один. М/у собой, но отлич. от атомов др. вида., ат....
-
Составление химических уравнений, Расчеты по химическим уравнениям - Основные понятия и законы химии
Включает три этапа: 1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками "+" и "®" : HgO ®...
-
Основные понятия информационного моделирования - Понятие об информационном моделировании
Остановимся на информационных моделях, отражающих процессы возникновения, передачи, преобразования и использования информации в системах различной...
-
Растворы - термодинамические устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
ЗАКОНЫ ЭЛЕКТРОЛИЗА ФАРАДЕЯ - Основные законы электротехники и их использование
При электролизе масса превращенного вещества прямо пропорциональна количеству электричества, прошедшего через электролитическую ячейку. При прохождении...
-
Основные положения стереохимии Стереохимия Стереохимия или структурная химия(от греч. уфесеьт -- твердый, пространственный), -- раздел химии о...
-
Периодическая система и закон Д. И. Менделеева и его значение - Роль химии в повседневной жизни
Имя и труды Менделеева пользуются мировой славой. Периодический закон, открытый Менделеевым, сопутствует каждому химику любой страны на всем протяжении...
-
Основная проблема химии и способы ее решения. - Роль химии в повседневной жизни
Основная проблема химии - это не только ее теоретический, но и исторический стержень,- это именно инвариантное ядро химии. При формулировании основной...
-
Понятие квантовой химии - Квантовые концепции в химии
Квантовая химия - это раздел теоретической химии, в котором строение и свойства химических соединений, их взаимодействие и превращение в химических...
-
Свойства растворов неэлектролитов. Замерзание и кипение растворов. Законы Рауля - Основы химии
По наличию или отсутствию электрической проводимости растворы веществ делят на электролиты - проводящие электрический ток, и неэлектролиты - не...
-
Периодический закон химических элементов: свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической...
-
ЗАКОН ДЖОУЛЯ-ЛЕНЦА - Основные законы электротехники и их использование
Электротехника закон цепь ток электролиз Получим Закон Джоуля-Ленца теоретическим путем. Используя закон Ома, запишем формулу для вычисления работы тока...
-
Пример 1 Далеко не во всех случаях цепь представляет собой совокупность лишь последовательно и параллельно соединенных ветвей. В качестве примера...
-
Периодический закон - Химия сегодня
Рассматривая историю химии я не могу не упамяуть об открытии периодического закона. Уже на ранних этапах развития химии было обнаружено, что различным...
-
Опис-ся правиломВант-Гоффа: С увелич-ем темп. на каждые 10 градусов. Скор. больш-ва хим. р-ций увелич-ся в 2-4 раза. Где г-темп. коэф-т скорости хим....
-
Первым практическим поводом к осознанию необходимости изучения химической эволюции явились исследования в области моделирования биокатализаторов....
-
В данной главе мы обсуждаем известные модели НС: модель Маккалоха и Питтса; модель Розенблата; модели Хопфилда и Больцмана; модель на основе обратного...
-
Уравнение Клайперона-Менделеева - Основные понятия и законы химии
Если записать объединенный газовый закон для любой массы любого газа, то получается уравнение Клайперона-Менделеева: PV= (m / M) RT Где m - масса газа; M...
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
При взаимодействии атомао м/у ними может возникнуть хим. связь, приводящая к образованию устойчивой многоатомной с-мы - молекулы, кристалла. Чем прочнее...
-
ОВР, протекающие с изменением ст. окисления эл-тов, вхлдящие в состав реакц. ве-в. они сопровожд-ся переход электронов одним за другим. Zn-2e =Zn2+...
-
Закон Авогадро ди Кваренья (1811 г.) - Основные понятия и законы химии
В равных объемах различных газов при одинаковых условиях (температура, давление и т. д.) содержится одинаковое число молекул. Закон справедлив только для...
-
Основные термины и понятия Статистика жилищного хозяйства Статистика жилищно-коммунального хозяйства - отрасль статистики, которая изучает наличие,...
-
Основные понятия сетевых и графовых моделей Объектом исследования является сеть, состоящая из узлов и линий связи. Предполагается, что в сети имеется два...
-
С кислородом большинство металлов образует оксиды - амфотерные и основные: 4Li + O2 = 2Li2O, 4Al + 3O2 = 2Al2O3. Щелочные металлы, за исключением лития,...
-
Пусть { , , ..., } - множество возможных состояний некоторой физической системы. В любой момент времени система может находиться только в одном...
-
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов,...
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Свойство 1. Вероятность достоверного события равна единице. Действительно, если событие достоверно, то каждый элементарный исход испытания...
Основные законы химии - Основные понятия и законы химии