Электролиз водных растворов солей с активными инертными анодами. Примеры, Закон Фарадея. Применение электролиза в промышленности - Основы химии
Электролиз - физико-химический процесс, состоящий в выделении на Электродах составных частей растворенных веществ или других веществ, который возникает при прохождении электрического тока через раствор либо расплав Электролита. При Электролизе водных растворов солей кроме ионов самого вещества в процессе участвуют ионы растворителя. 1. Электролиз водного раствора соли, образованной малоактивным металлом и бескислородной кислотой с нерастворимым анодом.
Рассмотрим электролиз водного раствора бромида меди (CuBr2) с угольными электродами.
Схема электролиза:
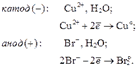
Суммарное уравнение:или
Закон Фарадея. Применение электролиза в промышленности
Первый закон ФАРАДЕЯ: масса вещества m, выделяющегося на электроде, при прохождении электрического тока прямо пропорциональна значению q электрического заряда, пропущенного через электролит:
M = kq,
Где k - электрохимический эквивалент вещества, численно равный массе вещества, выделившегося при прохождении через электролит единицы количества электричества. При пропускании через электролит постоянного тока I в течение секунды
Q = It, m = kIt.
Второй закон ФАРАДЕЯ: электрохимические эквиваленты элементов прямо пропорциональны их химическим эквивалентам. Отношение атомного веса A элемента к его валентности z называется химическим эквивалентом; количество вещества, масса которого, выраженная в граммах, равна его химическому эквиваленту, называется грамм-эквивалентом; величина, обратная C, называется числом Фарадея. Число Фарадея равно количеству электричества, которое нужно пропустить через электролит для выделения на электроде одного грамм-эквивалента любого вещества.
Электролиз - основной метод промышленного производства алюминия, хлора и едкого натра, важнейший способ получения фтора, щелочных и щелочноземельных металлов, эффективный метод рафинирования металлов. Путем электролиза воды производят водород и кислород. Электрохимический метод используется для синтеза органических соединений различных классов и многих окислителей (персульфатов, перманганатов, перхлоратов, перфторорганических соединений и др.). Применение электролиза для обработки поверхностей включает как катодные процессы гальванотехники (в машиностроении, приборостроении, авиационной, электротехнической, электронной промышленности), так и анодные процессы полировки, травления, размерной анодно-механической обработки, оксидирования (анодирования) металлических изделий (см. также Электрофизические и электрохимические методы обработки).
Похожие статьи
-
ЗАКОНЫ ЭЛЕКТРОЛИЗА ФАРАДЕЯ - Основные законы электротехники и их использование
При электролизе масса превращенного вещества прямо пропорциональна количеству электричества, прошедшего через электролитическую ячейку. При прохождении...
-
ПОНЯТИЕ ЭЛЕКТРОЛИЗА - Электролиз и его практическое применение
Электролизом называют окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через раствор или расплав...
-
Введение - Диффузионная кинетика катодного осаждения купрума из водных сульфатных растворов
С развитием современной металлообрабатывающей промышленности и непрерывным ростом ассортимента изделий из металлов постоянно расширяется область...
-
Растворы электролитов. Диссоциация кислот, солей и оснований - Основы химии
Электролиты - вещества, которые при растворении подвергаются диссоциации на ионы. В результате раствор приобретает способность проводить электрический...
-
Кинетика электродных процессов. Электродным процессом называется сумма всех изменений, происходящих во времени на поверхности электрода при потенциале,...
-
Свойства растворов неэлектролитов. Замерзание и кипение растворов. Законы Рауля - Основы химии
По наличию или отсутствию электрической проводимости растворы веществ делят на электролиты - проводящие электрический ток, и неэлектролиты - не...
-
Электролиз - р-ция превращения ве-ва под действ. эл. тока. если к р-ру или расплаву эл-та поднести эл. ток, то ионы в нем начнут направленно перемещаться...
-
Способы получения и химические свойства оксидов - Основы химии
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. Окисление кислородом простых...
-
Законы стехиометрии - Введение в химию
Основные законы стехиометрии, включающие законы количественных соотношений между реагирующими веществами с помощью уравнений химических реакций, вывод...
-
Задачи и методы качественного анализа - Основы аналитической химии
Обнаружение или, как иногда говорят, "открытие" отдельных элементов или ионов, входящих в состав веществ - это задачи качественного анализа. Качественный...
-
Гальванический элемент. ЭДС гальванического элемента - Основы химии
Рассмотрим простейший гальванический элемент Даниэля - Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы...
-
Что такое гравиметрический фактор F - Основы аналитической химии
Если мы знаем A - навеску анализируемой пробы, b - массу осадка и его состав, то мы можем вычислить содержание определяемого вещества X . X = a*F*100/b...
-
Задачи и методы количественного анализа - Основы аналитической химии
Количественный анализ - это совокупность химических, физико-химических и физических методов определения количественного соотношения компонентов, входящих...
-
Рассмотрим простейший гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы сульфатов...
-
Особые механические свойства эластичность - способность к высоким обратимым деформациям при относительно небольшой нагрузке (каучуки); малая хрупкость...
-
Зарождение современной химии, Теория флогистона и система Лавуазье - Химия сегодня
Представления древнегреческих натурфилософов оставались основными идейными истоками естествознания вплоть до XVIII в. До начала эпохи Возрождения в науке...
-
Диспергированием называют тонкое измельчение твердых мате-риалов или жидкостей и распределение их частиц в жидкой или газообразной среде, в результате...
-
Воздушная известь - одно из древнейших вяжущих, широко применяемых в строительстве и промышленности. Известь - продукт умеренного обжига кальциевых и...
-
Скорость разложения "мокрым" способом определяется концентрацией реагирующих веществ и температурой. Скорость разложения зависит от величины пробы,...
-
Обработка смесью серной и азотной кислот - метод Дениже. Данный метод часто используют в агрохимических и почвенных лабораториях. В настоящее время...
-
Минеральные кислоты, используемые для переведения анализируемой пробы в раствор, разделяют на две основные группы. 1) Кислоты, не оказывающие...
-
Растворы - термодинамические устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это...
-
Косметические средства - Применение химии в быту
В мире считается, что среди наиболее прибыльных отраслей промышленности на одном из первых мест стоит косметическая. Наблюдения показывают, что если...
-
ОСНОВЫ ЭЛЕКТРОХИМИИ - Неограническая химия
Задание 6.1. В данной (табл. VI.1) окислительно-восстановительной реакции уравняйте стехиометрические коэффициенты ионно-электронным методом и...
-
Химия в системе наук - Основы естественно-научных знаний
Химия - наука о веществах, их свойствах, строении и взаимных превращениях. Под веществом понимается любая совокупность атомов и молекул. Традиционная...
-
ЗАКЛЮЧЕНИЕ, БИБЛИОГРАФИЧЕСКИЙ СПИСОК - Электролиз и его практическое применение
Электролиз - основной метод промышленного производства алюминия, хлора и едкого натра, важнейший способ получения фтора, щелочных и щелочноземельных...
-
КРИСТАЛЛИЗАЦИЯ ВОДЫ И ВОДНЫХ РАСТВОРОВ В РАЛИЧНЫХ УСЛОВИЯХ - Химические свойства и строение воды
Для осуществления процесса кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два основных метода...
-
Составление химических уравнений, Расчеты по химическим уравнениям - Основные понятия и законы химии
Включает три этапа: 1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками "+" и "®" : HgO ®...
-
ГИДРОЛИЗ СОЛЕЙ - Характеристика основных видов растворов
Гидролизом называется обменная реакция между веществом и водой. При гидролизе обычно происходит изменение реакции среды. Если гидролиз не сопровождается...
-
Введение., Способы получения перхлоратов - Производство перхлоратов в промышленности
Получение перхлората калия или перхлоратов вообще имеет большое значение для промышленности. Ведь перхлораты широко используются как в проведении...
-
Опытным путем, задолго до появления молекулярно-кинетической теории, был открыт целый ряд законов, описывающих равновесные изопроцессы в идеальном газе....
-
- Ядерная энергетика; - Археология; - Нефтехимия; - Геохимия (изотопная геохронология); - Агрохимия; - Химическая промышленность; - Анализ...
-
Теоретические основы масс-спектрометрии Масс-спектрометрия представляет собой метод исследования веществ, основанный на определении массы (точнее,...
-
ХИМИЯ ЭЛЕМЕНТОВ VI ГРУППЫ, Кислород - Химия элементов VI группы
16-ю группу периодической таблицы химических элементов Д. И. Менделеева составляют Халькогемны (от греч. чблкпт -- медь (в широком смысле), руда (в узком...
-
Открытие периодического закона и его роль - Жизнь и деятельность Д. И. Менделеева
Конечно, начиная рассказывать об открытиях гениального ученого, нельзя не осветить главное открытие Д. И. Менделеева - Периодический закон. Ко времени...
-
Процессы окисления. - Методы очистки и получения коллоидных растворов
Наряду с серой в реакциях окисления обычно образуются политио-новые кислоты, главным образом пентатионовая кислота H2S5O6 Реакции двойного обмена....
-
Получение, Промывка - Особенности получения и применения золота
Для получения золота используются его основные физические и химические свойства: присутствие в природе в самородном состоянии, способность реагировать...
-
ВИДЫ РАСТВОРОВ. РАСТВОРИМОСТЬ. ПРОЦЕСС РАСТВОРЕНИЯ - Характеристика основных видов растворов
Растворы - гомогенные системы, состоящие из двух или более компонентов (растворителя, растворенного вещества и продуктов их взаимодействия), состав...
-
Внутренняя энергия термодинамическая функцция состояния системы, ее энергия, определяемая внутренним состоянием. Внутренняя энергия складывается в...
-
Задача количественного химического анализа состоит в определении содержания тех или иных элементов в анализируемом материале; при этом главное требование...
Электролиз водных растворов солей с активными инертными анодами. Примеры, Закон Фарадея. Применение электролиза в промышленности - Основы химии