Газовые законы - Основные понятия и законы химии
Материя химия закон эквивалент
Закон объемных отношений (Ж. Гей-Люссак, 1805) при одинаковых условиях объемы вступающих в реакцию газов, относятся друг к другу и к объемам образующихся газообразных продуктов реакций как соответствующие стехиометрические коэффициенты.
Закон Авогадро (1811). В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Из закона Авогадро вытекают следствия, которые используется при решении задач.
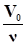
Следствие 1. Моли различных газов при одинаковых условиях (T и P) занимают одинаковый объем, а при нормальных условиях (н. у.) - 22,4 л. Этот объем (объем одного моля газа) называется молярным объемом газа и обозначается VM или Vm. Молярный объем газа - это отношение объема вещества к количеству этого вещества VM =.
Следствие 2. Плотности газов, взятых при одинаковых условиях (Т, Р) относятся как их молекулярные массы
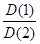
=
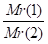
Отсюда, Dгаз2(газ1) = Mr(газ1) / Mr(газ 2)
D - относительная плотность первого газа по второму. Обычно ее определяют по отношению к легкому газу - водороду. Поскольку Ar(Н2) = 2, то Mr(газа) = Mr(Н2) - D (Н2) Отсюда Mr (газа) = 2 - D(Н2)
Таким образом, молекулярная масса вещества в газообразном состоянии равна его удвоенной плотности по водороду.
Для решения химических задач, связанных с газообразными веществами, часто используется формула объединенного газового закона Бойля-Мариотта и Гей-Люссака:
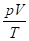
=
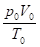
P0 , V0, T0 - давление, объем газа и температура при нормальных условиях (р0 = 101325 Па, Т0 = 273 К).
Если известна масса или количество газа, а необходимо вычислить объем, или, наоборот, используют уравнение Менделеева - Клапейрона:
PV = n-R-T, т. к. n = m/M, то
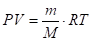
N - число молей газа; m - масса, г; M - молярная масса газа, г/моль; R - универсальная газовая постоянная:
R = 8,31 л-кПа/моль-К; R = 62400 мл-мм. рт. ст./град-моль
R = 0,082 л-атм/град-моль
Похожие статьи
-
Закон Авогадро ди Кваренья (1811 г.) - Основные понятия и законы химии
В равных объемах различных газов при одинаковых условиях (температура, давление и т. д.) содержится одинаковое число молекул. Закон справедлив только для...
-
Уравнение Клайперона-Менделеева - Основные понятия и законы химии
Если записать объединенный газовый закон для любой массы любого газа, то получается уравнение Клайперона-Менделеева: PV= (m / M) RT Где m - масса газа; M...
-
Законы стехиометрии - Введение в химию
Основные законы стехиометрии, включающие законы количественных соотношений между реагирующими веществами с помощью уравнений химических реакций, вывод...
-
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ, Атомно-молекулярное учение - Основные понятия и законы химии
Химия - наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении. В настоящее время известно более 100 тыс....
-
Основные законы химии - Основные понятия и законы химии
Стехиометрия - это особый раздел химии, в котором изучают количественный состав веществ, а также количественные изменения, происходящие с ними при...
-
Если два химических элемента дают несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же...
-
Опытным путем, задолго до появления молекулярно-кинетической теории, был открыт целый ряд законов, описывающих равновесные изопроцессы в идеальном газе....
-
Составление химических уравнений, Расчеты по химическим уравнениям - Основные понятия и законы химии
Включает три этапа: 1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками "+" и "®" : HgO ®...
-
Закон постоянства состава - Основные понятия и законы химии
Впервые сформулировал Ж. Пруст (1808 г). Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное...
-
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Атомно-молекулярное учение этот закон объясняет следующим...
-
Атомно-молекулярное учение. Основные понятия химии - Основные понятия неорганической химии
Все вещества сост. из атомов. В химию понятие атома ввел Ломоносов: ат. разные, ат. каждого вида один. М/у собой, но отлич. от атомов др. вида., ат....
-
ЗАКОНЫ ЭЛЕКТРОЛИЗА ФАРАДЕЯ - Основные законы электротехники и их использование
При электролизе масса превращенного вещества прямо пропорциональна количеству электричества, прошедшего через электролитическую ячейку. При прохождении...
-
Растворы - термодинамические устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это...
-
Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает...
-
Электролиз - физико-химический процесс, состоящий в выделении на Электродах составных частей растворенных веществ или других веществ, который возникает...
-
Внутренняя энергия термодинамическая функцция состояния системы, ее энергия, определяемая внутренним состоянием. Внутренняя энергия складывается в...
-
Св-ва хим. эл-тов, а так же формы и св-ва соединений эл-тов нах-ся в периодической зависимости от заряда ядер их атомов. Возрастание + зарядов атомных...
-
Электролиз - р-ция превращения ве-ва под действ. эл. тока. если к р-ру или расплаву эл-та поднести эл. ток, то ионы в нем начнут направленно перемещаться...
-
ОВР, протекающие с изменением ст. окисления эл-тов, вхлдящие в состав реакц. ве-в. они сопровожд-ся переход электронов одним за другим. Zn-2e =Zn2+...
-
Р-ры-галог. с-мы, сост. из 2х или более компонентов(расв-ль и растворимые ве-ва). Растворитель-тот компонент, кот. в чистом виде нах-ся в том же...
-
ЗАКОН КУЛОНА - Основные законы электротехники и их использование
Одним из ведущих первоисследователей электричества явился Шарль Огюстен де Кулон. Тщательно исследовав силы взаимодействия между телами, несущими на себе...
-
Если на равновесную с-му не оказ-ся вноешнего воздействия (не изм. темп, давл.), то равновесие м/существовать неизменным долго. Любое внешнее возд-ие...
-
К-изменение скорости хим. р-ции, под действием особых ве-в-катализаторов, кот. участвуют в ходе р-ции, но к концу ее остаются в неизменном кол-ве. Виды:...
-
Основные показатели качества природных вод - Химия воды
Температура -- физический показатель качества воды. Температура воды поверхностных водоисточников в зависимости от сезона года изменяется от 0 до 30°С....
-
Или N экв.1=n экв.2 для газообразных ве-в наряду с понятием молярного V (22,4 моль/л), исп-ся понятие - молярный объем эквивалента-это V одного моль...
-
Свойства растворов неэлектролитов. Замерзание и кипение растворов. Законы Рауля - Основы химии
По наличию или отсутствию электрической проводимости растворы веществ делят на электролиты - проводящие электрический ток, и неэлектролиты - не...
-
Модель в общем смысле (обобщенная модель) есть создаваемый с целью получения и (или) хранения информации специфический объект (в форме мысленного образа,...
-
Основные понятия и определения проблемы прогнозирования - Прогнозирующие системы
Необходимо отметить, что мы рассматриваем прогнозирование в целях планирования производства или управления запасами. Таким образом, наш интерес лежит в...
-
В условиях рыночной экономики возникают ситуации, в которых сталкиваются интересы двух и более сторон. Такие ситуации относятся к конфликтным. Например,...
-
ПОНЯТИЕ ЭЛЕКТРОЛИЗА - Электролиз и его практическое применение
Электролизом называют окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через раствор или расплав...
-
Основные понятия линейного программирования - Оптимальное программирование
Математические исследования отдельных экономических проблем, математическая формализация числового материала проводилась еще в XIX веке. При...
-
Основные понятия корреляционно-регрессионного анализа Теория и методы корреляционного анализа используются для выявления связи между случайными...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
Основная проблема химии и способы ее решения. - Роль химии в повседневной жизни
Основная проблема химии - это не только ее теоретический, но и исторический стержень,- это именно инвариантное ядро химии. При формулировании основной...
-
Описание процессов, происходящих на поверхности, изобилует специальными терминами, и при рассмотрении адсорбционных явлений приходится говорить на языке,...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Опис-ся правиломВант-Гоффа: С увелич-ем темп. на каждые 10 градусов. Скор. больш-ва хим. р-ций увелич-ся в 2-4 раза. Где г-темп. коэф-т скорости хим....
-
ЗАКОН ОМА - Основные законы электротехники и их использование
Закон Ома устанавливает зависимость между силой тока I в проводнике и разностью потенциалов (напряжением) U между двумя фиксированными точками...
-
ВВЕДЕНИЕ - Основные законы электротехники и их использование
Электротехника - это наука о процессах, связанных с практическим применением электрических и магнитных явлений. Так же называют отрасль техники, которая...
-
Соли-сильные электролиты, существующие в водных растворах в виде положительно запряженных ионов металлов и отрицательно заряженных ионов кислотных...
Газовые законы - Основные понятия и законы химии