Метод молекулярных орбиталей - Типы химических связей. Ковалентная связь
В методе молекулярных орбиталей (ММО) молекула рассматривается как единая система всех ядер и всех электронов. Последние находятся в общем пользовании всех ядер атомов, образующих молекулу. Таким образом, метод МО химическую связь рассматривает как многоцентровую и многоэлектронную. Для приближенного решения уравнения Шредингера волновая функция, соответствующая молекулярной орбитали, задается как линейная комбинация атомных орбиталей, т. е. как Сумма и Разность атомных волновых функций с коэффициентами, указывающими на долю их вклада в перекрывание электронных облаков:
Ш+ = с1 ш1 + с2 ш2,
Ш- = с3 ш1 - с4 ш2.
Полученный метод получил название линейной комбинации атомных орбиталей (ММО ЛКАО). В методе МО ЛКАО для образования устойчивой молекулярной орбитали необходимо, чтобы энергии атомных орбиталей были близки друг к другу. Кроме того, нужно, чтобы их симметрия не сильно отличалась. При выполнении этих двух требований коэффициенты c1 и c2 должны быть близкими по своим значениям, что обеспечивает максимальное перекрывание орбиталей. Образуется молекулярная орбиталь, энергия которой ниже энергий исходных атомных орбиталей - Связывающая МО. Волновая функция, соответствующая связывающей орбитали, получается в результате сложения волновых функций с одинаковым знаком. Максимум электронной плотности при этом находится между ядрами, а волновая функция принимает положительное значение.
При вычитании атомных орбиталей энергия молекулярной орбитали повышается, она называется Разрыхляющей. Электронная плотность в этом случае располагается за ядрами, а между ними равна нулю. Волновая функция в двух образовавшихся электронных облаках имеет противоположные знаки, что хорошо видно на схеме образования связывающей и разрыхляющей орбиталей (рис. 5):
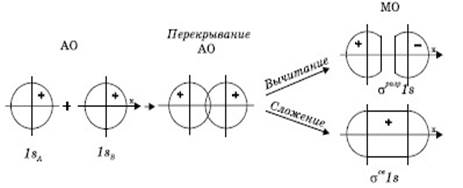
Рис. 5. Схема образования связывающей и разрыхляющей молекулярных орбиталей.
Когда атомная орбиталь одного из атомов вследствие большой разницы в энергии или в симметрии не может взаимодействовать с атомной орбиталью другого атома, она переходит в энергетическую схему молекулярных орбиталей молекулы с той же энергией, которая соответствовала ей в атоме. Такие орбитали называются Несвязывающими.
Классификация орбиталей на У или Р производится в соответствии с симметрией их электронных облаков, аналогично у - и р-связям в методе валентных связей: у-орбиталь имеет такую симметрию электронного облака, при которой поворот ее вокруг оси, соединяющей ядра, на 180О приводит к орбитали, не отличимой по форме от первоначальной. Знак волновой функции при этом не меняется. В случае же р-орбитали, при повороте ее на 180О знак волновой функции изменяется на противоположный. Поэтому s-электроны атомов при взаимодействии между собой могут образовывать только у-орбитали, а три p-орбитали атома - одну у - и две р - орбитали, причем у-орбиталь возникает при взаимодействии pХ - атомных орбиталей, а р-орбиталь - при взаимодействии pY- и pZ-атомных орбиталей. Молекулярные р-орбитали повернуты относительно межъядерной оси на 90О. Здесь наблюдается полная аналогия с методом валентных связей.
Для того чтобы отличать связывающие и разрыхляющие орбитали друг от друга, принята следующая система обозначений. Связывающая орбиталь обозначается сокращением "св", располагающимся справа вверху после греческой буквы, обозначающей орбиталь, а разрыхляющая - соответственно "разр". Часто используют еще одно обозначение: звездочкой справа вверху после греческой буквы помечаются разрыхляющие орбитали, а без звездочки - связывающие. После обозначения молекулярной орбитали пишется обозначение атомной орбитали, которой молекулярная обязана своим происхождением, например, рРазр2pУ. Это означает, что молекулярная орбиталь р-типа, разрыхляющая, образовалась при взаимодействии 2 pУ - атомных орбиталей (рис. 6):
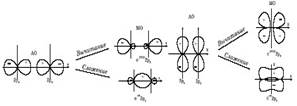
Рис. 6. Схема образования связывающих и разрыхляющих орбиталей для 2р-атомных орбиталей.
При рассмотрении электронного строения молекулы с точки зрения метода молекулярных орбиталей (МО) нужно соблюдать следующие правила:
- 1. Электроны в молекуле, также, как и в атоме, занимают соответствующие орбитали, которые характеризуются своим набором квантовых чисел; 2. Число образующихся молекулярных орбиталей равно числу исходных атомных орбиталей участвующих в их образовании; 3. Распределение электронов по молекулярным орбиталям подчиняется принципу наименьшей энергии, принципу Паули и правилу Хунда; 4. Для молекул, образованных атомами одного химического элемента (гомоядерных), выигрыш в энергии за счет образования связывающей орбитали компенсируется повышением энергии, разрыхляющей орбитали. На энергетической диаграмме обе орбитали располагаются симметрично относительно атомных орбиталей (рис. 11):
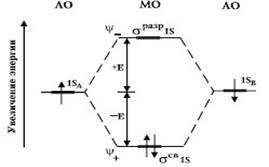
Рис. 11. Энергетическая диаграмма молекулярных орбиталей для гомоядерных молекул (на примере молекулы водорода)
5. В гетероядерных (разноэлементных) молекулах связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома (B), а разрыхляющие - ближе к орбитали менее электроотрицательного атома (A). Разность в энергиях исходных атомных орбиталей (b) равна полярности связи. Эта разность является мерой ионности связи, а разность в энергиях между связывающей орбиталью и атомной орбиталью более электроотрицательного атома определяет ковалентность связи (см. рис. 7):
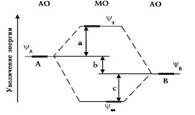
Рис. 7. Энергетическая диаграмма молекулярных орбиталей для гетероядерной молекулы.
6. Порядок связи ПС равен половине разности числа электронов, расположенных на связывающих орбиталях, и числа электронов - на разрыхляющих орбиталях.
Если ПС=0, то система неустойчива и хим. связь не возникает; необходимо, чтобы число связ. электронов было больше, чем число разрыхляющих электронов. Вследствие многоцентровости и делокализации химических связей возможны дробные значения ПС.
Похожие статьи
-
1. В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) - связывающую, энергия которой ниже, чем энергия...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Теория отталкивания электронных пар валентного уровня - Типы химических связей. Ковалентная связь
Исходя из электростатических представлений Гиллеспи предложил более общую теорию пространственного строения молекул. Основные положения: 1. Геометрия...
-
Различные типы гибридизации - Типы химических связей. Ковалентная связь
Sp-гибридизация . В этом явлении принимают участие одна s-орбиталь и одна p-орбиталь, в результате образуются две орбитали нового типа, которые...
-
Насыщенность и направленность ковалентной связи - Типы химических связей. Ковалентная связь
Число ковалентных связей, которые образует данный атом, ограничено и определяется числом валентных орбиталей: s-, p - и d - внешнего уровня, d -...
-
Метод валентных связей - Типы химических связей. Ковалентная связь
Основные положения: 1. Ковалентная связь - образуется за счет 2-х электронов с антипараллельными спинами. Эта общая электронная пара принадлежит обоим...
-
При взаимодействии атомао м/у ними может возникнуть хим. связь, приводящая к образованию устойчивой многоатомной с-мы - молекулы, кристалла. Чем прочнее...
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Химическая связь - Квантовые концепции в химии
Химия изучает процессы превращения молекул при воздействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного...
-
По характеру химической связи кристаллы делятся на 4 группы: молекулярные, ковалентные, ионные и металлические. В соответствии с этой классификацией...
-
Полярность ковалентной связи - Типы химических связей. Ковалентная связь
Если взаимодействующие атомы обладают одинаковыми электроотрицательностями (ЭО), то они в одинаковой степени влияют на общее электронное облако. Такая...
-
ХИМИЧЕСКАЯ СВЯЗЬ - Неограническая химия
Задание 2.1. Для двух, указанных по варианту (табл. II.2), молекул с позиций метода валентных связей показать образование молекул и ответить на следующие...
-
Химическая связь и валентность, Валентность - Квантовые концепции в химии
Валентность Валентность - это способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической...
-
Винилхлорид -- достаточно активное химическое соединение, чьи химические свойства определяются как наличием двойной связи, так и атома хлора. Наибольший...
-
Важной задачей статистики является разработка методики статистической оценки социально-экономических явлений, которая осложняется тем, что многие...
-
Водородная связь - Систематика химических элементов
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным...
-
Химические свойства. Образование ковалентной связи по донорно-акцепторному механизму - Аммиак
1. Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус - синий; фенолфталеин - малиновый)...
-
APCI также стала важным способом ионизации, потому что она генерирует ионы непосредственно из раствора, и способна к анализу относительно неполярных...
-
В этой работе описаны общая характеристика пероксидов щелочных металлов, их химические и физические свойства, а также их получение. Особое внимание...
-
Методы изучения связи качественных признаков - Основы эконометрики
При наличии соотношения между вариацией качественных признаков говорят об их ассоциации, взаимосвязанности. Для оценки связи в этом случае используют ряд...
-
МЕТОДЫ ОСАЖДЕНИЯ, ИОННОГО ОБМЕНА, МЕМБРАННЫЕ МЕТОДЫ - Химические свойства и строение воды
Современные технологии позволяют изготавливать объемные или плоские фильтрующие материалы с однородными каналами практически любого размера. Мембранный...
-
Кристаллическая решетка. Координационное число Кристаллы - Твердые тела, обладающие трехмерной периодической структурой, которая называется...
-
Химическая связь и строение молекул вещества. - Роль химии в повседневной жизни
Атомистические воззрения возникли первоначально на Древнем Востоке, в античных Греции и Риме. Первоначально атомное учение предполагало существование...
-
Рис. 5. Масс-спектрометрия электронной ионизацией (EI). Электронная ионизация - один из наиболее важных способов ионизации для повседневных анализов...
-
Понятие квантовой химии - Квантовые концепции в химии
Квантовая химия - это раздел теоретической химии, в котором строение и свойства химических соединений, их взаимодействие и превращение в химических...
-
Физические свойства Очень чистый Na2O2 бесцветен, обычно полученный продукт чуть желтоватого цвета. Tпл = 6750 c (разлагается). Гексагональная...
-
Ниже рассматривается наиболее важный изобарно-изотермический случай. Если реакция идет в изохорно-изотермических условиях, то вместо энергии Гиббса нужно...
-
Методы определения корреляционной связи - Корреляционно-регрессионный анализ
Корреляцию и регрессию принято рассматривать как совокупный процесс статистического исследования, поэтому их использование в статистике часто именуют...
-
Собственно-корреляционные параметрические методы изучения связи - Основы эконометрики
Измерение тесноты и направления связи является важной задачей изучения и количественного измерения взаимосвязи социально-экономических явлений. Оценка...
-
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия Молекула - Химически...
-
Вплоть до 1980-х электронная ионизация (EI) была основным способом ионизации для анализа масс. Однако EI ограничивала химиков и биохимиков малыми...
-
Теоретические основы масс-спектрометрии Масс-спектрометрия представляет собой метод исследования веществ, основанный на определении массы (точнее,...
-
Если атом находится в основном (т. е. в невозбужденном) состоянии, то его электроны занимают самые низкие по энергиям орбитали. Однако в многоэлектронном...
-
Математически строго аддитивны только массы смешиваемых тел, но иногда аддитивные объемы, а также молекулярные массы. Касаемо структуры молекул, правило...
-
Существует три основных типа окислительно-восстановительных реакций: 1. Если окислитель и восстановитель находятся в молекулах различных веществ, то...
-
Модель Лефевра-Николиса описывает колебательные процессы в следующей цепочке химических реакций: Предполагается, что концентрации веществ A, B, D, E...
-
Частным случаем недетерминированной связи является связь случайная - стохастическая (вероятностная). Реализация вероятностного подхода к описанию...
-
Рассмотрим теперь, какое влияние на свойства веществ оказывает порядок соединения атомов в молекуле. Обратимся сначала к историческим фактам. Изучая...
-
Основы новой теории сформулировал 1861 г. профессор Казанского университета Александр Бутлеров. В химии к тому времени уже значительное распространение...
Метод молекулярных орбиталей - Типы химических связей. Ковалентная связь