Насыщенность и направленность ковалентной связи - Типы химических связей. Ковалентная связь
Число ковалентных связей, которые образует данный атом, ограничено и определяется числом валентных орбиталей: s-, p - и d - внешнего уровня, d - предвнешнего уровня, f - второго снаружи уровня.
Насыщенность ковалентной связи - способность атома участвовать в образовании только определенного числа химических связей.
Направленность ковалентной связи. Т. к. все эл. облака (кроме s-) имеют определенную пространственную направленность, а перекрывание эл. облаков возможно только при определенной взаимной ориентации, то ковалентная химическая связь тоже является направленной.
В некоторых молекулах возникает несоответствие между реальной геометрией молекулы и предполагаемым направлением орбиталей в пространстве. Для разрешения этой проблемы в рамках теории МВС существует Теория гибридизации АО (Л. Полинг):
- при образовании молекулы вместо разных по симметрии исходных АО возникают смешанные ("гибридные") орбитали, одинаковые по энергии и форме; естественно, что при этом меняется и форма электронных облаков, а также их расположение в пространстве:
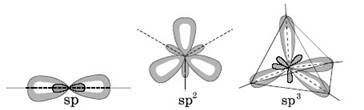
Рис.3. Пространственное расположение электронных облаков для различных типов гибридизации.
- - для образования гибридных облаков необходимы затраты энергии, но они компенсируются, т. к. энергия связи с гибридными облаками больше, чем энергия связи с "чистыми" облаками; - число гибридных АО равно числу исходных АО.
Похожие статьи
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
При взаимодействии атомао м/у ними может возникнуть хим. связь, приводящая к образованию устойчивой многоатомной с-мы - молекулы, кристалла. Чем прочнее...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Метод валентных связей - Типы химических связей. Ковалентная связь
Основные положения: 1. Ковалентная связь - образуется за счет 2-х электронов с антипараллельными спинами. Эта общая электронная пара принадлежит обоим...
-
Полярность ковалентной связи - Типы химических связей. Ковалентная связь
Если взаимодействующие атомы обладают одинаковыми электроотрицательностями (ЭО), то они в одинаковой степени влияют на общее электронное облако. Такая...
-
Химические свойства. Образование ковалентной связи по донорно-акцепторному механизму - Аммиак
1. Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус - синий; фенолфталеин - малиновый)...
-
Химическая связь - Квантовые концепции в химии
Химия изучает процессы превращения молекул при воздействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного...
-
Химическая связь и валентность, Валентность - Квантовые концепции в химии
Валентность Валентность - это способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической...
-
ХИМИЧЕСКАЯ СВЯЗЬ - Неограническая химия
Задание 2.1. Для двух, указанных по варианту (табл. II.2), молекул с позиций метода валентных связей показать образование молекул и ответить на следующие...
-
Водородная связь - Систематика химических элементов
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным...
-
Строение атома, Квантовые числа. Атомные орбитали - Систематика химических элементов
Квантовые числа. Атомные орбитали Состояние электрона в атоме любого химического элемента характеризуется четырьмя квантовыми числами: главным,...
-
Винилхлорид -- достаточно активное химическое соединение, чьи химические свойства определяются как наличием двойной связи, так и атома хлора. Наибольший...
-
Разработав теорию и подтвердив правильность ее синтезом новых соединений, А. М. Вутлеров не считал теорию абсолютной и неизменной. Он утверждено, что она...
-
Ниже рассматривается наиболее важный изобарно-изотермический случай. Если реакция идет в изохорно-изотермических условиях, то вместо энергии Гиббса нужно...
-
Химическая связь и строение молекул вещества. - Роль химии в повседневной жизни
Атомистические воззрения возникли первоначально на Древнем Востоке, в античных Греции и Риме. Первоначально атомное учение предполагало существование...
-
Кристаллическая решетка. Координационное число Кристаллы - Твердые тела, обладающие трехмерной периодической структурой, которая называется...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
Рассмотрим теперь, какое влияние на свойства веществ оказывает порядок соединения атомов в молекуле. Обратимся сначала к историческим фактам. Изучая...
-
Основы новой теории сформулировал 1861 г. профессор Казанского университета Александр Бутлеров. В химии к тому времени уже значительное распространение...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
1. В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) - связывающую, энергия которой ниже, чем энергия...
-
Методы изучения связи качественных признаков - Основы эконометрики
При наличии соотношения между вариацией качественных признаков говорят об их ассоциации, взаимосвязанности. Для оценки связи в этом случае используют ряд...
-
Химия экстремальных состояний - Концепции современного естествознания: химическая составляющая
В отличие от каталитической химии, особенностью которой является химическая активизация молекул реагента, т. е. расслабление исходных химических связей...
-
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия Молекула - Химически...
-
Фактически это следствие первого начала термодинамики, но сформулирован раньше, чем первое начало. Тепловой эффект изобарного (или изохорного) процесса...
-
В предыдущих разделах рассмотрены отдельные аспекты кинетики, а теперь пора подвести общие итоги: от чего зависят скорости реакций и как можно ими...
-
Основы химической термодинамики. Первое начало термодинамики Термодинамические системы и термодинамические параметры. Функции состояния. Парциальные...
-
Важной задачей статистики является разработка методики статистической оценки социально-экономических явлений, которая осложняется тем, что многие...
-
ТЕРМОХИМИЯ - Химическая термодинамика. Термохимия. Решение задач
Уравнения химических реакций, учитывающие тепловые эффекты, называются термохимическими уравнениями. Например: 2Н2(г.)+О2(г.) = 2Н2О(г.); ДН = - 476 кДж....
-
Закон действующих масс. Правило Вант-Гоффа - Систематика химических элементов
Скорость химической реакции зависит, прежде всего, от природы реагирующих веществ, а также от условий протекания реакции: концентрации, температуры,...
-
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - Неограническая химия
Задание 3.1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте...
-
По характеру химической связи кристаллы делятся на 4 группы: молекулярные, ковалентные, ионные и металлические. В соответствии с этой классификацией...
-
Органические кислоты в различных условиях могут разлагаться с образованием предельного углеводорода по общей схеме O R-C RH + CO2 Кислота OH Углеводород...
-
ПРОХОЖДЕНИЕ ЧЕРЕЗ ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР - Процесс катализа
Закон Аррениуса - экспериментально установленный факт. Он утверждает, что скорость реакции возрастает с увеличением температуры для преобладающего...
-
Предмет органической химии. Изучая неорганическую химию, мы знакомились с веществами самого разнообразного состава и при этом ни разу не встречали, чтобы...
-
Физические свойства., Химические свойства. - Третья группа периодической системы
Алюминий в свободном виде -- серебристо-белый металл, обладающий высокой тепло - и электропроводностью. Алюминий имеет невысокую плотность -- примерно...
-
ПРИМЕНЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ - Химические свойства нуклеиновых кислот
Последнее десятилетие характеризуется интенсивным развитием технологий, которые ориентированы на создание устройств, позволяющих получать информацию о...
-
Химические свойства Бора. - Третья группа периодической системы
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С...
-
Заключение - Физические и химические свойства кремния
Таким образом, кремний - это мелкий бурый порошок или серые, твердые, но довольно хрупкие кристаллы (пл. 2,4). В кристаллическом состоянии кремний хорошо...
Насыщенность и направленность ковалентной связи - Типы химических связей. Ковалентная связь