Теория отталкивания электронных пар валентного уровня - Типы химических связей. Ковалентная связь
Исходя из электростатических представлений Гиллеспи предложил более общую теорию пространственного строения молекул. Основные положения:
- 1. Геометрия молекулы или иона определяется только числом электронных пар на валентном уровне центрального атома. 2. Электронные пары занимают такое расположение на валентной оболочке атома, когда они максимально удалены друг от друга, т. е. электронные пары ведут себя так, как если бы они взаимно отталкивались. 3. Область пространства, которую занимает несвязывающая (неподеленная) пара электронов имеет Большие размеры, чем та область, которая занята связывающей электронной парой. 4. Размер области пространства, занятой связывающей парой электронов, уменьшается с увеличением электроотрицательности лиганда и с уменьшением электроотрицательности центрального атома. 5. Две электронные пары двойной связи занимают большую область пространства, чем одна электронная пара простой связи.
Обозначения, которые используются для описания геометрической конфигурации молекул: А - многовалентный атом; X - атомы, связанные с атомом А;
N - число атомов X; E - неподеленная пара электронов; m - количество неподеленных электронных пар.
Тогда формула молекулы по Гиллеспи записывается так: AXNEM.
Геометрия молекулы зависит от суммы (n + m). Число n, которое определяет количество атомов X, непосредственно присоединенных к атому A, совпадает с его координационным числом. Каждая электронная пара принимается за точечный заряд. Центральный атом А помещается в центр сферы некоторого радиуса, который для однотипных присоединенных атомов X равен длине связи A-X. На поверхности сферы располагаются точечные электронные пары.
Применяя правило максимального удаления электронных пар на сфере друг от друга, можно вывести геометрию простейших молекул и ионов, постепенно увеличивая сумму поделенных и неподеленных пар (рис.4 и табл.1). валентный гибридизация полярность ковалентный
Молекулу AX рассматривать не имеет смысла, так как она всегда будет линейной, независимо от количества неподеленных электронных пар у атома А.
Молекула AX2 также всегда линейна, так как максимальное отталкивание двух электронных пар будет располагать их на концах диаметра условной сферы.
Три связывающие электронные пары, максимально удаленные друг от друга, образуют правильный треугольник (молекула AX3). В этом случае угол X-A-X равен 120О. Такое строение имеют молекулы BF3, AlF3. Если одну из связывающих электронных пар заменить неподеленной парой электронов, тогда молекула будет описываться формулой AX2E и иметь угловое строение, причем, согласно третьему правилу Гиллеспи, угол X-A-X станет меньше 120О. Примером такой геометрии может служить молекула SnF2.
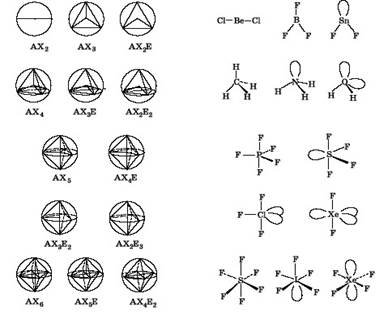
Рис. 4. Зависимость геометрии молекул от расположения атомов и электронных пар на поверхности сферы.
Четыре связывающие пары электронов будут образовывать в пространстве тетраэдр. По теории Гиллеспи это тип молекулы AX4. Угол X-A-X составит 109О28?. Типичными представителями этого типа молекул являются молекулы CH4, CCl4, SnF4. Последовательно уменьшая число связывающих пар электронов и увеличивая число неподеленных электронных пар, для молекул типа AX3E получим тригонально-пирамидальное строение (молекула аммиака NH3), а для молекул типа AX2E2 - угловое (молекула воды H2O).
Координационное число "пять" реализуется в молекулах типа AX5. Примерами подобных молекул являются пентафторид или пентахлорид фосфора (PF5, PCl5). Пять атомов галогенов в пространстве занимают вершины тригональной бипирамиды. Три атома располагаются в экваториальной плоскости, образуя равнобедренный треугольник, а два - соответственно над и под этой плоскостью. Расстояние A-X от центра молекулы до одной из вершин пирамиды, называемое аксиальным, больше аналогичного экваториального.
Валентный угол между связями, лежащими в экваториальной плоскости, равен 120О, а валентный угол между связями, лежащими в аксиальной плоскости - 180О. У молекул, являющихся производными от тригональной бипирамиды, для неподеленных электронных пар возникают две альтернативные возможности расположения. При аксиальном расположении она испытывает отталкивание от трех близлежащих атомов, а в экваториальной - от двух. Поэтому первые неподеленные пары электронов всегда занимают экваториальное положение как энергетически наиболее выгодное. Примером может служить молекула тетрафторида серы SF4, которая имеет форму качелей или дисфеноида. В молекулах типа AX3E2, таких, как ClF3 или ICl3, вторая неподеленная электронная пара располагается также в экваториальной плоскости. Поэтому все четыре атома находятся в одной плоскости, напоминая по форме букву Т. За счет того, что неподеленная пара электронов занимает в пространстве область Большего размера, происходит искажение соответствующих валентных углов в сторону их уменьшения. Третья неподеленная пара электронов, также занимая положение в экваториальной плоскости, превращает Т-образную молекулу в линейную. Представителем молекул типа AX2E3 является молекула дифторида ксенона XeF2.
Наиболее выгодное размещение шести атомов X вокруг центрального атома A - октаэдрическое. Молекулы типа AX6, например, SF6, имеют форму октаэдра. Первая неподеленная пара электронов будет занимать любую из вершин октаэдра, превращая его в квадратную пирамиду. Примером молекулы типа AX5E может служить IF5. Для второй неподеленной электронной пары имеются две возможности расположения: по соседству с первой (цис-положение) и напротив нее (транс-положение). Максимальное отталкивание электронных пар заставляет занять транс-положение. Вследствие этого молекулы типа AX4E2 имеют форму квадрата, например, XeF4.
Таблица 1.
|
Число электронных пар |
Координация |
N |
M |
Тип Молекулы |
Форма молекулы |
Примеры |
|
2 |
Линейная |
2 |
0 |
АХ2 |
Линейная |
BeH2, BeCl2 |
|
4 |
Тетраэдр |
|
|
АХ4 АХ3Е АХ2Е2 |
Тетраэдр Тригональная бипирамида Гловая |
СН4, SiCl4 NH3, PH3 Н2О, SCl2 |
|
5 |
Тригональная бипирамида |
5
|
3 |
АХ5 АХ4Е АХ3Е2 АХ2Е2 |
Тригональная бипирамида Дисфеноид Т-образная Линейная |
PCl5,AsF5 SF4 ClF3 XeF2 |
|
6 |
Октаэдр |
|
|
АХ6 АХ5Е АХ4Е2 |
Октаэдр Квадратная бипирамида Плоский квадрат |
SF6 BrF5 XrF4 |
Похожие статьи
-
Различные типы гибридизации - Типы химических связей. Ковалентная связь
Sp-гибридизация . В этом явлении принимают участие одна s-орбиталь и одна p-орбиталь, в результате образуются две орбитали нового типа, которые...
-
Основы новой теории сформулировал 1861 г. профессор Казанского университета Александр Бутлеров. В химии к тому времени уже значительное распространение...
-
Насыщенность и направленность ковалентной связи - Типы химических связей. Ковалентная связь
Число ковалентных связей, которые образует данный атом, ограничено и определяется числом валентных орбиталей: s-, p - и d - внешнего уровня, d -...
-
Химическая связь - Квантовые концепции в химии
Химия изучает процессы превращения молекул при воздействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного...
-
Метод валентных связей - Типы химических связей. Ковалентная связь
Основные положения: 1. Ковалентная связь - образуется за счет 2-х электронов с антипараллельными спинами. Эта общая электронная пара принадлежит обоим...
-
При взаимодействии атомао м/у ними может возникнуть хим. связь, приводящая к образованию устойчивой многоатомной с-мы - молекулы, кристалла. Чем прочнее...
-
Разработав теорию и подтвердив правильность ее синтезом новых соединений, А. М. Вутлеров не считал теорию абсолютной и неизменной. Он утверждено, что она...
-
Рассмотрим теперь, какое влияние на свойства веществ оказывает порядок соединения атомов в молекуле. Обратимся сначала к историческим фактам. Изучая...
-
Полярность ковалентной связи - Типы химических связей. Ковалентная связь
Если взаимодействующие атомы обладают одинаковыми электроотрицательностями (ЭО), то они в одинаковой степени влияют на общее электронное облако. Такая...
-
ХИМИЧЕСКАЯ СВЯЗЬ - Неограническая химия
Задание 2.1. Для двух, указанных по варианту (табл. II.2), молекул с позиций метода валентных связей показать образование молекул и ответить на следующие...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
Энергия и длина связи. Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность. Донорно-акцепторный механизм образования...
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Предмет органической химии. Изучая неорганическую химию, мы знакомились с веществами самого разнообразного состава и при этом ни разу не встречали, чтобы...
-
Химическая связь и валентность, Валентность - Квантовые концепции в химии
Валентность Валентность - это способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической...
-
1. В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) - связывающую, энергия которой ниже, чем энергия...
-
Кристаллическая решетка. Координационное число Кристаллы - Твердые тела, обладающие трехмерной периодической структурой, которая называется...
-
Водородная связь - Систематика химических элементов
Промежуточный характер между межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Она возникает между положительно поляризованным...
-
По характеру химической связи кристаллы делятся на 4 группы: молекулярные, ковалентные, ионные и металлические. В соответствии с этой классификацией...
-
Химическая связь и строение молекул вещества. - Роль химии в повседневной жизни
Атомистические воззрения возникли первоначально на Древнем Востоке, в античных Греции и Риме. Первоначально атомное учение предполагало существование...
-
В данном разделе речь идет об особом уровне развития химических знаний, на котором главенствующую роль играет структура молекулы реагента. Свойства...
-
Винилхлорид -- достаточно активное химическое соединение, чьи химические свойства определяются как наличием двойной связи, так и атома хлора. Наибольший...
-
Химические свойства. Образование ковалентной связи по донорно-акцепторному механизму - Аммиак
1. Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус - синий; фенолфталеин - малиновый)...
-
Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью...
-
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия Молекула - Химически...
-
Теория Периодической Системы была преимущественно создана Н. Бором (1913-21) на базе предложенной им квантовой модели атома. Учитывая специфику изменения...
-
Арены, Толуол - формула, строение - Арены. Толуол
Арены или ароматические углеводороды - это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с особым...
-
Нормальное и возбужденное состояние атомов. Электронные формулы ионов - Основы химии
Нормальное - когда все электроны находятся на своих обычных орбиталях (а они их стараются занять наиболее энергетически выгодное положение, находится...
-
Важной задачей статистики является разработка методики статистической оценки социально-экономических явлений, которая осложняется тем, что многие...
-
Строение Солнечной системы. Солнечно-Земные связи - Основы естественно-научных знаний
Вселенная -- это весь окружающий нас мир, безграничный во времени и пространстве и бесконечно разнообразный по формам, которые принимает вечно движущаяся...
-
"Квантовая химия" Квантовая химия - область теоретической химии, в которой вопросы строения и реакционной способности химических соединений, химические...
-
МООС - Моделирование бизнес-процессов и информационных сервисов электронного образования
Массовые открытые онлайн курсы одна из форм дистанционного образования, представляющие из себя интернет-курсы с масштабным интерактивным участием и...
-
Периодическая система химических элементов 1 марта 1869 года признан днем открытия Периодического закона, который представляет собой один из наиболее...
-
Строение атома, Квантовые числа. Атомные орбитали - Систематика химических элементов
Квантовые числа. Атомные орбитали Состояние электрона в атоме любого химического элемента характеризуется четырьмя квантовыми числами: главным,...
-
Рис. 5. Масс-спектрометрия электронной ионизацией (EI). Электронная ионизация - один из наиболее важных способов ионизации для повседневных анализов...
-
Новый класс металлорганических соединений, имеющий двухслойную структуру, называется "сэндвичевые соединения". Наиболее изученным из них является...
-
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов,...
-
После того, как ионы разделены анализатором масс, они достигают ионного детектора, где генерируют токовый сигнал падающих ионов. Самым распространенным...
-
Дипольный момент молекулы и связи
Представим себе, что можно найти "центры тяжести" отрицательных и положительных частей молекулы. Тогда условно все вещества можно разбить на две группы....
-
Периодическое изменение свойств атомов химических элементов - Систематика химических элементов
Химические свойства атомов элементов проявляются при их взаимодействии. Типы конфигураций внешних энергетических уровней атомов определяют основные...
Теория отталкивания электронных пар валентного уровня - Типы химических связей. Ковалентная связь