Фізичні властивості, Хімічні властивості - Загальна характеристика, номенклатура та ізомерія оксигеновмісних органічних сполук
Феноли - безбарвні кристалічні речовини або рідини з характерним запахом. Як правило, вони погано розчинні у воді; при зберіганні на повітрі окиснюються (темніють).
Хімічні властивості
Для фенолів характерні реакції, що відбуваються за участю гідроксильної групи та бензенового ядра.
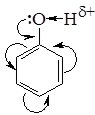
В молекулі фенолу гідроксильна група безпосередньо зв'язана з бензеновим ядром. Внаслідок цього одна з неподілених пар електронів атома Оксигену гідроксильної групи взаємодіє з р-електронами бензенового ядра. Це веде до зміщення електронної густини з атома Оксигену в бік ароматичного ядра. У результаті спостерігається зменшення електронної густини на атомі Оксигену гідроксильної групи та її збільшення в бензеновому ядрі, що впливає на реакційну здатність ОН-групи і бензенового ядра.
Реакції за участю гідроксильної групи.
1. Кислотні властивості.
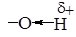
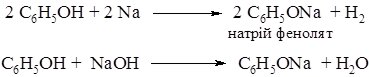
Зменшення електронної густини на атомі Оксигену веде до підвищення полярності зв'язку - О-Н, оскільки атом Оксигену сильніше, ніж у молекулі спирту, відтягає спільну пару електронів від атома Гідрогену. Атом Гідрогену набуває більшого часткового позитивного заряду і легко може відщеплюватись у вигляді протону Н+, тому феноли виявляють сильніші кислотні властивості, ніж спирти. Так, феноли реагують не тільки з металами, але і з гідроксидами, утворюючі феноляти:
У 1835 р. Ф. Рунге дав назву фенолу "карболова кислота", за його здатність взаємодіяти з лугом.
Утворені феноляти, на відміну від алкоголятів, не розкладаються водою. Водні розчини фенолятів мають лужну реакцію. Однак, при дії кислот, навіть такої слабкої як карбонатна відбувається розклад фенолятів:

3. Утворення етерів. Зручними методом синтезу фенілових етерів є взаємодія фенолятів лужних металів з галагенопохідними вуглеводнів:


Дифеніловий етер одержують у присутності каталізатора - порошку міді.
Реакції по бензеновому ядру.
У результаті зміщення електронної густини з гідроксильної групи на бензенове ядро, значно зростає реакційна здатність останнього.
3. Нітрування Фенолу відбувається за кімнатної температури, при обробці розведеною нітратною кислотою з утворенням суміші Орто- і Пара-нітрофенолів. Використання концентрованої нітратної кислоти у цій реакції призводить до утворення 2,4,6-тринітрофенолу:
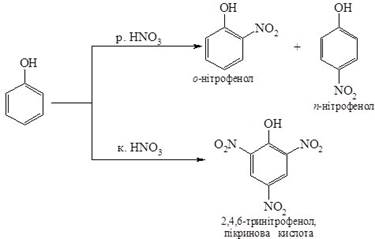
4. Бромування. Якщо бензен галогенується тільки за наявності каталізатора, то фенол бромується вже за кімнатної температури бромною водою. Відбувається заміщення атомів Гідрогену в О- і П- положеннях:
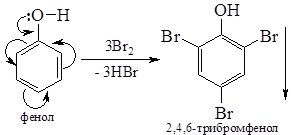
2,4,6-Трибромфенол не розчиняється у воді і випадає у вигляді білого осаду, що використовують для виявлення фенолу.
Похожие статьи
-
Реакції, в які вступають спирти, супроводжуються розривом зв'язків О-Н або С-О. 1. Кислотні властивості спиртів. Утворення алкоголятів. Спирти не...
-
Горіння простих і складних речовин: А) С + О2 СО2 2Сu + O2 = 2CuO (окислення, крім благородних металів) Б) СН4 + 2О2 СО2 + 2Н2О 2. Розклад під час...
-
Гідроксильні похідні ароматичних вуглеводнів, у яких гідроксильна група безпосередньо зв'язана з бензольним ядром. Сполуки, що містять гідроксил в...
-
Фізичні та хімічні властивості - Натрій: історія, властивості
Фізичні властивості. Оскільки в атомах лужних металів один зовнішній електрон доводиться на 4 і більше вільні орбіталі, а енергія іонізації атомів...
-
Загальна формула одноатомних спиртів R-OH. Залежно від того, з яким атомом Карбону (первинним, вторинним чи третинним) зв'язана гідроксильна група,...
-
1. Гідроліз галогенопохідних. При обробці галагенопохідних водним розчином лугу, іде заміщення галогену на гідроксил. СН3СН2Br + NaOH > СН3СН2OH +...
-
Вступ - Загальна характеристика, номенклатура та ізомерія оксигеновмісних органічних сполук
Всі органічні речовини передусім складаються з атомів карбону і гідрогену. Але, поряд з тим, відомо багато речевин містить також атоми оксигену. Із...
-
Фізичні властивості, ХІМІЧНІ ВЛАСТИВОСТІ - Амінокислоти: одержання, властивості, роль у біології
Амінокислоти-безбарвні кристалічні речовини з високими температурами плавлення, які мало відрізняються для цих кислот і тому не характерні. Плавлення...
-
Спирти, молекули яких містять декілька гідроксильних груп відносять до Багатоатомних спиртів . Спирти, які містять дві гідроксильні групи біля одного...
-
АМІНОКИСЛОТИ, ІЗОМЕРІЯ. НОМЕНКЛАТУРА - Амінокислоти: одержання, властивості, роль у біології
Органічні сполуки, що містять в молекулі карбоксильну та аміно групи, називають - амінокислотами. Амінокислоти мають надзвичайно велике значення в...
-
ХІМІЧНІ ВЛАСТИВОСТІ КИСНЮ І СІРКИ - Загальні відомості про елементи
Ви вже знаєте, що кисень -- дуже реакційноздатна речовина. Він реагує з багатьма металами, неметалами багатьма складними речовинами, виявляючи...
-
ХІМІЧНІ ВЛАСТИВОСТІ КИСНЮ І СІРКИ - Неметали та їхні сполуки
Ви вже знаєте, що кисень - дуже реакційноздатна речовина. Він реагує з багатьма металами, неметалами багатьма складними речовинами, виявляючи властивості...
-
ЗАГАЛЬНА ХАРАКТЕРИСТИКА ОКСИГЕНУ І СУЛЬФУРУ - Неметали та їхні сполуки
Історичні відомості. Про історію відкриття кисню, молекули якого складаються з елемента Оксигену, ви довідалися ще у 8 класі. Тепер ознайомтеся з деякими...
-
ЙОД Сировиною для промислового одержання йоду служать нафтові бурові води, морські водорості, а також маткові розчини чилійської (натрієвої) селітри, що...
-
Оксиди, їх класифікація. Номенклатура - Оксиди, загальна характеристика
Оксидами називаються складні речовини, до яких входять два елементи, один з яких оксиген. Майже всі хімічні елементи утворюють оксиди. І досі ще не...
-
ЗАГАЛЬНА ХАРАКТЕРИСТИКА ОКСИГЕНУ І СУЛЬФУРУ - Загальні відомості про елементи
Історичні відомості. Про історію відкриття кисню, молекули якого складаються з елемента Оксигену, ви довідалися ще у 8 класі. Тепер ознайомтеся з деякими...
-
СПГ зберігається в спеціальних кріоцістернах, влаштованих за принципом посудини Дюара. Транспортується СПГ на спеціалізованих морських суднах - танкерах,...
-
Фізичні і механічні властивості титану - Титан та його властивості
Титан дуже тугоплавкий метал. Довгий час вважався, що він плавиться при 1800° С, однак у середині 50-х рр. англійські вчені Діардорф і Хейс установили...
-
Хімічні сполуки титану - Титан та його властивості
З одновалентними галогенами (фтором, бромом, хлором і йодом) він може утворювати ди - три - і, тетраз'єднання, із сіркою й елементами її групи (селеном,...
-
Вступ - Типові неметали - галогени, їх характеристика, властивості і сполуки
До головної підгрупи VII групи періодичної системи елементів Д. І. Менделєєва входять: Фтор F, Хлор Cl, Бром Br, Йод J та Астат At. Загальна назва цієї...
-
ЙОД ЙОД - І хімічний елемент VII групи періодичної системи Менделєєва, належить до галогенів (у літературі зустрічається також символ J); атомний номер...
-
Фізичні властивості. - Виробництво і застосування платини
Платина дуже тугоплавкий метал, кристалізується в гранецентровані кубічні (р. ц. до.) грати. При дії на розчини солей відновниками метал може бути...
-
Порівняльна характеристика харчової цінності жирів - Характеристика харчової цінності жирів
Порівняно з іншими продуктами жири мають найвищу калорійність і є основним джерелом енергії. Енергетичні витрати людини забезпечуються за рахунок жирів...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
ШЛЯХИ ОТРИМАННЯ АМІНОКИСЛОТ - Амінокислоти: одержання, властивості, роль у біології
Розроблено багато шляхів отримання - амінокислот. Найважливіші з них три: 1. Дія аміаку на солі хлорзамісних кислот:...
-
Общая характеристика жиров - Общая характеристика жиров
Жиры - природные соединения, находящиеся в тканях животных, растений, в семенах и плодах различных растений, в некоторых микроорганизмах. Как правило,...
-
Літературний огляд, Властивості ферментів - Вплив температури на амілолітичну активність
Властивості ферментів Ферменти - термолабільні сполуки. Це означає, що під дією високих температур вони денатурують. Спочатку при підвищенні температури...
-
Висновок - Типові неметали - галогени, їх характеристика, властивості і сполуки
Всі галогени дуже отруйні. Вдихання їхньої пари викликає подразнення органів дихання, а у великих кількостях вони викликають задуху. Особливо отруйним є...
-
Властивості титану - Титан та його властивості
У періодичній системі елементів Менделєєва титан має порядковий номер 22. Атомна маса природного титану, обчислена за результатами досліджень його...
-
Понятие и классификация спиртов СПИРТЫ (алкоголи) - класс органических соединений, содержащих одну или несколько группировок С-ОН, при этом гидроксильная...
-
Реакція термічного алкілування пропану етиленом - Алкани як паливо
Представляє скоріше теоретичний, ніж практичний інтерес. З цієї реакції витікає, що атоми водню метиленової групи більш реакційноздатні, ніж атоми водню...
-
Общая характеристика благородных газов - Благородные газы и их свойства
Главную подгруппу восьмой группы периодической системы составляют благородные газы -- гелий, неон, аргон, криптон, ксенон и радон. Эти элементы...
-
Ізомеризація - Алкани як паливо. Октанове та цетанове число
Цей процес застосовується для перетворення н-пентану і н-гексану в цінніші ізомери з розгалудженим ланцюгом. В якості каталізаторів, активних при...
-
Это метод который нашел мировое применение для анализа лекарствнных средств. Он основан на свойстве галогенидов количественно осаждаться нитратом серебра...
-
Введение - Характеристика, классификация, история аварий на атомных электростанциях
Ядерная энергетика (Атомная энергетика) -- это отрасль энергетики, занимающаяся производством электрической и тепловой энергии путем преобразования...
-
ГИДРОЛИЗ СОЛЕЙ - Характеристика основных видов растворов
Гидролизом называется обменная реакция между веществом и водой. При гидролизе обычно происходит изменение реакции среды. Если гидролиз не сопровождается...
-
Загальна характеристика підприємства ТОВ "МегаТоп" є спеціалізованим підприємством з виробництва спеціальних видів взуття. Виробництво зазначеного взуття...
-
Водораствроримые витамины Большинство водорастворимых витаминов, поступающих с пищей или синтезируемых кишечными бактериями, проявляют активность после...
-
К числу таких реакций относятся взаимодействия солей двухвалентных катионов (кроме Ca2+, Sr2+, Ba2+) с водными растворами карбонатов натрия или калия,...
-
1. Спирты реагируют со щелочными металлами (Na, K и т. д.) с образованием алкоголятов: 2R--OH + 2Na 2R--ONa + H2 Реакция протекает не так бурно, как при...
Фізичні властивості, Хімічні властивості - Загальна характеристика, номенклатура та ізомерія оксигеновмісних органічних сполук