Влияние различных факторов на растворимость веществ - Растворы
Растворимость зависит от природы растворяемого вещества и растворителя, температуры, давления и влияния посторонних веществ.
Природа веществ, образующих раствор. Этот фактор хорошо иллюстрирует старое правило: подобное растворяется в подобном. Под подобием подразумевают природу химической связи в веществах, образующих раствор. Действительно, две неполярные жидкости будут смешиваться друг с другом неограниченно, а неполярная и полярная жидкости будут практически нерастворимы друг в друге.
Вещества, состоящие из неполярных молекул, лучше растворяются в неполярных растворителях, например, сера хорошо растворяется в сероуглероде и практически не растворяется в воде. Кислород в воде растворяется в 10 раз хуже, чем в бензоле.
Вещества с ионным и ковалентным полярным характером связи, как правило, хорошо растворяются в сильно полярных растворителях. Однако ионные кристаллические структуры гораздо прочнее, чем молекулярные, поэтому, когда энергия кристаллической решетки велика, а энергия сольватации низка, растворимость таких соединений в воде мала (BaSO4, CuS, CaF2 и т. д.).
Максимальную энергию кристаллической решетки имеют полимерные соединений с ковалентной связью (алмаз, диоксид кремния и т. д.), поэтому растворимость таких веществ ничтожно мала в любых растворителях.
Температура.
Согласно принципу Ле Шателье, на зависимость растворимости от температуры влияет значение теплового эффект растворения данного вещества в данном растворителе.
Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость будет уменьшаться (например, Ca(OH)2 в воде) и наоборот. Для большинства солей растворимость при нагревании увеличивается.
Практически все газы растворяются с выделением тепла, поэтому растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением температуры - увеличивается.
Если измерять растворимость веществ при разных температурах, то обнаружится, что одни вещества сильно изменяют свою растворимость в зависимости от температуры, другие - не очень сильно (табл. 2).
Таблица 2.
Влияние температуры на растворимость некоторых твердых веществ.
В таблице приведена растворимость в г/100 г воды
|
Вещество |
Температура, ОC | ||||
|
0 |
20 |
50 |
80 |
100 | |
|
KBr |
53,5 |
65,2 |
80,8 |
94,6 |
103,3 |
|
NaCl |
35,7 |
35,9 |
36,8 |
38,1 |
39,4 |
|
CaSO4 |
0,176 |
0,206 |
0,180 |
0,102 |
0,066 |
Если полученные экспериментальным путем значения растворимости при различных температурах нанести на оси координат, то получаются так называемые Кривые растворимости различных веществ (рис. 3).
Эти кривые имеют большое практическое значение. Используя эти кривые, можно рассчитать, сколько вещества, например KNO3, выпадет в осадок при охлаждении до 20ОС насыщенного раствора, приготовленного при температуре 80ОС. На этом основаны процессы, которые позволяют очищать некоторые вещества. Дело в том, что при охлаждении ненасыщенного раствора образуется насыщенный раствор, но Насыщенный по основному веществу, которого больше всего, а не по Примесям. Поэтому при охлаждении в осадок выпадает только Чистое вещество, а примеси (вместе с частью вещества) остаются в растворе. Чистые кристаллы потом отфильтровывают от охлажденного, загрязненного примесями раствора. Этот способ очистки называется ПЕРЕКРИСТАЛЛИЗАЦИЕЙ. Так очищают, например, многие лекарственные препараты.
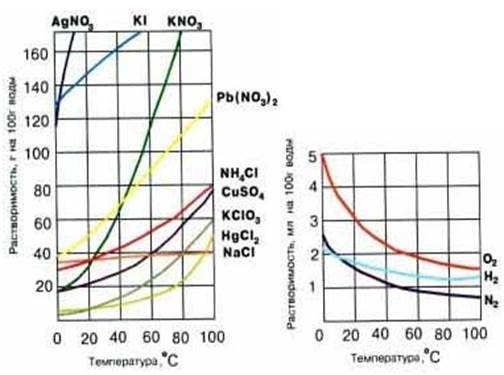
Рис. 3. Кривые растворимости твердых (а) и газообразных (б) веществ.
Давление. По принципу Ле Шателье увеличение давления смещает равновесие в сторону уменьшения объема системы. При растворении твердых веществ в жидкости объем изменяется мало, поэтому давление не будет существенным образом влиять на растворимость солей. Также влияние давления практически не будет проявляться и для смеси двух жидкостей.
Растворимость газов сильно зависит от давления, так как в этом случае происходит значительное изменение объема системы. С увеличением давления растворимость газов увеличивается.
Для смеси газов растворимость каждого из них определяется Законом Генри:
Растворимость летучего вещества при постоянной температуре прямо пропорциональна его парциальному давлению над раствором.
Закон справедлив для разбавленных растворов, невысоких давлений и при отсутствии химического взаимодействия с растворителем.
Влияние посторонних веществ на растворимость.
Эффект "высаливания".
Если постороннее вещество сильно сольватируется и дает прочные связи с растворителем, то в его присутствии растворимость других веществ падает. Например, добавление хорошо растворимых солей уменьшает растворимость газов в воде, а добавление спирта уменьшает растворимость большинства солей:
NaClКр + H2O Na+Аq + Cl- аq
<------
Спирт
Такой же эффект вызывает добавление концентрированной соляной кислоты к насыщенному раствору хлорида натрия
NaClКр + H2O Na+Аq + Cl- аq
<------
HCl > H+ + Cl-
Присутствие одноименных ионов.
Если постороннее вещество дает ионы, одноименные с ионами растворенного вещества, в этом случае растворимость данного вещества также уменьшается:
NaClкр + H2O Na+аq + Cl - аq
<------
HCl > H+ + Cl-
Солевой эффект.
Хорошо растворимое третье вещество поставляет в систему большое количество посторонних ионов, что приводит к повышению растворимости ионных соединений.
BaSO4 (кр) Ba2+ + SO42-
------>
KNO3 > K+ + NO3-
Похожие статьи
-
Растворимость веществ - Растворы
Растворение - самопроизвольный (так как идет с увеличением энтропии в системе) обратимый процесс. Однако растворение возможно только до определенного...
-
РАСТВОРЫ. РАСТВОРИМОСТЬ, Общая характеристика и классификация растворов - Растворы
Общая характеристика и классификация растворов Растворы имеют большое значение для живых организмов (питательные вещества усваиваются в виде растворов;...
-
Основные опасности при перегонке связаны с использованием электрических нагревательных приборов (электроплитки, колбонагреватели). 1. Шнур (нельзя...
-
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ - Характеристика основных видов растворов
В насыщенном растворе малорастворимого сильного электролита устанав-ливается равновесие между твердой фазой (осадком) и ионами электролита: ВaSO4 (в...
-
ВИДЫ РАСТВОРОВ. РАСТВОРИМОСТЬ. ПРОЦЕСС РАСТВОРЕНИЯ - Характеристика основных видов растворов
Растворы - гомогенные системы, состоящие из двух или более компонентов (растворителя, растворенного вещества и продуктов их взаимодействия), состав...
-
Таблица 1 Физические свойства веществ используемых при синтезе [20] Название Формула Внешний вид ТПл, 0С ТКип, 0С Ратсворимость В воде В другом...
-
В основе метода лежит закон адитивности оптической плотности при соблюдении основного закона светопоглощения. Ход работы 1. Выбор оптимальных...
-
Создание мазей новых лекарственных препаратов, со вершенствование качества мазей, уже применяемых в ус ловиях клиник, невозможно без всестороннего...
-
Фенолфталеин - один из наиболее широко используемых в химии кислотно-основных индикаторов. Он относится к триарилметановым красителям, называемых...
-
Тепловые эффекты при растворении. Механизмы растворения веществ в воде - Растворы
Растворение веществ сопровождается различными тепловыми эффектами в зависимости от природы вещества. При растворении в воде, например, гидроксида калия...
-
1) рассеяние света 2) флотация-всплывание каллоидных частиц на поверхность 3) сидиментация - выпадение в осадок коллоидных частиц 4)коагуляция-уменьшение...
-
При работе флотационной машины в пульпе создаются значительные перепады давления. Поэтому, в соответствии с законом Генри, в зонах повышенного давления...
-
5.1 Основные опасности при работе с концентрированными кислотами 1. Сильные неорганические кислоты при попадании на кожу вызывают химические ожоги. При...
-
Рассмотрим реакцию между веществами А и В, протекающую по схеме: А А + в В = с С + d D Количественно зависимость между скоростью реакции и концентрациями...
-
Фенолфталеин - один из наиболее широко используемых индикаторов, особенно при объемном определении слабых кислот. Он обладает рядом преимуществ: не...
-
Важнейшей характеристикой раствора является его состав. Содержание растворенного вещества в растворе может быть выражено безразмерными единицами (долями...
-
Поляриметр. Удельное вращение - Оптические изомеры и их влияние на организм человека
Различить оптические изомеры можно с помощью поляриметра - прибора, измеряющего угол поворота плоскости поляризации. Величину оптической активности...
-
Осмотическое давление раствора - Характеристика основных видов растворов
В 1748 году было обнаружено явление перехода растворителя через мембрану из менее концентрированного раствора в более концентрированный, которое назвали...
-
Растворы - термодинамические устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это...
-
Минеральные кислоты, используемые для переведения анализируемой пробы в раствор, разделяют на две основные группы. 1) Кислоты, не оказывающие...
-
Разбавленные Растворы неэлектролитов (веществ, растворы или расплавы которых не проводят электрический ток) обладают рядом свойств, количественное...
-
Диэлектрическая проницаемость (ДП) раствора е относится к важнейшим факторам из числа оказывающих наиболее сильное влияние на характеристики протекающего...
-
Особое место в характеристике растворителей занимает диэлектрическая проницаемость. Преимущество последней по сравнению с другими критериями связаны с...
-
Большинство систем классификации растворителей по химическим признакам в явной либо неявной формах учитывает их кислотно-основные свойства. Поэтому самая...
-
Биологическая роль флавоноидов в жизни растений изучена еще недостаточно. Некоторые авторы считают, что флавоноиды принимают участие: * в...
-
Так как по ходу выполнения синтеза необходимо будет провести отгон не прореагировавшего фенола с помощью перегонки с водяным паром, необходимо...
-
СЛАБЫЕ ЭЛЕКТРОЛИТЫ - Характеристика основных видов растворов
При растворении в воде слабого электролита устанавливается динамическое равновесие между недиссоциированными молекулами и продуктами их диссоциации -...
-
Воздушная известь - одно из древнейших вяжущих, широко применяемых в строительстве и промышленности. Известь - продукт умеренного обжига кальциевых и...
-
Введение - Выпаривание раствора хлорида калия
Выпаривание - это процесс концентрирования растворов твердых нелетучих веществ путем частичного испарения растворителя при кипении жидкости. Выпаривание...
-
Способы получения насыщенных растворов - Синтез ацетата натрия ("Горячий лед")
Простейший способ приготовления насыщенных растворов - длительное настаивание растворителя с избытком растворяемого вещества, лучше всего при...
-
Что такое гравиметрический фактор F - Основы аналитической химии
Если мы знаем A - навеску анализируемой пробы, b - массу осадка и его состав, то мы можем вычислить содержание определяемого вещества X . X = a*F*100/b...
-
Природа растворов полимеров - Физико-химические свойства растворов полимеров
Размеры макромолекул соизмеримы с размерами коллоидных частиц. Поэтому растворы полимеров обнаруживают ряд свойств, характерных для коллоидных золей...
-
Метод вискозиметрии один из самых простых в аппаратурном; оформлении. В то же время он позволяет получить такие важные] характеристики макромолекул, как...
-
КРИСТАЛЛИЗАЦИЯ ВОДЫ И ВОДНЫХ РАСТВОРОВ В РАЛИЧНЫХ УСЛОВИЯХ - Химические свойства и строение воды
Для осуществления процесса кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два основных метода...
-
Схема реакции: Реактивы: Тимолфталеин, триэтиламин, хлороформ, дихлоангидрид терефталевой кислоты, гексан. Оборудование: Прибор для поликонденсации при...
-
Диспергированием называют тонкое измельчение твердых мате-риалов или жидкостей и распределение их частиц в жидкой или газообразной среде, в результате...
-
Процессы окисления. - Методы очистки и получения коллоидных растворов
Наряду с серой в реакциях окисления обычно образуются политио-новые кислоты, главным образом пентатионовая кислота H2S5O6 Реакции двойного обмена....
-
Молекулярно-массовые характеристики полимеров - Физико-химические свойства растворов полимеров
Полимолекулярность, средние молекулярные массы и молекулярно-массовое распределение. В силу особенностей процесса синтеза макромолекул и возможности их...
-
Физика низких температур, Низкие температуры - Свойства веществ при низких температурах
Низкие температуры Низкие температуры, криогенные температуры, обычно температуры, лежащие ниже точки кипения жидкого воздуха (около 80 К). Такие...
-
Свойства растворов неэлектролитов. Замерзание и кипение растворов. Законы Рауля - Основы химии
По наличию или отсутствию электрической проводимости растворы веществ делят на электролиты - проводящие электрический ток, и неэлектролиты - не...
Влияние различных факторов на растворимость веществ - Растворы