Эквивалентная электропроводность и подвижность ионов - Электрохимические методы анализа
Эквивалентная электропроводность (Л) - это электропроводность раствора, содержащего 1 моль экв электролита, измеренная при расстоянии между электродами L = 1 см.
Единица измерения л - Смсм2/моль экв.
Л нельзя измерить, ее рассчитывают:
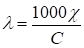
,
ГдеС - молярная концентрация эквивалента.
Факторы, влияющие на л:
1. Природа электролита:
Л = б (л+ + л-),
Гдеб - степень диссоциации;
Л+ и л - - Подвижности ионов:
л+ = F U,
ГдеF - число Фарадея;
U - скорости движения ионов.
В разбавленных растворах при С 0 степень диссоциации б 1, следовательно:
Л0 = л+0 + л-0 (Закон независимого движения ионов, уравнение Кольрауша),
Гдел0 - предельная электропроводность (при бесконечном разбавлении);
Л+0 и л-0 - предельные подвижности ионов (индивидуальные характеристики ионов, приведены в таблицах).
- 2. Температура (TО): чем больше TО, тем больше л. 3. Концентрация электролита (С): чем больше С, тем меньше л.
Для разбавленного раствора сильного электролита при z = 1:
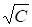
Л = л0 - В (Уравнение Онзагера),
Где В - константа.
Как видно из уравнения Онзагера, для получения линейной зависимости лучше всего строить график в координатах л = F() (рис. 13).
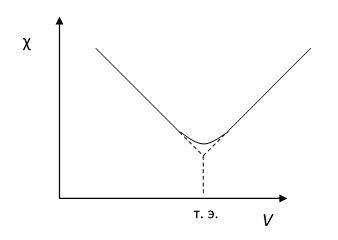
Рис. 13. Зависимость эквивалентной электропроводности от концентрации
При этом:
- - в разбавленных растворах зависимость л = F() - линейная; - в концентрированных - наблюдаются отклонения от линейности по тем же причинам, что и для ч.
Похожие статьи
-
Удельная электропроводность как аналитический сигнал - Электрохимические методы анализа
Удельная электропроводность (ч) - это электропроводность 1 см3 раствора, находящегося между электродами с площадью S = 1 см2 и расстоянием между ними L =...
-
Кондуктометрия, Основные узлы приборов - Электрохимические методы анализа
Кондуктометрия является старейшим, самым простым и наименее селективным из электрохимических методов анализа. Метод возник в 1885 г., когда Кольрауш...
-
Теоретические основы кондуктометрического метода анализа - Электрохимические методы исследования
Кондуктометрические методы анализа основаны на измерении электропроводности исследуемых растворов. Существует несколько методов кондуктометрического...
-
Методы кондуктометрии - Электрохимические методы исследования
Контактные методы. Измерения проводят с помощью контактных ячеек (рис. 3, а). При этом используют электроды из Pt, Ti, нержавеющей стали и др. Для...
-
Электрохимические методы анализа - Электрохимические методы анализа
Электрохимические методы анализа (ЭХМА) основаны на использовании процессов, которые протекают на поверхности электродов или в приэлектродном...
-
Кондуктометрическое титрование - Электрохимические методы исследования
Несомненно, большими аналитическими возможностями обладает кондуктометрическое титрование. Титрование позволяет восполнить недостаток селективности...
-
Метод дихотомии требует менее всего итераций цикла для получения корней уравнения с заданной точностью. Если расчет ведется без помощи ЭВМ, то это...
-
Полярографический метод анализа
Полярография -- метод качественного и количественного химического анализа, основанный на получении кривых зависимости величины тока от напряжения в цепи,...
-
Метод наименьших квадратов - Корреляционно-регрессионный анализ
Для определения коэффициентов уравнения регрессии b применяют разные методы (графический, метод средних), однако наибольшее распространение получил метод...
-
Метод наименьших квадратов - Анализ методов прогнозирования
Расчет параметров af b для конкретной функциональной зависимости осуществляется с помощью метода наименьших квадратов (МНК) и его модификаций. Суть МНК...
-
Введение - Электрохимические методы исследования
Кондуктометрия (от англ. conductivity - электропроводность и метрия) - совокупность электрохимических методов анализа, основанных на измерении...
-
Частным случаем недетерминированной связи является связь случайная - стохастическая (вероятностная). Реализация вероятностного подхода к описанию...
-
Численный сравнительный анализ - Ранговый метод оценивания параметров регрессионной модели
Итак, в рамках данной работы рассматриваются такие распределения случайных величин, как распределения Гаусса и Лапласа, треугольное распределение...
-
Регрессионный метод оценки, апроксимационные модели - Корреляционно-регрессионный анализ
При изучении любого процесса (физического, социального) прихоится сталкиваться с необходимостью представлять его в качестве некоторой модели, т. е. в...
-
Качественные методы анализа - Разработка технологической схемы получения анизола и крезола
Рециркуляционных реакционно-ректификационных процессов. При анализе сложных ХТС, характеризующихся большим числом параметров и переменных необходимо...
-
Построение теоретической функции методом наименьших квадратов Задание 1 Используя метод наименьших квадратов найти оценки коэффициентов регрессионной...
-
Регрессия -- зависимость среднего значения какой-либо величины от некоторой другой величины или от нескольких величин. Задача регрессионного анализа...
-
В настоящее время в условиях рыночной экономики появляется все больше и больше предприятий. Каждое предприятие стремится получить как можно большую...
-
Элементы матричного анализа - Методы решения системы линейных уравнений
Вектором, как на плоскости, так и в пространстве, называется направленный Отрезок , то есть такой Отрезок , один из концов которого выделен и называется...
-
Легирование В настоящее время создано большое число нержавеющих сталей путем присадок к железу никеля, хрома, кобальта и др. Оказалось, что при...
-
Алгоритмы метода Монте-Карло для решения интегральных уравнений второго рода Пусть необходимо вычислить линейный функционал , Где, причем для...
-
Это метод который нашел мировое применение для анализа лекарствнных средств. Он основан на свойстве галогенидов количественно осаждаться нитратом серебра...
-
Адсорбционные методы исследования свойств поверхности позволяют количественно охарактеризовать происходящие при адсорбции межмолекулярные взаимодействия,...
-
Нелинейный регрессионный анализ, Множественный регрессионный анализ - Основы научных исследований
Линейные по параметрам регрессионные модели можно использовать для аппроксимации нелинейных зависимостей путем их линеаризации с помощью базисных...
-
Заключение - Электрохимические методы исследования
Кондуктометрия - совокупность электрохимических методов анализа, основанных на измерении электропроводности х жидких электролитов, которая...
-
В настоящее время производственные методы получения формальдегида большим разнообразием не отличаются. Так, в реакциях восстановления СО и СО2 Водой...
-
Знаменитая теория полимолекулярной адсорбции Брунауэра, Эммета и Теллера, получившая название теории БЭТ (по первым буквам фамилий ученых), основана на...
-
Фотоэлектроколориметрические методы относятся к объективным методам, так как интенсивность окраски растворов оценивают с помощью специальных устройств -...
-
Методы непараметрической статистики - Основы теории систем и системного анализа
Использование классических распределений случайных величин обычно называют "параметрической статистикой" - мы делаем предположение о том, что...
-
Применение статистических методов анализа для адекватной интерпретации результатов контроля остаточных знаний соискателей высшего образования на примере...
-
Уровень науки и техники Надежность средств, с помощью которых человек достигает космоса высокая, но не идеальна. РН -- сложная конструкция, и даже в...
-
Количественный анализ - это совокупность, химических, физико-химических и физических методов определения количественного соотношения компонентов,...
-
Выпаривание пробы воды производится при температуре не более 90-950С на специальной установке, состоящей из электроплитки, песчаной бани, на которую...
-
Сравнительный анализ иерархических и неиерархических методов кластеризации - Кластерный анализ
Перед проведением кластеризации у аналитика может возникнуть вопрос, какой группе методов кластерного анализа отдать предпочтение. Выбирая между...
-
Преимущества комплексного применения методов анализа силикатных материалов
Химический состав силикатов можно представить как сочетание различных оксидов металлов и неметаллов с SiO2. Например, силикат натрия - натриевая соль...
-
В соответствии со вторым законом термодинамики элементарный акт флотации возможен, если свободная энергия Е2 системы после закрепления частицы на...
-
Вещество [Co] Лиганды и Комплексообразователь Координационное число 6 Для комплексов с координационным числом 6 характерно октаэдрическое расположение...
-
Правила построения рядов динамики - Методы анализа основной тендеции развития в рядах динамики
При построении динамических рядов необходимо соблюдать определенные правила: основным условием для получения правильных выводов при анализе рядов...
-
Выбор метода производства (или выделение) готового продукта Современные методы производства азотной кислоты основаны на применении синтетического аммиака...
-
МЕТОДЫ СРАВНИТЕЛЬНОГО ШКАЛИРОВАНИЯ - Многомерный статистический анализ
Шкалирование методом попарного сравнения - Это метод сравнительного шкалирования, при котором респонденту дается два объекта для выбора по определенному...
Эквивалентная электропроводность и подвижность ионов - Электрохимические методы анализа