КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ - Растворы
Коллигативными свойствами называют физико-химические свойства растворов, которые обусловлены Природой растворителя и числом частиц растворенного вещества в растворе (т. е. Концентрацией растворенного вещества), но не зависят от свойств растворенного вещества.
Добавление растворимого вещества к растворителю влияет на изменение физико-химических свойств не только растворенного вещества, но и самого растворителя. Основной причиной изменения свойств растворителя является уменьшение концентрации его свободных молекул. В первую очередь изменяются такие свойства, как Давление насыщенного пара растворителя, температуры замерзания и кипения, а также осмотическое давление. Перечисленные четыре свойства относятся к коллигативным свойствам растворов.
Первый закон Рауля
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Математическим выражением закона Рауля является уравнение:
(РО - Р1)/РО = N1,
Где N1 - мольная доля растворенного вещества;
РО - давление насыщенного пара над чистым растворителем;
Р1 - давление насыщенного пара растворителя над раствором.
Давление насыщенного пара растворителя над раствором всегда ниже, чем, над чистым растворителем (РО > P1). Явление понижения давления насыщенного пара над раствором вытекает из принципа Ле Шателье. Представим себе равновесие между жидкостью (например, водой) и ее паром:
Н2ОЖидк Н2ОПар, ДН > 0, ДS > 0
Этому равновесию отвечает определенное давление насыщенного пара РО. Если теперь растворить в воде некоторое количество нелетучего вещества, то часть молекул растворителя будет связываться с этим веществом и не сможет участвовать в диффузии и перераспределении энергии и пойдет процесс, смещающий равновесие влево - конденсация пара. Через некоторое время скорости прямого и обратного процессов сравняются, установится новое равновесие, но При более низком давлении насыщенного пара P1 < РО .
Рассмотрим следствия, вытекающие из этого утверждения. На фазовой диаграмме однокомпонентной системы линия О*В*, показывающая зависимость давления пара растворителя над раствором, будет расположена ниже аналогичной кривой (ОВ) для чистого растворителя (рис. 4).
Отсюда вытекает Первое следствие понижения давления насыщенного пара растворителя над раствором:
Раствор всегда кипит при температуре, которая выше температуры кипения чистого растворителя.
Жидкость закипает тогда, когда давление насыщенного пара над ней и в пузырьках пара внутри жидкости сравняется с внешним давлением. Реально парциальное давление пара будет несколько больше атмосферного, т. к. необходимо совершать работу по созданию новых поверхностей раздела и разрывать большое число межмолекулярных связей.
Введение в кипящую жидкость нелетучего вещества по закону Рауля приводит к уменьшению давления пара растворителя и кипение прекращается. Чтобы снова достигнуть атмосферного давления в пузырьках пара, необходимо дополнительное увеличение температуры. Из рисунка 4 видно, что температура кипения раствора всегда больше, чем температура кипения чистого растворителя, т. к. давление насыщенного пара растворителя достигает значения внешнего давления при более высокой температуре.
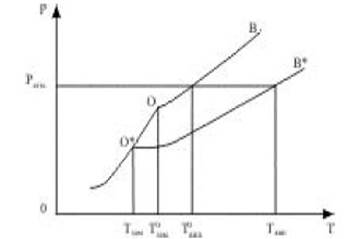
Рис. 4 Зависимость давления насыщенного пара растворителя над раствором и чистым растворителем.
Начало кристаллизации жидкости начинается, когда сравниваются давления насыщенных паров над твердой и жидкой фазой. Из рис.4 следует, что для раствора это происходит при более низкой температуре, чем для чистого растворителя.
Второе следствие из закона Рауля:
Раствор начинает замерзать при более низкой температуре, чем чистый растворитель.
Этим свойством растворов широко пользуются дворники для очистки тротуаров ото льда зимой. Если ко льду добавить соль, то образуется раствор, температура замерзания которого ниже температуры окружающей среды, и лед тает.
Чем выше концентрация раствора, тем давление насыщенного пара растворителя над ним будет ниже, и раствор будет закипать при более высоких температурах, а замерзать при более низких. Отсюда:
Второй закон Рауля
Повышение температуры кипения или понижение температуры кристаллизации раствора прямо пропорционально моляльной концентрации растворенного вещества.
?tКип = КЭ?СM; ?tКрист = КК?СM, (2.1)
Где СM - моляльная концентрация раствора;
КЭ - эбуллиоскопическая константа растворителя;
КК - криоскопическая константа растворителя.
Моляльная концентрация в уравнениях второго закона Рауля применяется из-за того, что во всех других способах выражения концентраций количество растворителя зависит от количества растворенного вещества, а в моляльной концентрации - фиксированое количество растворителя, а именно 1000 граммов. Так что изменение температур плавления и кипения раствора будет зависеть лишь от количества частиц растворенного в нем вещества.
Физический смысл констант КЭ и КК Легко сформулировать, допустив, что моляльная концентрация равна единице. Отсюда следует, что
Эбуллиоскопическая постоянная равна моляльному повышению температуры кипения раствора, а криоскопическая постоянная равна моляльному понижению температуры замерзания раствора.
Эбуллиоскопическая и криоскопическая константа зависят только от природы растворителя, например, КЭ(Н2О) = 0,52 и КК(Н2О) = 1,86.
Если в растворе растворено П граммов вещества в Т граммах растворителя, то легко рассчитать моляльную концентрацию раствора. Для этого надо поделить массу растворенного вещества на М - Его молярную массу, умножить на 1000 и разделить на массу растворителя:
Сm = 1000-n/M-m.
Подставив полученное выражение для концентрации в уравнение (2.1), получим уравнения для вычисления изменений температур плавления и кипения растворов:
?tКип = КЭ? 1000-N/M-M; ?tКрист = КК?1000-N/M-M. (2.2)
Способность понижать температуру плавления или повышать температуру кипения растворов используют для определения молекулярных масс новых соединений. Массы неизвестного вещества и растворителя можно определить точно. Эбуллиоскопические и криоскопические постоянные определены с большой точностью для большого числа растворителей, их значения можно найти в справочниках. Разность между температурами кипения чистого растворителя и раствора легко измеряется. Поэтому в уравнениях (2.2) единственной неизвестной величиной является молекулярная масса. Эти методы применимы только для соединений, которые не диссоциируют в выбранном растворителе.
Методами эбуллиоскопии и криоскопии можно вычислять и среднюю степень полимеризации, так как с их помощью находят среднюю молекулярную массу полимера, а молекулярная масса мономера известна.
Осмос. Осмотическое давление. Закон Вант-Гоффа.
Одним из свойств растворов, связанных с изменением количества свободных молекул растворителя, является Осмос. Осмотические явления возникают на границе двух растворов с различной концентрацией, разделенных полупроницаемой перегородкой. Полупроницаемая перегородка пропускает только молекулы растворителя и препятствует проникновению через нее частиц растворенного вещества.
Сущность явления осмоса состоит в том, что происходит выравнивание концентраций соприкасающихся растворов за счет самопроизвольного перехода молекул растворителя через полупроницаемую перегородку из одного раствора в другой под влиянием разницы их концентраций.
Возьмем сосуд, в котором два раствора разделены гибкой полупроницаемой перегородкой (рис.5). Если концентрации растворов равны, то число молекул растворителя, проходящих из одного раствора в другой в единицу времени, будет одинаковым, вследствие чего объемы растворов изменяться не будут.
Если концентрации растворов отличаются (см. рис. 5, CI > C2), то скорость перехода молекул растворителя из менее концентрированного раствора больше, чем скорость перехода молекул растворителя из более концентрированного.
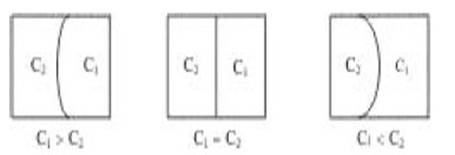
Рис.5. Схема возникновения явления осмоса
Это приводит к увеличению объема правого раствора и уменьшению левого. Осмос прекратится, когда концентрации в обоих растворах сравняются.
Количественно это явление характеризуется величиной давления, которое нужно приложить к раствору, чтобы прекратить проникновение молекул растворителя в более концентрированный раствор соли из более разбавленного раствора. Такое давление называется Осмотическим давлением. Рассчитать величину осмотического давления можно по формуле:
Р = CМ RT, (2.3)
Где р -- осмотическое давление (кПа),
СМ -- Молярная концентрация раствора (моль/л),
R -- универсальная газовая постоянная,
Т -- температура в К.
Если выразить концентрацию через количество вещества и объем: n/V и подставить это отношение в уравнение (2.3), получим выражение:
Р V = n RT/V, (2.4)
Напоминающее уравнение Менделеева-Клайперона для идеального газа.
Используя уравнение (2.4), сформулируем Физический смысл осмотического давления:
Осмотическое давление -- это такое давление, которое создавало бы растворенное вещество в количестве n молей, если бы оно в виде газа занимало весь объем раствора при данной температуре.
Явление осмоса играет большую роль в биологии, так как свойствами полупроницаемых перегородок обладает большинство тканей организмов. Процессы обмена веществ, усвоение пищи тесно связаны с этим явлением. Резь в глазах, возникающая у человека при нырянии, также обуславливается различной проницаемостью молекул воды через глазные ткани. Этим же объясняется невозможность существования пресноводных рыб в морской воде.
Вопросы для самоконтроля по теме "Коллигативные свойства"
- 1. Какие свойства растворов относятся к коллигативным? 2. Сформулируйте 1-й закон Рауля. 3. В чем суть 2-го закона Рауля? 4. Физический смысл криоскопической и эбуллиоскопической констант воды? 5. Что называется осмосом?
Похожие статьи
-
Свойства растворов неэлектролитов. Замерзание и кипение растворов. Законы Рауля - Основы химии
По наличию или отсутствию электрической проводимости растворы веществ делят на электролиты - проводящие электрический ток, и неэлектролиты - не...
-
Разбавленные Растворы неэлектролитов (веществ, растворы или расплавы которых не проводят электрический ток) обладают рядом свойств, количественное...
-
Природа растворов полимеров - Физико-химические свойства растворов полимеров
Размеры макромолекул соизмеримы с размерами коллоидных частиц. Поэтому растворы полимеров обнаруживают ряд свойств, характерных для коллоидных золей...
-
Метод вискозиметрии один из самых простых в аппаратурном; оформлении. В то же время он позволяет получить такие важные] характеристики макромолекул, как...
-
Молекулярно-массовые характеристики полимеров - Физико-химические свойства растворов полимеров
Полимолекулярность, средние молекулярные массы и молекулярно-массовое распределение. В силу особенностей процесса синтеза макромолекул и возможности их...
-
Растворимость веществ - Растворы
Растворение - самопроизвольный (так как идет с увеличением энтропии в системе) обратимый процесс. Однако растворение возможно только до определенного...
-
Растворы - термодинамические устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это...
-
Осмотическое давление раствора - Характеристика основных видов растворов
В 1748 году было обнаружено явление перехода растворителя через мембрану из менее концентрированного раствора в более концентрированный, которое назвали...
-
КРИСТАЛЛИЗАЦИЯ ВОДЫ И ВОДНЫХ РАСТВОРОВ В РАЛИЧНЫХ УСЛОВИЯХ - Химические свойства и строение воды
Для осуществления процесса кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два основных метода...
-
Способы выражения концентрации растворов - Растворы
Концентрация раствора отражает количественные соотношения между растворителем и растворенным веществом. Массовая доля (щ) показывает число единиц массы...
-
РАСТВОРЫ. РАСТВОРИМОСТЬ, Общая характеристика и классификация растворов - Растворы
Общая характеристика и классификация растворов Растворы имеют большое значение для живых организмов (питательные вещества усваиваются в виде растворов;...
-
МЕТОДЫ ОСАЖДЕНИЯ, ИОННОГО ОБМЕНА, МЕМБРАННЫЕ МЕТОДЫ - Химические свойства и строение воды
Современные технологии позволяют изготавливать объемные или плоские фильтрующие материалы с однородными каналами практически любого размера. Мембранный...
-
Влияние различных факторов на растворимость веществ - Растворы
Растворимость зависит от природы растворяемого вещества и растворителя, температуры, давления и влияния посторонних веществ. Природа веществ, образующих...
-
Способы получения насыщенных растворов - Синтез ацетата натрия ("Горячий лед")
Простейший способ приготовления насыщенных растворов - длительное настаивание растворителя с избытком растворяемого вещества, лучше всего при...
-
Пористые полупроницаемые мембраны, применяемые для диали-за, электродиализа, ультрафильтрации и осмометрии, как правило, не являются инертными чисто...
-
Алюминаты. Алюминатные растворы - Алюминий и его свойства
Оксид алюминия - соединение амфотерное, т. е. обладающее одновременно основными и кислотными свойствами. Поэтому оксид, а также его гидроксиды...
-
Важнейшей характеристикой раствора является его состав. Содержание растворенного вещества в растворе может быть выражено безразмерными единицами (долями...
-
УМЯГЧЕНИЕ И ОБЕССОЛИВАНИЕ ВОДЫ - Химические свойства и строение воды
Под умягчением воды подразумевается процесс удаления из нее катионов жесткости, т. е. кальция и магния. В соответствии с ГОСТ 2874-82 "Вода питьевая"...
-
Приготовление растворов - Расчеты при приготовлении водных растворов
Концентрация растворов Масса раствора состоит из массы вещества и массы воды, т. е. Концентрация раствора Для дезинфекции чаще всего используются...
-
Электролиз - физико-химический процесс, состоящий в выделении на Электродах составных частей растворенных веществ или других веществ, который возникает...
-
Система лабораторного контроля - Свойства и состав нефти
Для проведения анализов и определения качественных характеристик нефти организуется система лабораторного контроля. Большинство методов оценки и анализа...
-
Стандартные методы, как правило, предусматривают использование количественного анализа, позволяющего установить точное содержание отдельных элементов и...
-
Физические и химические свойства простого вещества - Свойства германия
Начать следует с описания физических свойств простого вещества германия. Германий представляет собой твердый серебристо-белый полуметалл, обладающий...
-
Применение H2O2 связано с его окислительными свойствами и безвредностью продукта его восстановления (H2O). Его использую для отбеливания тканей и мехов,...
-
ВИДЫ РАСТВОРОВ. РАСТВОРИМОСТЬ. ПРОЦЕСС РАСТВОРЕНИЯ - Характеристика основных видов растворов
Растворы - гомогенные системы, состоящие из двух или более компонентов (растворителя, растворенного вещества и продуктов их взаимодействия), состав...
-
1) рассеяние света 2) флотация-всплывание каллоидных частиц на поверхность 3) сидиментация - выпадение в осадок коллоидных частиц 4)коагуляция-уменьшение...
-
Давление пара металлов - Структура и свойства металлических расплавов
Как и все вещества, металлы обладают конечным значением давления собственного пара, хотя весьма незначительным. С этим свойством приходится считаться при...
-
Диффузия в металлических расплавах - Структура и свойства металлических расплавов
Диффузия - это процесс самопроизвольного выравнивания концентрации веществ по всему объему системы. Различают внешнюю диффузию, когда массоперенос идет в...
-
Свойства полимера, полученного различными методами - Важнейшие представители полимеров
Молекулярная цепь полистирола имеет преимущественно линейное строение с небольшим количеством разветвлений, возникающих в результате реакций передачи...
-
Расчет производительности вакуум-насоса - Выпаривание раствора хлорида калия
Производительность вакуум-насоса GВозд, кг/с определяется количеством газа (воздуха), который необходимо удалять из барометрического конденсатора: GВозд...
-
Технологические свойства метанола Метанол (метиловый спирт) СН3ОН представляет бесцветную легкоподвижную жидкость с температурой кипения 64,65°С,...
-
Свойства дисперсии и пленок - Синтез полиуретанов
В отличие от ПУ на основе растворителей, частицы должны сначала вернуться в непрерывной органической фазе, прежде чем отдельные полимерные цепи могут...
-
Физические свойства - Свойства аминокислот
Аминокислоты -- бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом. Химические свойства: Все...
-
Методы выделения - Свойства флавоноидов
Для флавоноидов, как и для других веществ, не существует способа выделения, универсального для всех растительных материалов. В каждом конкретном случае...
-
Введение - Выпаривание раствора хлорида калия
Выпаривание - это процесс концентрирования растворов твердых нелетучих веществ путем частичного испарения растворителя при кипении жидкости. Выпаривание...
-
Минеральные кислоты, используемые для переведения анализируемой пробы в раствор, разделяют на две основные группы. 1) Кислоты, не оказывающие...
-
ВВЕДЕНИЕ, СТРОЕНИЕ МОЛЕКУЛ И СВОЙСТВА ВОДЫ - Химические свойства и строение воды
Вода - ценнейший природный ресурс. Вода играет исключительную роль в процессах обмена веществ, составляющих основу жизни. Огромное значение вода имеет в...
-
Физико-химические свойства воды - Химия воды
Вода обладает необычными свойствами. Наибольшая ее плотность наблюдается при температуре 4°С. При охлаждении пресных водоемов зимой по мере понижения...
-
Электрофизические свойства. - Физические, химические свойства и способы получения кремния
Элементарный кремний в монокристаллической форме является непрямозонным. Ширина запрещенной зоны при комнатной температуре составляет 1,12 эВ, а при Т =...
-
Свойства жиров - Общая характеристика жиров
Животные жиры - твердые легкоплавкие вещества легче воды (плотность 0,91-0,94 г/см3), плохо проводят тепло. Большинство растительных масел - жидкости,...
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ - Растворы