Сорбция - Подготовка проб к анализу, разделение и концентрирование компонент природных вод
Сорбцию широко используют для разделения и концентрирования веществ. Сорбционные методы обычно обеспечивают хорошую селективность разделения, высокие значения коэффициентов концентрирования.
Наиболее высокие значения коэффициентов концентрирования достигаются при определении микрокомпонентов непосредственно в фазе сорбента с использованием атомно-эмиссионного, атомно-абсорбционного, атомно-флуоресцентаого и рентгенофлуоресцентного методов.
Процессом сорбции относительно легко управлять, поскольку, варьируя условия эксперимента, можно осуществить количественную сорбцию-десорбцию и контролировать этот процесс. Для осуществления сорбционных методов не требуется сложного приборного оформления, экстремальных условий, поэтому методы этой группы удобны для проведения работ в полевых условиях, их легко сочетать с методам последующего определения компонентов. Сорбционные методы отличаются высокой технологичностью и легкостью автоматизации. Можно автоматизировать не только операцию концентрирования, но и само определение, например, в хроматографических.
Механизм сорбции
Сорбция -- процесс поглощения газов, паров и растворенных веществ, твердыми или жидкими поглотителями на твердом носителе (сорбентами). Классификация сорбционных методов основана на различии механизма взаимодействия веществ с сорбентами. Различают адсорбцию (физическая адсорбция и хемосорбция), распределение веществ между двумя несмешивающимися фазами (растворитель и жидкая фаза на сорбенте) и капиллярную конденсацию -- образование жидкой фазы в порах и капиллярах твердого сорбента при поглощении паров вещества. В чистом виде каждый из перечисленных механизмов, как правило, не реализуется, и обычно наблюдаются смешанные механизмы.
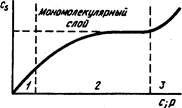
Изотерма сорбции
Область применимости: / -- уравнения Генри; 2 -- уравнения Фрейндлиха и Лэнгмюра; 3 -- уравнения Брунауэра--Эмметта--Геллера
Сорбционный процесс в статических условиях описывается уравнениями, связывающими количество сорбированного вещества с, и концентрацию вещества с в жидкой (газообразной) фазе или давление р i газообразной фазе и учитывающими химическую и геометрическую неоднородность сорбента и свойства сорбируемого вещества. Графическая зависимость с; = /(с) называется изотермой сорбции.
В области малых концентраций и при однородной поверхности сорбента справедливо уравнен" Генри:
Где а и а' -- характерные для веществ постоянные; р -- парциальное давление. В этой области концентрации сохраняется постоянство коэффициента распределения. После выхода из области Генри эмпирический коэффициент распределения становится зависимым от равновесной концентрации сорбируемого вещества, и тогда изотерма сорбции может быть описана уравнением Лэнгмюра:
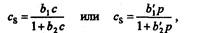
Где b1 b2, Ь11 и b'2 --постоянные.
Для описания адсорбционных процессов на неоднородных поверхностях при образовании мономолекулярного слоя применяют уравнение Фрейндлиха:
Где z, z' и n - постоянные.
Для полимолекулярных слоев действительно уравнение Брунауэра--Эмметта-- Теллера:
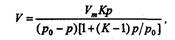
Где V -- объем газа, сорбированного при давлении р; VM -- объем газа, соответствующий мономолекулярному слою; К -- постоянная, характерная для данного вещества; р0 -- давление пара сорбируемого вещества.
При физической адсорбции взаимодействие молекул сорбирующихся веществ с поверхностью сорбента определяется главным образом дисперсионными силами, вызываемыми согласованным движением электронов в сближающихся молекулах. Такой механизм характерен для сорбции на активных углях. Для некоторых сорбентов, например, кремнеземов, оксида алюминия, цеолитов, имеют значение электростатические силы: ориентационные силы, проявляющиеся при адсорбции полярных молекул на поверхности, несущей постоянный электростатический заряд, и индукционные силы, обусловленные появлением в сорбирующихся молекулах дипольных моментов, наведенных зарядами поверхности или появлением дипольных моментов в сорбенте, наведенных диполями сорбирующихся молекул. Физическая адсорбция легко обратима.
При сорбции воды, спиртов, кетонов, аминов и других соединений на сорбентах, поверхность которых покрыта гидрокси - и оксигруппами (например, кремнезем, оксид алюминия), в дополнение 'к неспецифическим (дисперсионным и электростатическим) взаимодействиям происходит образование комплексов с межмолекулярной водородной связью. В этом случае может осуществляться смешанный механизм.
Наконец, сорбция может сопровождаться возникновением между сорбирующимся соединением и поверхностью прочной химической связи и, следовательно, образованием нового химического соединения на поверхности (хемосорбция). Такой механизм осуществляется на природных и синтетических сорбентах с ионогенными и хелатообразующими группами. В отличие от физической адсорбции хемосорбция обратима не полностью. Использование синтетических сорбентов с ионогенными и хелатообразующими группами наиболее эффективно, и их широко применяют для селективного разделения макро - и микрокомпонентов и для группового и селективного концентрирования микрокомпонентов.
При сорбции органических соединений более применимы сорбенты с химически привитой "жидкой" фазой (сорбенты с привитыми, длинными алкильными. или алкилсилильными группами). Разделение в этом случае похоже на равновесие, которое устанавливается при распределении растворенных веществ между двумя жидкими фазами (раствор -- поверхностный монослой сорбента).
Основные количественные характеристики сорбции, как и экстракции, -- коэффициент распределения и степень извлечения. Так, коэффициент распределения представляет собой отношение концентрации вещества сТв в фазе сорбента к концентрации сВ, его в водной фазе:
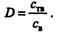
Если известны коэффициенты распределения, то можно решить вопрос о разделении веществ на данном сорбенте.
Процесс сорбции осуществляют двумя методами: статическим и динамическим. Последний положен в основу хроматографических методов разделения. В анализе используют разнообразные сорбенты: активные угли, ионообменные и хелатообразующие синтетические смолы, обычные и химически модифицированные кремнеземы и целлюлозу, сорбенты на неорганической основе.
Активные угли
Активные угли получают при действии на неактивные угли паров Н2О или СО; при 850--950 "С. При этом часть угля выгорает и получается активный уголь, пронизанный весьма тонкими порами с радиусом менее 1 нм. Поверхность покрыта главным образом оксидными группами, причем из-за неоднородности состава оксидов на поверхности физическая адсорбция может сопровождаться как катионо-, так и анионообменными процессами. Особое место занимают окисленные активные угли, являющиеся селективными полифункциональными катионообменниками. Они весьма устойчивы к химическим, термическим и радиационным воздействиям, их легко получить и регенерировать.
Активные угли используют в качестве эффективных сорбентов для извлечения свинца из атмосферного воздуха; Са, Ва и Sr из концентрированных растворов щелочей, солей и других соединений; Сг, Мо и V из воды и рассолов ртутного электролиза. Как правило, определение элементов заканчивается непосредственно в концентрате: прямым сжиганием концентрата в канале спектрального угольного электрода или концентрат облучают потоком нейтронов или определяют элементы в концентрате рентгенофлуоресцентным методом. Окончание анализа может быть другим: после разложения сорбента, содержащего сорбированные компоненты, действием азотной кислотой в полученном растворе компоненты определяют атомно-абсорбционным, спектрофотометрическим и другими методами.
Эффективность разделения и концентрирования может быть улучшена при добавлении в исследуемый раствор комплексообразующих веществ. Так, микроколличества Bi, Со, Си, Fe, In, Pb при анализе металлического серебра и нитрата таллия можно извлечь в виде устойчивых комплексов с ксиленоловым оранжевым сорбцией активным углем, помещенным в виде слоя на фильтр. Некоторые примеры концентрирования микроэлементов приведены в табл. 1. Активные угли оказались весьма эффективными для извлечения биологически активных веществ разнообразных классов из сыворотки и плазмы крови,, желчи и экстрактов различных органов.
|
Определяемый элемент |
Объект анализа |
Реагент |
Особенности Концентрирования |
Метод определения |
|
Ag, Bi, Cd, Со, Си, In, Ni, Pb, Tl, Zn |
Соли Хрома(Ш) |
Гексаметилен - дитиокарбаминат гексаме тиленаммония |
Сорбционный фильтр, десорбция HNO 3, |
Атомно-абсорбционный |
|
Cd, Co, Си, Pb |
Водные растворы солей(NaCI, MgCl; CaCI; |
Дитизон. Дифенилкарбазид 8-оксихинолин антраниловая кислота |
Сорбционный фильтр десорбция HNO3 |
Атомно-абсорбционный и атомно-эмиссионный |
|
Cd, Co, Си, Cr, Fe, Hg, Hf, Mn, Ni, Pb, Re, Zn, РЗЭ |
Природные Воды |
8-Оксихинолин |
Коэффициент Концентрирования 1-104 |
Фотометрия, Атомно-абсорбционный и ренгено-флуоресцентный, нейтронно - акгивационный и Y-активационный анализ |
|
Ag. Cd. Co. Cu, In, Ni, Pb, Tl, Zn |
Вольфрам |
Диэтилтиокарбаминат натрия |
Десорбция азотной кислотой |
Атомно-абсорбционный и ренгено-флуоресцентный анализ |
Ионообменники и хелатообразующие сорбенты на органической матрице экстрагирование ион раствор сорбент
Ионообменники. Синтетические органические ионообменники представляют собой продукты полимеризации и поликонденсации непредельных органических соединений, содержащих кислотные (-80зН, - СООН, - ОН,-РОзН; и др.) или основные (- N(СНз)з, - NHз, =NH2+ и др.) группы. Ионообменники с кислотными группами способны обменивать катионы и называются катионообменниками. Сорбенты с основными группами обменивают анионы -- это анионообменники. Приведем, например, структуры катионообменника КУ-2 (I) и анионообменника АВ-17 (II)
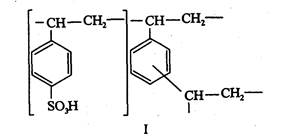
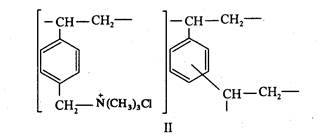
Ионообменники можно приготовить в виде мелкозернистого порошка, волокон, тканей, мембран и бумаги; известны макропористые гранулы. Иногда мелкие зерна сорбентов вносят в массу какого-либо инертного материала (так называемый наполненный сорбент) или наносят сорбент в виде тонкого слоя на поверхность шарика из другого материала.
Сорбция ионов происходит в результате их диффузии внутрь частиц смолы, а также адсорбции и электростатических взаимодействий. Таким образом, селективность сорбции ионов одного и того же заряда, возможно, будет определяться преобладающим типом сорбции. Следовательно, при доминировании электростатических взаимодействий селективно сорбироваться будут ионы, характеризующиеся высоким отношением заряда к радиусу сольватированной формы иона. При сорбции легко поляризующихся ионов ион с большим радиусом будет обладать более высокой обменной способностью. Если размеры ионов отличаются друг от друга, то разделение может основываться на различной способности проникновения ионов в структуру ионообменника.
Ионообменный процесс можно представить следующими уравнениями:
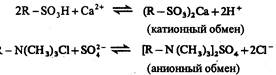
В общем виде равновесие можно написать, например, для катионного обмена
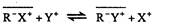
Тогда константа обмена будет иметь вид
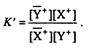
Известно несколько подходов к описанию ионообменных равновесий. Наиболее часто используются теоретические концепции, базирующиеся на применении закона действующих масс или мембранного распределения. Оба подхода к описанию ионообменного равновесия не являются строгими.
С практической точки зрения необходимо признать, что ионный обмен iне очень селективный процесс. Чаще разделение на ионообменниках проводят путем изменения форм нахождения ионов в растворе, варьируя рН раствора или вводя комплексообразующие вещества, связывающие ионы в комплексы. Например, в щелочных растворах на анионообменниках алюминий, который в этом растворе существует в виде комплекса А1(ОН)-4, можно отделить от щелочно-земельных элементов. Из солянокислых сред Ni(II), А1(Ш), Y(III), Th(IV) не сорбируются анионообменниками, поскольку они не образуют анионных хлоридных комплексов, тогда как большинство металлов сорбируется, проявляя значительные различия в величинах констант обмена.
Ионообменники применяют для сорбции микроэлементов и для поглощения матричных элементов. Их применение нередко затрудняется необходимостью иметь дело с большими объемами растворов. Однако при работе с микроколонками они достаточно широко используются во многих лабораториях для извлечения микроэлементов.
Хелатообразующне сорбенты. К ним относятся сшитые полимеры трехмерной структуры, обладающие комплексообразующими или одновременно ионообменными и комплексообразующими свойствами, обусловленными наличием функционально-аналитических групп, входящих в состав полимера. Закрепление тем или иным способом на полимерной матрице группы атомов или молекул органических реагентов, свойства которых хорошо известны, позволило получить сорбенты, обладающие повышенной селективностью.
В качестве полимерных матриц для синтеза сорбентов используют различные соединения: полимеры линейного и пространственного строения, полученные поликонденсацией и полимеризацией, природные органические полимеры, например целлюлоза и синтетические волокна.
Селективность хелатообразующих сорбентов определяется преимущественно природой хелатообразующих групп, в них содержащихся. Кроме того, селективность сорбции зависит от условий сорбции: рН раствора, концентрации и состояния соединений в растворе, присутствия комплексообразующих веществ и солевого фона. Их используют главным образом для избирательного концентрирования и разделения элементов на стадиях анализа, предшествующих собственно определению элементов различными методами. Применяются хелатообразующие сорбенты и для тонкой очистки растворов, например кислот, щелочей и солей различных металлов.
Известно много хелатообразующих сорбентов, которые могут быть использованы для избирательного концентрирования и разделения компонентов (табл. 2). Подбором сорбента с определенной хелатообразующей группой и условий сорбции можно достичь необходимой величины коэффициента распределения. Рис. 1 иллюстрирует возможность разделения Си и Ni, Си и Zn, Си и Со на иминодиацетатном сорбенте подбором рН.
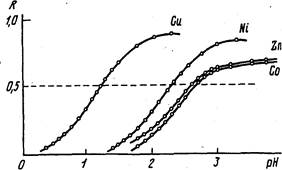
Рис. 1 Зависимость от рН степени извлечения ионов Си, Ni, Zn и Со сорбентом с иминодиацетатными группами
В качестве матрицы используют не только синтетические полимеры, но и природные, особенно целлюлозу. С использованием целлюлоз, содержащих две аминогруппы или аминогруппу и дитиокарбоновую группу, разработан метод концентрирования микроэлементов при анализе природных вод.
Для извлечения благородных металлов из производственных растворов и продуктов переработки медно-никелевых шламов широко используют так называемые полимерные гетероцепные сорбенты. Активные атомные группировки этих сорбентов -- компоненты самой матрицы; такие центры чаще входят в состав полимерных цепей в качестве гетероатомов. Например, полимерные тиоэфиры, содержащие фрагмент - СН2-S - или полимерный третичный амин с фрагментом --СН2--N--СН2--- СН2
Следует отметить, что полимерный третичный амин извлекает платиновые металлы без нагревания и введения лабилизирующих добавок типа SnCI2. Полимерные гетероцепные сорбенты применяют также для извлечения тяжелых металлов из природных вод и других объектов; определение металлов в концентрате осуществляют методами рентгенофлуоресцентной и атомно-абсорбционной спектроскопии.
Хелатообразующие органические реагенты вообще не обязательно закреплять на сорбентах химическим путем; их можно закрепить на поверхности ионообменника в виде второго слоя противоионов или механически спрессовать комплексообразующий реагент с инертной матрицей. Известно множество способов приготовления сорбентов, модифицированных комплексообразующими реагентами. Модифицированные сорбенты получены также на основе пенополиуретановых пен. Пенополиуретаны -- высокопористые материалы с высокой удельной поверхностью.
Примеры использования модифицированных сорбентов приведены в табл. 2
Таблица 2
Концентрнрование микроэлементов с помощью модифицированных сорбентов
|
Определяемые элементы |
Объект анализа |
Комплексообразующий реагент |
Матрица |
|
Hg |
Морская вода |
Дитизон, теноил-трифторацетон |
Бусины из полистирола (2%-ного дивинилбензола) |
|
Cd, Hg |
Растворы |
Диэтилдитиокарбаминат натрия |
Хромосорб |
|
Сг, Си, Fe, Pb, Ni, Zn |
" |
Диметилглиоксим, 8-оксихинолин, двуза-мещенный фосфат натрия, щелочи |
Анионообменники АВ-17иАВ-18в ОН'- форме |
|
Cd, Cu, Hg, Mn, Zn |
" |
1-(2-Пиридилазо)-2-нафтол, трикрезил фосфат |
Мембрана из поливинилхлорида |
|
Платиновые металлы |
Отходы производства плати новых металлов |
Тионалид |
Бумага |
|
Hg |
Растворы |
Дитизон |
Полиуретановые пены |
|
Au |
Растворы |
Трибутилфосфат, Тиомочевина |
Полиуретановые пены |
|
Co, Fe, Mn |
" |
1-(2-Пиридилазо)-2-нафтол |
" |
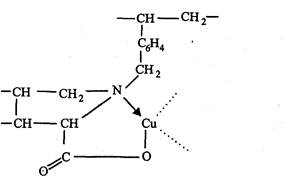
Сравнительно недавно стали применять закомплексованные формы хелатообразующих сорбентов для разделения лигандов. Вследствие стерических препятствий внутренняя координационная сфера иона металла при взаимодействии с хелатообразующими группами сорбента не заполняется полностью донорными атомами этих групп. Свободные координационные места иона металла могут заполняться молекулами растворителя или другими, находящимися в растворе лигандами, которые могут легко обмениваться на различные лиганды.
Селективность лигандного обмена ярко проявляется в распознавании оптически активных лигандов, например оптических изомеров аминокислот. Так, оптически активный сорбент с привитым Z-пролином, обработанный раствором сульфата меди, в результате чего образуется полимер следующей структуры: проявляет высокое сродство к D-изомерам аминокислот, тогда как Z-изомеры легко смываются водой
Кремнеземы и химически модифицированные кремнеземы
Кремнезем -- это диоксид кремния во всех его формах: кристаллический, аморфный или гидратированный. Наиболее универсальны аморфные пористые кремнеземы, так как их структурные характеристики (величина поверхности, диаметр и объем пор, размер частиц и их прочность) можно изменять в широком интервале. Аморфный кремнезем имеет следующие разновидности: аэросилы -- безводные, аморфные частицы кремнезема, получаемые при высокой температуре; аэросилогели (силохромы) -- очень чистая и геометрически однородная форма пористого аморфного кремнезема с удельной поверхностью 70--150 м2 / г; силикагели -- сухие гели поликремниевой кислоты (одна из самых важных разновидностей аморфного кремнезема, выпускаемая промышленностью); пористые стекла -- особая форма аморфного кремнезема.
Механизм ионного обмена на кремнеземах, т. е. замещение протонов поверхностных ?Si-OH-групп на катионы, доказан достаточно надежно. Однако сродство ионов металлов к поверхности кремнезема может определяться наряду с электростатическими силами также и некоторым дополнительным донорно-акцепторным взаимодействием. Рассматривая с этих позиций причины различной сорбируемости ионов на поверхности кремнеземов, следовало ожидать, что при прочих равных условиях наибольшее сродство будут проявлять ионы, у которых связь Me'N+-'-O-Si ? в поверхностных группах имеет частично ковалентный характер. Следует отметить, что катионозамещенные формы кремнеземов, полученные обработкой растворами соответствующих гидроксидов, применяют достаточно часто, поскольку они обнаруживают высокую сорбционную емкость и избирательность по сравнению с кремнеземами в Н-форме.
На кремнеземах разделяют близкие по химическим свойствам элементы, например цирконий и гафний. Вследствие большого радиуса и меньшего ионного потенциала гафния его комплексообразующая способность выражена слабее. Это способствует тому, что гафний из 10 М НС1 сорбируется в вице нейтральных комплексов, тогда как цирконий находится в основном в виде анионных комплексов и его сорбция протекает в значительно меньшей степени.
Высокая радиационная устойчивость кремнеземов позволяет длительное время использовать их в жестких радиационных условиях для извлечения и концентрирования радиоактивных элементов из отходов радиохимических производств, разделения и получения чистых нуклидов, например И Zr и 9i Nb, а также для получения индивидуальных форм в разных степенях окисления, например Pa(IV) и Pa(V), Pu(IV)
И Pu(VI),HT. n.
Кремнеземы используют для поглощения органических примесей из воздуха; они довольно активно сорбируют полярные молекулы из водных растворов.
Кремнеземы с химически привитыми молекулами органических соединений (ХМК) широко применяют в аналитической химии, биохимии. Укажем некоторые достоинства ХМК: высокая скорость установления сорбционного равновесия (что объясняется жесткостью каркаса и малой толщиной привитого слоя), механическая прочность и ненабухаемость частиц (это позволяет значительно уменьшить время отбора пробы); легкость и полнота десорбции сорбированных компонентов небольшими объемами растворителей.
Наиболее подробно изучены и широко используются на практике кремнеземы с привитыми алкильными группами. Какие же алкильные группы закрепляются на поверхности кремнеземов? Наиболее применимы кремнеземы с длинными алкильными цепями, обычно C8 и C12. В последнее время растет популярность кремнеземов с привитыми более короткими алкильными группами €4 и С3, особенно на широкопористых кремнеземах, используемых для анализа биологически важных высокомолекулярных соединений. Кремнеземы с привитыми арильными группами применяют реже, хотя они часто обладают более высокой селективностью, чем кремнеземы с алкильными группами.
Механизм сорбции на кремнеземах с привитыми алкильными группами сложен, в основном известны три вида взаимодействия: адсорбция сорбирующихся молекул на внешней поверхности привитого слоя, абсорбция молекул привитым слоем и взаимодействием сорбированных молекул с остаточными силанольными группами поверхности.
Взаимодействие ионов с поверхностью ХМК, содержащих ионогенные и комплексообразующие группы, осуществляется главным образом по механизму ионного обмена и комплексообразования.
Области использования ХМК многообразны. Уже в 1971 г. кремнезем с привитыми октадецильными группами был применен для отбора паров органических веществ из воздуха. С помощью ХМК проводят очистку воздуха от промышленных органических загрязнений, конценгрирование микропримесей органических веществ с целью последующего анализа загрязнений воздушного бассейна.
Кремнеземы с привитыми алкильными группами используют для концентрирования органических соединений из морской и пресной воды. Несмачиваемость кремнеземов с привитыми алкильными группами и, следовательно, их плавучесть определяет применение таких сорбентов для дифференцированного отбора проб из поверхностной пленки водоемов. Так, с помощью силохрома С-80, модифицированного гексадецилтрихлорсиланом, изучен состав пленок нефтепродуктов в Японском море. Проведенные эксперименты свидетельствуют о том, что ХМК с привитыми алкильными группами могут быть с успехом применены для концентрирования пленок органических веществ с поверхности моря, а работа с ХМК гораздо менее трудоемка, чем метод экстракции.
Кремнеземы с привитыми алкильными группами оказались весьма эффективными и для извлечения разнообразных классов биологически активных веществ из сыворотки и плазмы крови, мочи, желчи и экстрактов различных органов. Их используют также для концентрирования стероидов, пептидов, некоторых витаминов, нуклеотидов, простагландинов, сахаров, ряда метаболитов и лекарственных препаратов.
Для извлечения ионов металлов из растворов используют преимущественно ХМК с комплексообразующими группами. Эффективны сорбенты с привитыми группами иминодиуксусной, этилендиаминтриуксусной и гидроксамовых кислот, а также сорбенты с привитыми моно - и полиаминными группами и такими органическими реагентами, как неокупроин, 1,10-фенантролин, диэтилдитиокарбаминат, формазаны и др. Платиновые металлы Ра(П), Pt(IV), Ru(IV), 1т(Ш) и золото с высокой эффективностью сорбируются из разбавленных соляно-кислых растворов с помощью ХМК, содержащих моно - и полиаминные группы.
Кремнеземы с привитыми комплексообразующими группами применяют для извлечения ионов металлов из морской воды. Например, этилендиаминовым и ими-нодиацетатным сорбентами осуществлено селективное извлечение урана из морской воды и групповое извлечение Сu(П), Zn(П), Ni(II) и Со (П).
Похожие статьи
-
Экстрагируемый Ион Ионы, от которых отделяют Водная фаза Экстрагент 8-оксихинолин хлороформ Метилизобутилкетон и др. Диметилглиоксим, КОН хлороформ и др....
-
Методика отбора и хранения проб Отбор и хранение проб производилось согласно ГОСТ Р 51592-2000 "Общие требования к отбору проб".[35,36] Пробы воды в...
-
Радиоактивность природных вод В питьевом водоснабжении преимущественно используются поверхностные воды из рек, озер, водохранилищ, а также грунтовые воды...
-
Концентрирование микроэлементов - Природные воды. Классификация примесей
При выборе методов анализа вод различного состава необходимо принимать во внимание приведенные выше данные об элементном составе природных, питьевых и...
-
Отбор пробы воды следует рассматривать как стадию, в значительной степени определяющую правильность последующего анализа, причем ошибки, допущенные в...
-
По существу морская вода является хлоридно-сульфатно-натриево-магниевым раствором, в котором в виде следов и примесей находятся все остальные химические...
-
Проба брал на ГПУ г. Москвы "Природный заказника "Воробъевы горы"из реки Москва, с помощью стеклянной бутыли. Затем стеклянную бутыль опускал в реку и...
-
Основным источником поступления ИРН в моря и океаны являются атмосферные выпадения (глобальные и локальные) на их поверхность, а также жидкие стоки...
-
Выпаривание пробы воды производится при температуре не более 90-950С на специальной установке, состоящей из электроплитки, песчаной бани, на которую...
-
1. Сушильный шкаф 2. Весы 3. Колонка сит 4. Ступки и пестики 5. Нож, ножницы 6. Металлические или картонные противни 7. Набор счетных геометрий:...
-
Цель работы: освоение методик подготовки проб почвы и растительности, подготовка проб почвы и растительности для инструментального...
-
Физическая сущность методики В связи с отсутствием у нейтронов электрического заряда они проходят в веществе без взаимодействий сравнительно большие...
-
Газовая хроматография - Основы качественного анализа
Этот метод представляет собой замечательное сочетание методов разделения и количественного анализа, поддающееся полной автоматизации. Смесь газов или...
-
Общая схема исследования: 1. Составление среднего образца. 2. Извлечение пестицидов из пробы. 3. Очистка экстракта. 4. Анализ экстракта. Прием образцов в...
-
- Ядерная энергетика; - Археология; - Нефтехимия; - Геохимия (изотопная геохронология); - Агрохимия; - Химическая промышленность; - Анализ...
-
Цель работы: освоение методик подготовки проб воды и атмосферных осадков, подготовка воды и атмосферных для инструментального гамма-спектрометрического...
-
Космогенные радионуклиды поступают в моря и океаны в основном из атмосферы и литосферы, частично могут образовываться в самой водной среде. Их среднее...
-
Метод Е. Грусц-Харди - изолирование смесью спирта и хлороформа Схематично метод можно представить из следующих этапов: * Настаивание измельченного с...
-
АНАЛИТИКА Компиляция выдержек из различных источников - удельная б-активность U235 и U238 составляет соответственно 0,08 и 0,012 Бк/мкг (или 80 и 12...
-
Наиболее представительные ионы и соответствующие им структуры помещены в таблицы, их используют при интерпретации масс-спектров. Кроме того сравнивают...
-
Обычно, для различных интервалов энергий используют разные типы установок, которые предназначены для измерения спектров нейтронов методом времени...
-
Особенности анализа органических соединений
Особенности анализа органических соединений: - Реакции с органическими веществами протекают медленно с образованием промежуточных продуктов. -...
-
Рентгенофазовый анализ (РФА), Общие сведения - Основы качественного анализа
Общие сведения Из множества физических и физико-химических методов анализа в нашем практикуме используется лишь один, наиболее важный для химии и физики...
-
МЕТОДЫ СРАВНИТЕЛЬНОГО ШКАЛИРОВАНИЯ - Многомерный статистический анализ
Шкалирование методом попарного сравнения - Это метод сравнительного шкалирования, при котором респонденту дается два объекта для выбора по определенному...
-
Ввод образца был одной из первых проблем в масс-спектрометрии. Для проведения анализа масс образца, который первоначально находится при атмосферном...
-
Попытаемся дать общее представление о свойствах и применении адсорбентов на примере весьма распространенных углеродных материалов. Углеродные адсорбенты...
-
Однородные (гомогенные) смеси - это смеси, в которых компоненты смешаны на молекулярном уровне (однофазный материал); их невозможно обнаружить при...
-
Количественный анализ - это совокупность, химических, физико-химических и физических методов определения количественного соотношения компонентов,...
-
Кремний - элемент главной подгруппы четвертой группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14....
-
Адсорбционные методы исследования свойств поверхности позволяют количественно охарактеризовать происходящие при адсорбции межмолекулярные взаимодействия,...
-
Адсорбционные явления чрезвычайно широко распространены в живой и неживой природе. Толщи горных пород и почвы являются огромными колоннами с...
-
Подготовка к работе - Основы качественного анализа
Выданное количество вещества гораздо больше нужного для анализа. Поэтому ни в коем случае не следует расходовать все. Нужно оставить запас для проверки в...
-
Средства для окраски волос - Химия в косметике
В быту в качестве дезинфицирующего и отбеливающего средства широко используют растворы (3, 6, 10 %-ные) пероксида водорода. Более концентрированный --...
-
Введение - Нейтрон-спектрометрический анализ изотопного состава обогащенных проб гафния
Измерения ядерных материалов (ЯМ) различными методами, является одним из необходимых направлений совершенствования, для решения ряда задач, таких как,...
-
Подготовка угля к коксованию - Анализ и технологическая оценка химического производства
Коксование-- Процесс сухой перегонки каменных углей при их нагревании до 900--1050° С без доступа воздуха. В результате сложных физических и химических...
-
Задание 1 - Анализ отобранных проб жидкости и газа
По данным таблицы 1.3. рассчитать значения коэффициентов: А=С2/С4; i-C4/n-C4; В=(C1+ГУ)/ПУ; Z=А+В и спрогнозировать месторождение (залежь) какого типа...
-
Общие вопросы Привести объекты судебно-химического (химико-токсикологического) анализа. Дать понятие "вещественным доказательствам". Значение наружного...
-
Заключение - Нейтрон-спектрометрический анализ изотопного состава обогащенных проб гафния
За время выполнения дипломной работы, были получены знания о НСА и методах обработки спектров пропускания, приобретены навыки работы с программами...
-
Особенности обработки Погрешность данного метода вызвана: длительностью вспышки (0.5мкс), временем срабатывания анализатора (0.7мкс) и шириной канала...
-
Позволяет определить погрешность полученной площади и окончательного содержания. Также использовались и другие программы: Otno - Программа используемая...
Сорбция - Подготовка проб к анализу, разделение и концентрирование компонент природных вод