"Катализ. Гомогенный и гетерогенный катализ" - Гомогенный и гетерогенный катализ
В 1835 году Берцелиус впервые использовал термин "катализатор" для обозначения "веществ, которые способны пробудить сродство, дремлющее при данной температуре, одним лишь своим присутствием, а не в силу своего собственного сродства". Он не мог определить природу "каталитической силы" и удовлетворился указанием на то, что она представляет собой особое проявление обычных электрохимических свойств вещества. В 1895 г. Оствальд определил катализаторы как "вещества, изменяющие скорость реакции, но не влияющие на ее энергетические характеристики". Позднее он дал еще одно определение, в котором указание на кинетический аспект каталитического процесса прозвучало в более явном виде: "Катализатор есть вещество, которое изменяет скорость химической реакции, но не входит в состав конечного продукта реакции".
В каждом из этих качественных определений катализ связывается с такими понятиями, как скорость и стехиометрия, которые поддаются количественной оценке. Действительно, эти две очень важные характеристики химического превращения можно выразить математически. Простая некатализируемая реакция протекает в соответствии с уравнением:
Скорость некатализируемой реакции Vн определяется по формуле:
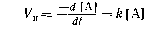
Где А - реагирующее вещество, [А] - концентрация реагирующего вещества, t - время, k - константа скорости реакции.
Согласно приведенным выше опеределениям катализа, при протекании той же самой реакции в присутствии катализатора C последний входит как в правую, так и в левую части уравнения ре акции.
Кроме того, поскольку катализатор увеличивает скорость реакции, выражение для скорости катализируемой реакции должно включать концентрацию катализатора.
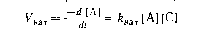
Катализ - это изменение скорости химической реакции в присутсвии веществ, которые после завершения реакции в неизменном виде и количестве.
Ингибитор - вещества вызывающие отрицательный катализ
Гомогенный катализ - катализатор и реакционная смесь находятся в одной фазе. Скорость пропорциональна количеству катализатора(омыление сложных эфиров) H2О2 + I > H2О + IO; H2О2 + IO > H2О + О2 + I В гомогенном каталитических реакциях скорость пропорциональна числу катализатора, хотя его количество в системе невелико. Гомогенный катализ в растворах и биологических средах может вызываться ионами водорода (кислотный катализ) и гидроксида (основный катализ).
Гетерогенный катализ - катализатор обычно твердый, а реакция протекает на его поверхности. Скорость зависит от площади и состояния катализатора, т. к. реакция проходит на активных центрах(водный раствор пероксида водорода взаимодействует с оксидом марганца 4).При гетерогенном катализе скорость реакции сильно зависит от площади и состояния поверхности катализатора, так как реакция происходит не на всей поверхности, а только на ее активных центрах.
В гомогенных каталитических реакциях скорость пропорциональная кол-ву катализатора, хотя его кол-во в системе не велико.
При гетерогенном катализе скорость реакции зависит от площади и состоянии поверхности катализатора, т. к. реакция происходит не на всей поверхности, а только на ее активных центрах
Энергетический профиль каталитической реакции - это зависимость координаты реакции (насколько прошла реакция) от времени (при постоянном количестве катализатора) или от количества катализатора.
Обычно энергетический профиль пути реакции ( координата реакции) строится для стандартной температуры ( 298 К), минимально сложного состава окружающей среды ( раствора) и в отсутствии посторонних электрических, магнитных и электромагнитных полей; реакция проводится в темновых условиях, а не на свету.
Каталитическая активность ферментов - это способность ферментов увеличивать вероятность реакции, которую они обеспечивают.
Данная тема актуальна и интересна, так как связана с процессами, происходящими в человеческом организме.
Похожие статьи
-
Гомогенный и гетерогенный катализ. Механизм действия катализатора - Основы химии
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газовая смесь или раствор). При гетерогенном катализе катализатор и...
-
Энергетический профиль каталитической реакции - Гомогенный и гетерогенный катализ
Энергетический профиль реакции - это кривая, которая показывает зависимость координаты реакции (насколько прошла реакция) от времени (при постоянном...
-
Катализ - Концепции современного естествознания: химическая составляющая
Наиболее сильное влияние на скорость реакции оказывает присутствие в реагирующей системе Катализатора -- вещества, которое повышает (а иногда и уменьшает...
-
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Катализаторы - вещества,...
-
Гетерогенный катализ - Гомогенный и гетерогенный катализ
Механизм гетерогенного катализа включает пять стадий, причем все они обратимы. 1. Диффузия реагирующих веществ к поверхности твердого вещества. 2....
-
Катализ, Разновидности катализа:, Принципы катализа: - Гомогенный и гетерогенный катализ
Явление катализа - Это изменение скорости реакции под действием некоторых веществ, которые к концу реакции остаются в химически неизменном виде....
-
ВИДНЫЕ ДЕЯТЕЛИ ХИМИИ О КАТАЛИЗЕ - Процесс катализа
И. Берцелиус (1837): "Известные вещества оказывают при соприкосновении с другими веществами такое влияние на последние, что возникает химическое...
-
Гомогенный катализ - Гомогенный и гетерогенный катализ
Среди многочисленных каталитических реакций особое место занимает катализ в цепных реакциях. "Цепными реакциями, как известно, называются такие...
-
Высокая каталитическая эффективность. Отличительной особенностью любого фермента является его чрезвычайно высокая каталитическая эффективность. Так,...
-
ГОМОГЕННЫЙ КАТАЛИЗ - Процесс катализа
Среди многочисленных каталитических реакций особое место занимает катализ в цепных реакциях. "Цепными реакциями, как известно, называются такие...
-
КАТАЛИЗ В БИОХИМИИ - Процесс катализа
Ферментативный катализ неразрывно связан с жизнедеятельностью организмов растительного и животного мира. Многие жизненно важные химические реакции,...
-
РОЛЬ КАТАЛИЗА В ЭКОЛОГИИ - Процесс катализа
Огромную роль призван сыграть катализ в решении актуальнейшей проблемы - охраны окружающей среды. По словам Кусто, земной шар напоминает "одиноко...
-
НЕМНОГО О ПРОМЫШЛЕННОМ КАТАЛИЗЕ - Процесс катализа
На всю жизнь запомнилась мне проводившаяся по Энглеру разгонка полученного конденсата, в котором уже в начале опыта бензиновая фракция составляла 67%. Мы...
-
Гомогенное и гетерогенное горение - Принципы горения и взрыва
Горением называется сложный физико-химический процесс взаимодействия горючего вещества и окислителя, характеризующийся самоускоряющимся превращением и...
-
ГЕТЕРОГЕННЫЙ КАТАЛИЗ - Процесс катализа
К сожалению, до сих пор, несмотря на достаточно большое число теорий и гипотез в области катализа, многие основополагающие открытия были сделаны случайно...
-
ПРОХОЖДЕНИЕ ЧЕРЕЗ ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР - Процесс катализа
Закон Аррениуса - экспериментально установленный факт. Он утверждает, что скорость реакции возрастает с увеличением температуры для преобладающего...
-
Уравнение Михаэлиса-Ментен и его анализ - Гомогенный и гетерогенный катализ
Уравнемние Михаэмлиса -- Мемнтен -- основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от...
-
ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР - Процесс катализа
Все каталитические реакции - самопроизвольный процесс, т. е. протекают в направлении убыли энергии Гиббса - убыли энергии системы. Давно уже было...
-
Пиролиз в присутствии гомогенных инициаторов - Пиролиз углеводородного сырья
Широкое применение получили различные добавки и инициаторы способные инициировать процесс пиролиза, а также ингибировать нежелательные процессы. В...
-
Кинетика и катализ, Теоретические основы термического пиролиза - Пиролиз углеводородного сырья
Теоретические основы термического пиролиза Термическое разложение углеводородов представляет собой сложный процесс, который можно представить как ряд...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
К-изменение скорости хим. р-ции, под действием особых ве-в-катализаторов, кот. участвуют в ходе р-ции, но к концу ее остаются в неизменном кол-ве. Виды:...
-
Кинетика химических реакций - Концепции современного естествознания: химическая составляющая
Одна из особенностей химических реакций заключается в том, что они протекают во времени. Одни реакции протекают медленно, месяцами, как, например,...
-
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1: 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите...
-
Общее понятие о цепных реакциях и автокатализе - Принципы горения и взрыва
К цепным реакциям относят реакции, протекающие с образованием свободных радикалов, способных превращать реагенты в конечные продукты, поддерживая...
-
К настоящему времени единственным освоенным и широко распространенным в промышленности методом пиролиза является термический пиролиз в трубчатых печах....
-
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - Неограническая химия
Задание 3.1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте...
-
Задачи и методы качественного анализа - Основы аналитической химии
Обнаружение или, как иногда говорят, "открытие" отдельных элементов или ионов, входящих в состав веществ - это задачи качественного анализа. Качественный...
-
Адсорбционные методы исследования свойств поверхности позволяют количественно охарактеризовать происходящие при адсорбции межмолекулярные взаимодействия,...
-
Все аминокислоты, из которых состоят белки, являются" L-а-амино - (или имино-) кислотами. Они находят применение как пищевые добавки, приправы, усилители...
-
Теплота сгорания горючих веществ - Принципы горения и взрыва
Горючее, имеющее в своем составе водород, при сгорании образует воду в газообразном состоянии, которая, охлаждаясь, будет конденсироваться. Так как в...
-
Электролиз - физико-химический процесс, состоящий в выделении на Электродах составных частей растворенных веществ или других веществ, который возникает...
-
Задание и исходные данные Необходимо рассчитать насадочную ректификационную колонну для разделения бинарной смеси диоксан - толуол. GD=1000 кг/ч, xF=45%...
-
Методы неорганического синтеза - Синтез ацетата натрия ("Горячий лед")
НЕОРГАНИЧЕСКИЙ СИНТЕЗ, получение неорганических соединений. Как правило, состоит из нескольких последовательных или параллельных процессов -...
-
Кинетика электродных процессов. Электродным процессом называется сумма всех изменений, происходящих во времени на поверхности электрода при потенциале,...
-
При использовании разомкнутых химико-технологических систем в большинстве случаев принципиально невозможно проведение процессов при практически полной...
-
ОСНОВЫ ЭЛЕКТРОХИМИИ - Неограническая химия
Задание 6.1. В данной (табл. VI.1) окислительно-восстановительной реакции уравняйте стехиометрические коэффициенты ионно-электронным методом и...
-
Химия в системе наук - Основы естественно-научных знаний
Химия - наука о веществах, их свойствах, строении и взаимных превращениях. Под веществом понимается любая совокупность атомов и молекул. Традиционная...
-
Аналитический обзор - Выпаривание раствора хлорида калия
Устройство выпарных аппаратов. Разнообразные конструкции выпарных аппаратов применяемых в промышленности, можно классифицировать по типу поверхности...
-
Зарождение современной химии, Теория флогистона и система Лавуазье - Химия сегодня
Представления древнегреческих натурфилософов оставались основными идейными истоками естествознания вплоть до XVIII в. До начала эпохи Возрождения в науке...
"Катализ. Гомогенный и гетерогенный катализ" - Гомогенный и гетерогенный катализ