Основные расчетные формулы, Стандартные термодинамические величины - Взвешенная плавка никелевого концентрата
Плавка расчет взвешенный никелевый
При заданной температуре:
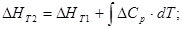
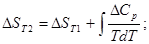
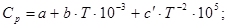
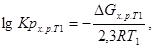
где R=8,314.
Для химической реакции:
;
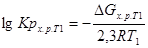
, где R=8,314.
Расчет lgKp по методу Темкина-Шварцмана:
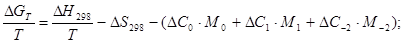
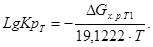
Расчет LgKp по методу Владимирова.
Точному:
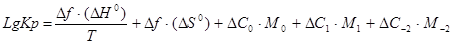
.
Расчет lgKp по приближенному методу Владимирова:
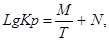
Где
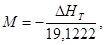
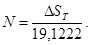
Формулы для самостоятельных (верных) расчетов:
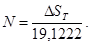
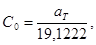
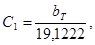
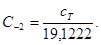
Стандартные термодинамические величины
Для реакции СоО+Fe = Feo+Со составим таблицу 1, в которую занесем основные термодинамические величины, необходимые для расчета.
Таблица 1. Стандартные термодинамические величины
|
Вещество | 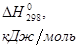 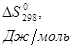
Коэффициенты уравнения | |||||
|
СоО |
-238,910 |
52,93 |
42,28 |
8,540 |
1,670 |
- |
|
Fe |
----------- |
27.15 |
17.24 |
24.77 |
------------ |
298-700 |
|
FeO |
-264.85 |
60.75 |
50.80 |
8.61 |
-3.31 |
298-1650 |
|
Со |
----------- |
29.87 |
16.99 |
29.46 |
----------- |
298-700 |
3. Приближенный расчет по методу Крестовникова А. Н.
Проведем расчеты при Т=2980К для химической реакции
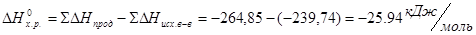
Проведем расчеты при Т=2980К для химической реакции
Проведем расчеты при Т=2980К для химической реакции
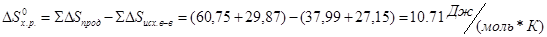
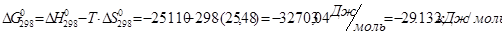
Проведем расчеты lgKp при Т=2980К для химической реакции
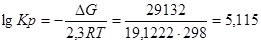
;
Где
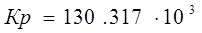
Проведем расчеты Ср при Т=5000К:
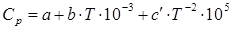
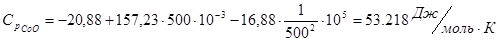
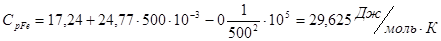
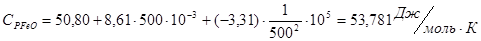
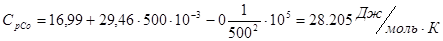
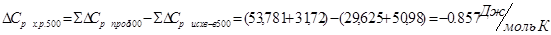
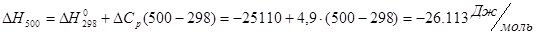
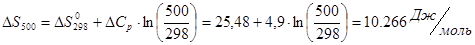
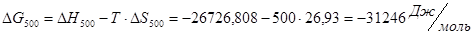
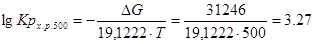
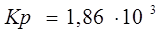
Где.
Аналогично проводим расчеты для остальных температур, результаты расчетов теплоемкости заносим в таблицу 2, а результаты расчетов энтальпии, энтропии, энергии Гиббса, логарифма константы равновесия заносим в таблицу 3.
Значения теплоемкости для реакции СоО+Fe=Feo+Со в заданном интервале температур
Таблица 2
|
Т, 0К |
СрСоО |
Cp FeO |
CpFe |
CpCo |
?Cpх. р. |
|
Дж/(моль*К) | |||||
|
298 |
-0,232 | ||||
|
500 |
53,218 |
53,781 |
29,625 |
28,205 | |
|
700 |
54,599 |
56,151 |
34,579 |
37,2 | |
|
900 |
56,172 |
58,140 |
39,533 |
34,905 | |
|
1100 |
57,812 |
59,997 |
44,487 |
38,255 | |
|
1300 |
59,481 |
61,797 |
49,441 |
41,605 | |
|
1500 |
61,164 |
63,568 |
54,395 |
44,955 | |
|
1700 |
62,856 |
65,322 |
59,349 |
48,305 | |
|
1900 |
64,552 |
67,067 |
64,303 |
51,655 |
Таблица 3
Значения термодинамических величин для реакции СоО+Fe = Feo+Со
|
Т, 0К | 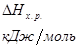 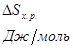 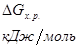
LgKp |
Kp | |||
|
298 |
130,317 103 | ||||
|
500 |
-26,113 |
-31,246 |
4,2 |
1,86 103 | |
|
700 |
-26,531 |
9,453 |
-33,149 |
2,478 |
300,6 |
|
900 |
-27,541 |
7,77 |
-34,534 |
2 |
100 |
|
1100 |
-29,186 |
5,425 |
-35,153 |
1,672 |
46,989 |
|
1300 |
-31,471 |
2,579 |
-34,824 |
1,4 |
25,119 |
|
1500 |
-34,397 |
-0,661 |
-33,406 |
1,165 |
14,622 |
|
1700 |
-37,966 |
-4,227 |
-30,780 |
0,947 |
8,851 |
|
1900 |
-42,141 |
-8,426 |
-26,132 |
0,72 |
5,248 |
По полученным данным строим графики зависимостей: ?Н, ?S, ?G, Кр, ?Ср как функций от температуры и зависимость LgKp как функции от обратной температуры 1/Т.
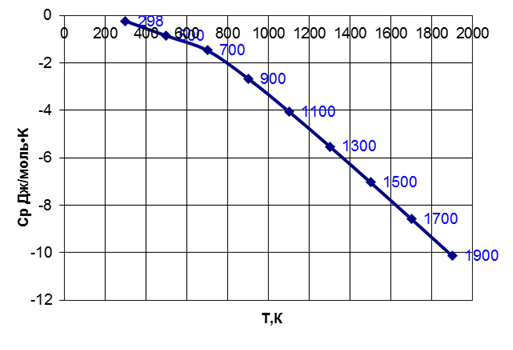
Рис. 1 Зависимость теплоемкости от температуры
Рассмотрим график зависимости СР от температуры. Видно, что с увеличением температуры СР уменьшается. Энтальпия уменьшается тем быстрее, чем выше температура. Что подтверждается соответствующим графиком и термодинамическими расчетами.
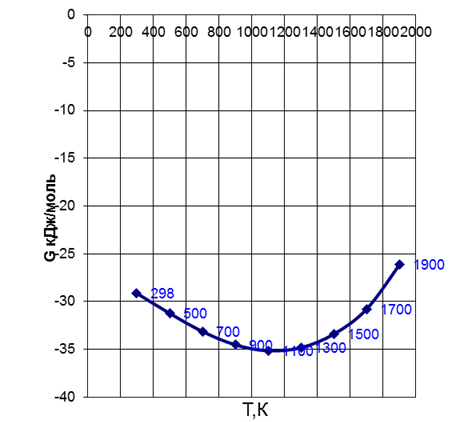
Рис. 2 Зависимость энергии Гиббса от температуры
Анализируя, зависимость ?G от температуры, определяем, что ?G для реакции СоО+Fe=Feo+Со повышается с ростом температуры, так как основное влияние оказывает величина Т-?S, уменьшающаяся с ростом температуры.
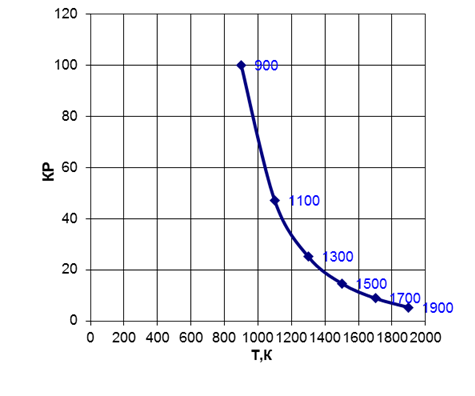
Рис. 3 Зависимость константы равновесия от температуры
Константа равновесия уменьшается с увеличением температуры, так как реакция СоО+Fe = Feo+Со экзотермическая.
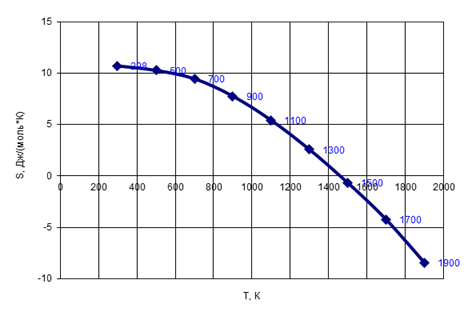
Рис. 4 Зависимость энтропии от температуры
Энтропия убывает, следовательно, система переходит из менее упорядоченного состояния в более упорядоченное.
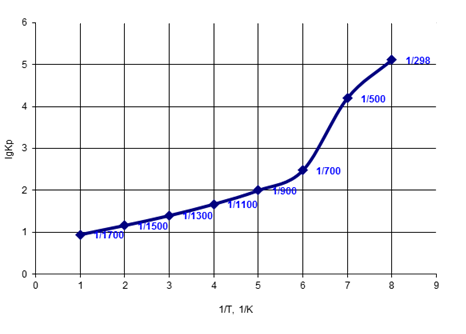
Рис. 5 Зависимость логарифма константы равновесия от обратной температуры
Рассмотрим график зависимости LgKр от 1/T. С увеличением обратной температуры LgKр увеличивается. Это означает что в интервале температур от 298 до 1500К Кр>1, следовательно равновесие реакции сместится в сторону продуктов реакции, т. е. реакция будет протекать в прямом направлении.
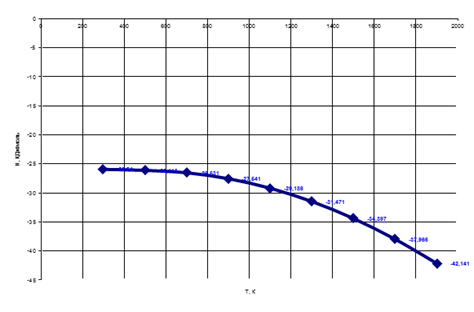
Рис. 6 Зависимость энтальпии от температуры
Энтальпия с повышением температуры убывает, так как СоO+Fe=FeО+Со экзотермическая реакция.
Похожие статьи
-
Воспользуемся рассчитанными данными из таблицы 3. Рассчитаем теперь lgKp для рабочей температуры (Траб=15000К) Процесс (рафинировочная плавка меди), при...
-
Вывод - Взвешенная плавка никелевого концентрата
Рассмотрим график зависимости ?Н от температуры. Видно, что с увеличением температуры энтальпия уменьшается, следовательно, реакция экзотермическая,...
-
Для этого необходимо составить таблицу со справочными данными: Таблица 5. Справочные данные для lgKp по методу Л. П. Владимирова Реагент N LgKp СоО...
-
Введение - Взвешенная плавка никелевого концентрата
При химических реакциях изменяется состояние электронов в атомах и молекулах реагирующих веществ, разрываются старые химические связи и возникают новые,...
-
Плавка стали в основной дуговой электропечи. - Производство стали
Сырые материалы. Основным материалом для электроплавки является стальной лом. Лом не должен быть сильно окисленным, так как наличие большого количества...
-
Технологическая схема зависит от вида и характера, вида и качества исходных материалов, от уровня развития техники (рис.1.). Рисунок 1- Технологическая...
-
Задача светотехнического расчета определить потребляемую мощность источников света для обеспечения нормированной освещенности. В результате прямого...
-
Как было отмечено, процесс окисления протекает многостадийно, поэтому некоторыми авторами [4, 7-11] кислотное число принимается за основной показатель,...
-
Переход экономики на рыночные условия хозяйствования ставит предприятия перед необходимостью контролировать степень использования средств труда,...
-
Законы распределения случайной величины - Оптимизация стратегии технического обслуживания и ремонта
Результаты оценки вида закона распределения времени безотказной работы, полученные при использовании статистических данных о надежности приборов контроля...
-
Расчет и подбор компрессора Холодильный компрессор - агрегат, отвечающий за сжатие и перекачку паров хладагента используется в промышленности и в...
-
Одним из основных элементов манипулятора является привод. В условиях повышенных требований к вакуумной гигиене широкое применение в качестве приводов...
-
Технология производства. В настоящее время азот на химических комбинатах добывают из атмосферного воздуха его разделением на фракции в специальных...
-
ПОСТРОЕНИЕ НОМОГРАММ ОТДЕЛЬНЫХ ЗАВИСИМОСТЕЙ - Расчет оптимального режима резания
Формулы, используемые для расчета режима резания, могут быть выражены графически, в виде номограмм, что в ряде случаев значительно упрощает расчет....
-
Барабаны диаметром меньше 100 мм исключают из дальнейших расчетов, т. к. наименьший из выходных валов редукторов с частью зубчатой полумуфты,...
-
Расчет безотказности - Вычисление основных количественных показателей безотказности
Для выполнения расчетов целесообразно продолжить заполнение таблицы 1, добавив столбцы промежуточных значений и значений искомых показателей. Для расчета...
-
Термогравиметрия (ТГ) или термогравиметрический анализ (ТГА) - один из основных методов в термическом анализе. Прибор для ТГ - термовесы построен на...
-
Режим динамического торможения при реактивном характере нагрузке производственного механизма (участок 89 - рисунок 6) от до 0. RДв. гор+ RДТ= 2,33Ом; С....
-
- Первая промежуточная ступень: Rя. пр1=3,83 Ом; с; Н-м; МКон. фикт = МС1 = 68,93 Н-м. При расчете переходного процесса М=f(t) для первой промежуточной...
-
Данные для построения: NМ1 =-35 об/мин - частота вращения в 1 рабочей точке; T1 = 20 с - время работы в 1 точке; NМ2 = 95 об/мин - частота вращения в 2...
-
Введение - Вычисление основных количественных показателей безотказности
Термины и определения, используемые в теории надежности, регламентированы ГОСТ 27.002-89 "Надежность в технике. Термины и определения". Надежность -...
-
Обзор методов и средств поверки манометров пружинных образцовых типа МО Манометров пружинных образцовых типа МО предназначены для проверки в лабораторных...
-
Фальсификация мука масло качественный Идентификация товара и ее методы Идентификация, как правило, требует многосторонних исследований как опытными...
-
Метрология (от греч. "metron" - мера, "logos" - учение) - наука об измерениях, методах и средствах обеспечения их единства и способах достижения...
-
По зависимости абсолютной погрешности от значений измеряемой величины различают погрешности (рис. 3.1): - аддитивные, не зависящие от измеряемой...
-
Пластмассы. Основные характеристики пластмасс - Пластмассы. Их свойства и области применения
Пластические массы (пластмассы, пластики) -- материалы на основе природных или синтетических полимеров, способные под влиянием нагревания и давления...
-
Механические и другие параметры блоков питания TFX12V - Импульсные источники питания
Габаритные размеры блока питания должны составлять 175х80х75 мм. Конфигурация корпуса и расположение крепежных элементов позволяют размещать его внутри...
-
Основные параметры технологии - Технология производства рассольных сыров
Для частичного обезвоживания сырной массы (удаления излишней сыворотки) и регулирования молочнокислого брожения сгусток разрезают и обрабатывают. Эти...
-
Общие сведения о режиме сварки Режимом сварки называют основные показатели, определяющие процесс сварки, которые устанавливаются на основе исходных...
-
В данном разделе мы рассчитаем потребное количество сырья, вспомогательным материалов и тары в 1 смену для выпуска готовой продукции в установленном...
-
Выделим в столбе воздуха вертикальной высоты Н элемент dz, ограниченный сечениями 1-1 и 2-2, так чтобы в пределах выделенного элемента объемный вес...
-
Способ охлаждения Для отвода тепла из охлаждаемых камер холодильника используют три различные системы: непосредственное, рассольное и воздушное...
-
Введение, Понятие о температуре и о температурных шкалах - Общие сведения об измерениях температуры
Температурой называют величину, характеризующую тепловое состояние тела. Согласно кинетической теории температуру определяют как меру кинетической...
-
Основные диаграммы состояния - Титановые сплавы, пути повышения жаропрочности и ресурса
При сравнительной оценке различных легирующих добавок к титану для получения жаропрочных сплавов основным вопросом является влияние добавляемых элементов...
-
Стальной аппарат с мешалкой. Он состоит из корпуса и перемешивающего устройства с приводом. Корпус! включает в себя: цилиндрическую обечайку с приварным...
-
В приспособлениях силы трения возникают на поверхностях контакта заготовки с опорными и зажимными элементами. Величина коэффициента трения (зависит от...
-
Составление расчетной схемы и исходного уравнения для расчета зажимного усилия Силовой расчет станочных приспособлений можно разбить на следующие этапы:...
-
Расчетная плотность нефти при температуре Т=ТР определяется по формуле Где - температурная поправка, кг/(м3-К), =1,825 - 0,001315293 ; 293 - плотность...
-
Определение силы инерции - Тяговый расчет Урала 4320
Р И (разгон, торможение) для равномерного движения равна Р И = 0. Результаты расчета сил сопротивления движению отдельно для груженного и порожнего...
-
ОПРЕДЕЛЕНИЕ ЭЛЕКТРИЧЕСКИХ НАГРУЗОК - Электроснабжение цеха
Электрические нагрузки промышленных предприятий определяют выбор всех элементов системы электроснабжения: линий электропередачи, трансформаторных...
Основные расчетные формулы, Стандартные термодинамические величины - Взвешенная плавка никелевого концентрата