Обзор научно-технической литературы, Диоксид титана TiO2 - Электронно-лучевой синтез TiO2 покрытий с использованием золь-гель мишеней
Диоксид титана TiO2
Диоксид титана, TiO2 - самое распространенное соединение титана на земле. Представляет из себя амфотерный оксид четырехвалентного титана. Является основным продуктом титановой индустрии. Оксид титана существует в виде нескольких модификаций. В природе встречаются кристаллы с тетрагональной сингонией (анатаз, рутил) и ромбической сингонией (брукит). Искусственно получены еще две модификации высокого давления - ромбическая IV и гексагональная V.
Таблица 1 - Свойства модификаций TiO2
|
Параметр Модификация |
Рутил |
Анатаз |
Брукит | |
|
Параметры элементарной решетки, нм |
A |
0,45929 |
0,3785 |
0,51447 |
|
B |
- |
- |
0,9184 | |
|
C |
0,29591 |
0,99486 |
0,5145 | |
|
Число формульных единиц в ячейке |
2 |
4 |
8 | |
|
Пространственная группа |
P4/mnm |
I4/amd |
Pbca |
При нагревании и анатаз, и брукит необратимо превращаются в рутил (температуры перехода соответственно 400-1000оС и около 750оС). Основой структур этих модификаций являются октаэдры TiO6, то есть каждый ион Ti4+ окружен шестью ионами О2-, а каждый ион О2- окружен тремя ионами Ti4+. Октаэдры расположены таким образом, что каждый ион кислорода принадлежит трем октаэдрам. В анатазе на один октаэдр приходится четрые общих ребра, в рутиле - два. На рисунках 1,2 и 3 изображены их кристаллические решетки.
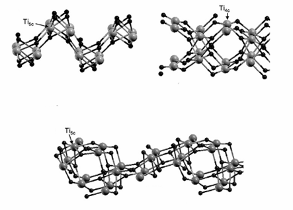
Рисунок 1 - Полиморфная модификация TiO2, брукит
Рисунок 2 - Полиморфная модификация TiO2, рутил
Рисунок 3 - Полиморфная модификация TiO2, анатаз
Хотелось бы отметить, что брукит промышленно почти не производится и в природе встречается редко. Анатазная форма также существенно уступает по производству рутильной, так как хуже рассеивает свет и менее атмосферостойка.
При термической обработке гелей, гидратированных форм диоксида титана, происходит их кристаллизация с образованием безводного TiO2. В зависимости от температуры прокаливания возможны полиморфные превращения гидратированного TiO2 в анатаз, рутил или брукит, сопровождающиеся изменением удельной поверхности и пористой структуры. При температурах ниже 600о идет процесс кристаллизации с образованием анатаза практически при неизменных значениях объема пор и удельной поверхности. При более высоких температурах наблюдается переход анатаза в прутил, сопровождающийся резким уменьшением и объема пор, и удельной поверхности. На температуру полиморфного превращения могут также большое влияние оказывать минеральные примеси.
Наиболее распространенными методами получения TiO2 являются сульфатный и хлоридный (из TiCl4), причем переработка тетрахлодида титана проводится по трем разным схемам: гидротермальный гидролиз, парофазный гидролиз или сжигание в токе кислорода. В последнее время все большее значение приобретает золь-гель метод, который позволяет получать наноразмерные TiO2 частицы с заданными структурой и свойствами и, следовательно, представляет интерес с точки зрения развития нанотехнологий. Обычно золь-гель техникой диоксид титана получают из какого-нибудь алкоксида, скажем, метоксида титана Ti(OCH3)4. Метоксид титана растворяли в безводном спирте, обычно добавляя в спирт уксусную или какую-нибудь другую кислоту - катализатор реакции гидролиза. После этого полученный раствор вливают в обычную воду при активном перемешивании. При контакте метоксида титана с водой происходит реакция гидролиза, которую упрощенно можно записать следующим образом:
Ti(OCH3)4 + 2H2O TiO2 + 4CH3OH (1)
Основные свойства диоксида титана:
- - высокая разбеливающая способность; - хорошая совместимость с любым пленкообразователем; - хорошая укрывистость; - высокая атмосферо - и влагостойкость; - отсутствие токсичности; - химическая стойкость; - амфотерность.
Порошок диоксида титана имеет ослепительно белый цвет и поэтому используется в качестве красителя при производстве красок, бумаги и т. д. Причиной такой белизны порошка TiO2 является его очень высокий показатель преломления (n=2,7). По этой же причине мы используем его в качестве основы для изготовления золь-гель мишеней для электронно-лучевого синтеза.
Похожие статьи
-
Техника и методика формирования золь-гель мишеней Гель (ксерогель) из полимерного золя образуется в процессе полимеризации мономеров и полимеров,...
-
Термином "золь-гель технология" обозначают технологию получения технически ценных неорганических и органо-неорганических материалов (катализаторы,...
-
Электронно-лучевые пучки широко используются в технологическом оборудовании для нагрева, сварки, плавки, размерной обработки, распыления, фундаментальных...
-
Формирование интерференционного многослойного покрытия осуществлялось с помощью установки вакуумного напыления ВУ-1А (рисунок 4), оснащенной источником...
-
Введение - Электронно-лучевой синтез TiO2 покрытий с использованием золь-гель мишеней
Интерференционные покрытия применяют для получения высоких коэффициентов отражения (зеркальные покрытия), для увеличения пропускания и контрастности...
-
Цель данного исследования состояла в исследовании мишеней при помощи сканирующего микроскопа и определения наличия примесей в них. В качестве объектов...
-
Нейтронообразующая мишень Нейтронообразующая мишень представляет собой подложку, на которую наносят активный слой металла, обладающего хорошими...
-
Рис. 2. Последовательность стадий роста пленки Образование покрытия начинается с возникновения зародышей. На первом этапе происходит столкновение атомов...
-
Полиморфные переходы в карбиде кремния Уже первые исследователи, открывшие явление полиморфизма, наблюдали переходы одних модификаций в другие. В 1839...
-
Суть процесса. Основные операции и область использования - Характеристика литья под давлением
Принцип процесса литья под давлением основан на принудительном заполнении рабочей полости металлической пресс-формы расплавом и формировании отливки под...
-
Свойства титана Титан - металл серого цвета. Он имеет две полиморфные модификации. Отличительными особенностями являются хорошие механические свойства,...
-
История применения активных металлов для связывания газов внутри вакуумного прибора насчитывает более 100 лет. Для этой цели впервые был использован...
-
ПРОИЗВОДСТВО ТИТАНА - Цветные металлы в строительстве
Титан получают магнийтермическим способом, сущность которого состоит в обогащении титановых руд, выплавке из них титанового шлака с последующим...
-
Влияние состава и структуры на горячеломкость при литье сплавов Влияние формы и размеров зерен на горячеломкость Измельчение зерна - это один из хорошо...
-
Сферы применения титана и титановых сплавов - Титан и титановые сплавы
Авиационная промышленность - основной потребитель титановой продукции. Именно развитие авиационной техники дало толчок титановому производству. По своим...
-
Сварка электронно-лучевая и лазерная - Виды сварки и способы их применения
В промышленности все более широкое применение находят тугоплавкие и химически активные металлы и сплавы. Поэтому для их сварки необходимо применять...
-
В большинстве случаев СОЖ используются с целью обеспечения бесперебойного рабочего процесса, уменьшения износа оборудования, снижения количества отходов...
-
Основні властивості титану - Властивості та застосування титану та його сплавів
Титан широко поширений в земній корі, де його міститься близько 0,6%, а за поширеністю він займає четверте місце після алюмінію, заліза і магнію. Однак...
-
Особенности титановых сплавов - Титан и титановые сплавы
Одним из важных преимуществ титановых сплавов перед алюминиевыми и магниевыми сплавами является жаропрочность, которая в условиях практического...
-
Целью данного исследования было изучение шероховатости поверхности напыленных дисков. В качестве объектов исследования были взяты пять образцов дисков -...
-
1. Плоскостность. Требование, означающее строгую параллельность лицевой стороны, куда наносят пленку, к тыльной стороне. Это необходимо как для...
-
В оптических цифровых показывающих приборах представление цифросуществляется при помощи диапозитивов (проекционные цифровые показывающие приборы) или в...
-
Исследования сорбционных испытаний газопоглотителей на основе титан-ванадиевого сплава На основе выбранного порошка титан-ванадиевого сплава было...
-
Электролитическое хромирование. - Гальванические покрытия
Хромирование подразделяют на коррозионностойкое, износоустойчивое, пористое и декоративное. Различают три группы деталей, наращиваемых хромом,...
-
Применяемые в производстве вещества и материалы, даже очень чистые, за частую имеют некоторое количество чужеродных атомов, оказываясь на поверхности,...
-
К универсальным грузовым вагонам относятся крытые вагоны с дверями в боковых стенах кузова и загрузочными люками в крыше; полувагоны с разгрузочными...
-
АНАЛИЗ РЫНКА КОПТИЛЬНЫХ КАМЕР На рынке отечественного оборудования в настоящее время представлен достаточно широкий спектр коптильно-варочных камер с...
-
Актуальность данной темы заключается в том, что мясные баночные консервы пользуются большим спросом у покупателей, являются продуктом, у которого...
-
Обзор литературы, Общие сведения о хлебе - Булочки из муки высшего сорта
Общие сведения о хлебе Печеный хлеб - продукт, получаемый выпечкой разрыхленного закваской или дрожжами теста, приготовленного из всех видов ржаной и...
-
Химический состав меда Химический состав меда сложный и разнообразный. Мед натуральный на 18-20 % состоит из воды, это показатель зрелости. Мед незрелый...
-
Физико-химические основы переработки пластмасс - Изготовление деталей из пластмасс
В основе процессов переработки пластмасс находятся физические и физико-химические процессы структурообразования и формования: 1) нагревание, плавление,...
-
Цель данного исследования состояла в изучении структуры и формы частиц титан-ванадиевого сплава, а также в определении наличия и состава примесей в этом...
-
Обоснование выбора теплообменника В нефтеперерабатывающей, нефтехимической, химической, газовой и других отраслях промышленности наибольшее...
-
Сплав Д1 - относится к числу дюралюминов. Такой вид сплавов обладает достаточно высокой прочностью, пластичностью и относится к числу нормальных...
-
Сушка. Общие сведения - Барабанная сушилка
Сушка представляет собой тепловую обработку материалов с целью удаления из них влаги путем испарения. Испарение влаги из материала происходит при...
-
Основные диаграммы состояния - Титановые сплавы, пути повышения жаропрочности и ресурса
При сравнительной оценке различных легирующих добавок к титану для получения жаропрочных сплавов основным вопросом является влияние добавляемых элементов...
-
Для получения пленок SiC использовалась вакуумная установка типа УРМ3, модернизированная с учетом особенностей предполагаемой методики получения....
-
Фазовые переходы и полиморфизм - Изоморфизм и варизонные структуры карбида кремния
В таблице 1 приведена современная классификация полиморфизма. К полиморфным превращениям могут приводить Фазовые переходы первого и второго рода. Фазовые...
-
Спекание керамики Операция спекания осуществляется для придания изделиям их окончательной прочности, компактности и плотности материала, полного...
-
Технологические параметры процесса электрошлаковой сварки (ЭШС). - Электрошлаковая сварка
Сущность метода принудительного формирования состоит в искусственном охлаждении поверхности металлической ванны. Основное назначение шлаков при эшс -...
Обзор научно-технической литературы, Диоксид титана TiO2 - Электронно-лучевой синтез TiO2 покрытий с использованием золь-гель мишеней