Экстракция, Жидкостная экстракция - Процесс экстракции
Экстракция - процесс извлечения одного или нескольких компонентов из растворов или твердых тел с помощью избирательных растворителей (экстрагентов). При взаимодействии с экстрагентом в нем хорошо растворяются только извлекаемые компоненты и значительно слабее или практически вовсе не растворяются остальные компоненты исходной смеси. В химической технологии экстракция из растворов экстрагентами более распространена, чем экстракция из твердых тел.
Используют для выделения в чистом виде органического синтеза. Применяется для очистки сточных вод от вредных примесей.
Экстракция в системе жидкость-жидкость есть массообменный процесс, протекающий с участием 2-х взаимно нерастворимых или органически растворимых друг в друге жидкостей.
Экстрагентом называется раствор извлеченных веществ в экстрагенте. Остаток раствора называется рафинатом. Рафинат извлекается в отстойниках. Из рафината извлекается экстрагерт.
Жидкостная экстракция
Процесс экстракции обычно экономически выгоднее ректификации, поскольку при экстракции не нужно испарять всю жидкую смесь.
Обычно жидкостную экстракцию с сочетают с ректификацией, которую применяют для регенирации экстрагента. Экстракт - раствор извлеченных веществ в экстрагенте, рафинат - остаточный исходный раствор.
На рис. 1 представлена схема без регенезации. Чаще всего используются схемы с регенезацией экстрагента.
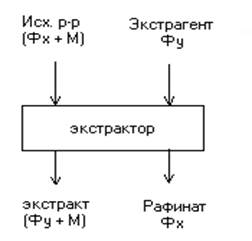
Рис. 1 Схема проведения экстракционных процессов
Равновесия в системе жидкость - жидкость
Для трехкомпонентной системы жидкость - распределяемое вещество-жидкость можно изменять концентрацию одной из фаз без нарушения равновесия. В процессе жидкостной экстракции обычно Т не меняется, Р на равновесие системы не влияет.
Закон распределения: отношение равновесных концентраций распределяемого между двумя жидкими фазами вещества при Т=const есть величина постоянная.
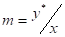
или (1)
Где у* и х - равновесные концентрации распределяемого вещества соответственно в экстракте и рафинате, m - коэффициент распределения.
По формуле (1) линия равновесия должна быть прямой, выходящей из начала координат. Однако это справедливо для случая полной взаимной нерастворимости участвующих в процессе фаз, что довольно редко встречается в реальных условиях. Обычно m зависит от концентрации распределяемого вещества Т=const, если же меняется Т, то величина m может меняться еще сильнее.
Линии равновесия на диаграмме у-х при постоянной темпиратупе называют изотермами экстракции (рис. 2). Если известны изотермы для разных Т, то становится возможным выбрать наиболее приемлемое Т.
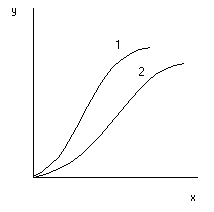
- 1 - неэлектролит 2 - электролит
Рис.2. Типичные изотермы экстракции.
Треугольные диаграммы. Отметим, что часто фазы, участвующие в процессе экстракции, частично растворимы друг в друге. Тогда экстракт помимо экстрагента и растворенного вещества содержит некоторое количество растворителя из исходного раствора, а рафинат помимо первоначального раствора и некоторого количества растворенного вещества - определенное количество экстрагента. Оба раствора состоят из трех компонентов.
А, В, С - чистые компоненты. В точке А - чистый Фх, в точке В - чистый М, в точке С - чистый Фу. Точка М характеризуется величинами. Точки на площади треугольника соответствуют составам трехкомпонентных растворов.
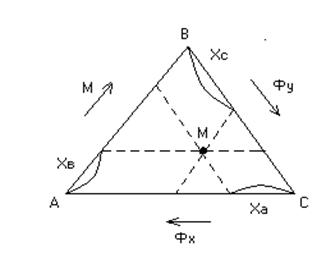
Рис. 3 Треугольная диаграмма
Равновесную концентрацию для трехкомпонентных смесей ж-ж можно представить на треугольной диаграмме.
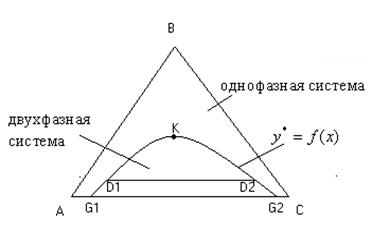
Рис. 4 Равновесная кривая в треугольной диаграмме.
А - 100% - растворитель в исходном растворе,
В - 100% - растворенное вещество,
С - 100% - экстрагент
Линии АВ, ВС, СА - характеризуют состав двухкомпонентных растворов. Пусть А и В, В и С, неограниченно растворимы друг в друге, а А и С - ограниченно растворимы. Пусть состав А и С характеризуются точками G1 и G2. Если к ним добавить В, получим трехкомпонентный расслаивающий раствор соответствующий точкам D1 и D2. Эта хорда соответствует растворам, находящихся в равновесии друг с другом. Точка К - критическая точка, соответствует однофазному раствору.
Взаимная растворимость с увеличением температуры повышается, поэтому область существования гетерогенных систем уменьшается. При высоких температурах может вообще исчезнуть (точка Ткр на рис. 5).
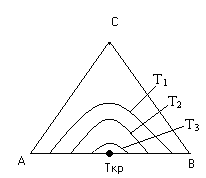
Рис. 5 Влияние Т на равновесную кривую.
Основным свойством экстрагента является селективность, которая характеризует его способность преимущественно извлекать один из двух, трех и более компонентов раствора. Селективность экстрагирования по отношению к распределяемому компоненту характеризуется коэффициентом селективности (коэффициент разделения)
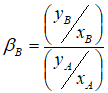
(2)
Или с учетом (1)
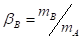
(3)
Как видно, чем больше тем больше. Если =1, то селективность равна 0. В реальных условиях больше 2.
Обозначены через у - экстракт, х - рафинат.
- коэффициент распределения для компонента В.
Похожие статьи
-
Материальный баланс процесса жидкостной экстракции - Процесс экстракции
Однократная (одноступенчатая) экстракция. Рассмотрим одноступенчатую (однократную) экстракцию. Этот простейший метод заключается в том, что исходный...
-
Исходный раствор и соответствующие рафинаты обрабатывают порцией свежего экстрагента S1 и S2 и т. д. На каждой ступени экстракции, состоящей из смесителя...
-
Цель системы автоматического регулирования определяется назначением процесса: очистка газа, поступающего в абсорбер или получение готового продукта. В...
-
Заключение - Копчение рыбы как пример сложного тепло-массообменного процесса
Копчение рыбы это сложный тепло-массобменный процесс, в результате которого протекают изменения в физико-химическом составе продукта (рыбы): процессы,...
-
Бездымное копчение. - Копчение рыбы как пример сложного тепло-массообменного процесса
Бездымное или мокрое копчение - это копчение коптильными препаратами, которые представляют собой экстракты продуктов термического разложения древесины,...
-
Получение сульфата аммония основано на поглощении аммиака из коксового газа раствором серной кислоты и протекании реакции нейтрализации....
-
Физико-химические изменения, происходящие в процессе копчения, связаны с тепловым воздействием, влиянием посолочных веществ и значительным...
-
Как было отмечено, процесс окисления протекает многостадийно, поэтому некоторыми авторами [4, 7-11] кислотное число принимается за основной показатель,...
-
Запуск системы производства поролона производится по команде оператора после того, как им были введены параметры протекания процесса. Перед запуском...
-
Физическое представление системы управления не может быть полным, если отсутствует информация о том, на какой технологической платформе она реализована....
-
После описания звеньев системы определяем ее передаточную функцию, которая представляет собой произведение всех ПФ звеньев: (2.10) Подставляем в...
-
Контроль качества -- это деятельность, включающая проведение измерений, экспертизы, испытаний или оценки параметров объекта и сравнение полученных...
-
Сплав Д1 - относится к числу дюралюминов. Такой вид сплавов обладает достаточно высокой прочностью, пластичностью и относится к числу нормальных...
-
Области применения абсорбционных процессов - Абсорбер для очистки газов от диоксида углерода
Некоторые из этих областей указаны ниже: 1. Получение готового продукта путем поглощения газа жидкостью. Примерами могут служить: абсорбция SO3 в...
-
Описание процесса приготовления цементного клинкера в трубной шаровой мельнице Измельчение материалов в цементном производстве - один из технологических...
-
Образование аромата и вкуса - Копчение рыбы как пример сложного тепло-массообменного процесса
При анализе образования специфических аромата и вкуса копчености следует различать понятия: аромат коптильного дыма и аромат, и вкус копченого продукта...
-
Назначение процесса - Каталитический крекинг
Основное назначение каталитического крекинга - получение высокооктановых компонентов бензина. Крекинг осуществляется при 420-550С и является процессом...
-
Образование цвета Цвет традиционно считается важнейшим критерием правильности проведения процесса копчения. По мнению потребителя, красивый...
-
Pointek ULS 200 - это бесконтактный ультразвуковой сигнализатор уровня с двумя точками переключения для регистрации уровня сыпучих веществ, жидкостей и...
-
Класс в Rational Rose -- это описание общей структуры (данных и связей) для дальнейшего создания объектов. Для того чтобы генератор Rational Rose имел...
-
Характеристика сплава Таблица 4 Марка чугуна Массовая доля элементов,% (остальное) Механические свойства С Si Mn P S Вв HB Не более МПа СЧ 15 3.5 -3.7...
-
Агрегат электролитического лужения (линия лужения) АЭЛ-1200/III предназначен для нанесения на поверхность стальной холоднокатаной полосы олова...
-
При разработке проекта автоматизации в первую очередь необходимо решить вопросы выбора структуры управления. Под структурой управления понимается...
-
Механизация и автоматизация технологических процессов Технология переработки полимеров - это область науки и техники, изучающая процессы, предназначенные...
-
Вентиляция в производственном помещении - Характеристика рабочих процессов газотурбинной установки
Вентиляционные системы устанавливаются для поддержания нормативных метеорологических параметров в помещениях разной функциональности. Классифицировать...
-
Получение низкоуглеродистой коррозионностойкой стали (процессы AOD и VOD) . - Производство стали
Широкое распространение получают методы производства низкоуглеродистой коррозионностойкой стали вне электропечи. Метод AOD. В электропечи выплавляют...
-
Рассчитаем необходимое число единиц гипсоварочных котлов, согласно формуле: N=Pп/(Pч-K), Где Pп - требуемая часовая производительность предприятия; Pч -...
-
Термодинамические процессы. Метод исследования т/д процессов. Как сказано выше первый закон т/д устанавливает взаимосвязь между количеством теплоты,...
-
Структура. Под структурой плотного продукта понимают размеры и пространственное расположение отдельных частиц или компонентов. Рис.6. Микроструктура...
-
В процессе формования компаунд в виде порошка, чешуек или гранул помещают в пресс-форму и подвергают воздействию температуры и давления, в результате...
-
Актуальность работы. В технологических процессах производства сливочного масла основным параметром, определяющим качество готового продукта и степень...
-
Сырье для экструзии профилей. - Технологические процессы производства изделий из поливинилхлорида
Исходное сырье ПВХ получают в виде мелкого белого порошка. Для того, чтобы его переработать в изделие с определенными эксплуатационными качествами, по...
-
В зависимости от температуры различают копчение холодное, горячее и полугорячее. Холодное копчение ведется при температуре не выше 40 градусов, горячее...
-
Формование листовых термопластов является чрезвычайно важным процессом для производства трехмерных изделий из поливинилхлорида. Схема этого процесса...
-
Проектирование меланжевой пряжи представляет собой важную, но весьма трудоемкую технологическую задачу. Поэтому перспективна разработка средств...
-
Процесс плавки в жидкой ванне (ПЖВ) - Цветные металлы в строительстве
Оригинальный процесс автогенной плавки сульфидных мед-ных и медно-цинковых концентратов, названный авторами данной книги "плавкой в жидкой ванне", начал...
-
Введение - Автоматика и автоматизация технологических процессов
Курс "Системы управления технологическими процессами" ("Автоматика и автоматизация технологических процессов") направлен на изучение вопросов управления...
-
Резание металлов - сложный процесс взаимодействия режущего инструмента и заготовки, сопровождающийся рядом физических явлений, таких как: 1)...
-
Обзор и характеристика применяемых ГОСТов - Анализ точности и стабильности технологического процесса
Для написания данной курсовой работы были использованы такие ГОСТы как: 1. ГОСТ Р ИСО/ТО 10017-2005 Статистические методы. Руководство по применению в...
-
Требования к хранению сырья - Характеристика процесса хлебопечение
В кладовых для хранения сухих продуктов должна поддерживаться t. около 15ОС и относительная влажность воздуха около 60-65%. В помещении где t не должна...
Экстракция, Жидкостная экстракция - Процесс экстракции