Физико-химические основы процесса производства сульфата аммония из аммиака коксового газа - Расчет аммиачного абсорбера в условиях сульфатного отделения коксохимического завода
Получение сульфата аммония основано на поглощении аммиака из коксового газа раствором серной кислоты и протекании реакции нейтрализации.
2NH3+H2S04>(NH4)2S4+q
Процесс нейтрализации серной кислоты аммиаком протекает в две стадии:
- образование кислой соли - бисульфата аммония
H2S04 + NH3 > NH4 HSO4
- превращение кислой соли в среднюю по мере перенасыщения раствора аммиаком
NH4HSO4 + NH3 > (NH4)2SO4
Эти реакции протекают с выделением тепла, количество которого зависит от условий ведения процесса. При взаимодействии чистого аммиака и насыщенного раствора сульфата аммония, содержащего 7-8% свободной кислоты, тепловой эффект суммарной реакции составляет при 47,5°С 815 кДж/кг сульфата аммония, а при 66,3°С 1855 кДж/кг. При поглощении аммиака из коксового газа тепловой эффект процесса значительно меньше, так как часть аммиака находится в виде летучих соединений С Сероводородом, углекислотой и другими кислыми газами, на разложение которых затрачивается тепло. Для практических расчетов можно принимать тепловой эффект суммарной реакции равным 1180 кДж/кг сульфата аммония.
Соотношение между сульфатом и бисульфатом в растворе определяется кислотностью последнего. При низкой кислотности (1 -2%) в растворе преобладает сульфат, который выпадает из пересыщенного раствора в виде кристаллов. При повышении кислотности раствора до 34% средняя соль переходит практически полностью в кислую, которая обладает лучшей растворимостью в воде и в кислых растворах. При 60°С растворимость сульфата аммония в воде составляет 46.6%. при повышении кислотности до 19% она практически не меняется, а затем постепенно растет и при кислотности 34% достигает максимума (около 52%), после чего начинает снижаться.
Образование кристаллов сульфата аммония происходит при пересыщении маточного раствора за счет непрерывного процесса поглощения аммиака серной кислотой или в результате упаривания раствора. Кристаллизация начинается с образования центров кристаллизации зародышей кристаллов. Для получения крупных кристаллов необходимо обеспечить условия для их роста, интенсивность которого зависит от скорости диффузии сульфата аммония из раствора к граням кристаллов, скорости перехода молекул соли из жидкой фазы в твердую и скорости отвода скрытой теплоты кристаллизации от поверхности кристаллов в раствор. При интенсивном перемешивании растворов процессы диффузии сульфата аммония из раствора к граням кристаллов и отвода тепла кристаллизации настолько интенсифицируются, что практически не оказывают влияния на процесс кристаллизации. При этом скорость перехода вещества из жидкой фазы в твердую пропорциональна второй степени разности концентрации пересыщенного и насыщенного растворов
W=K(CN-CH)2
Коэффициент скорости кристаллизации К зависит в сильной степени от условий кристаллизации. Экспериментально установлено, что основными факторами, оказывающими влияние на рост кристаллов, являются интенсивность перемешивания, температура и кислотность маточного раствора, а также концентрация различных примесей в нем.
Путем перемешивания растворов можно ускорить рост мелких кристаллов, задержать образование новых зародышей или растворить уже образовавшиеся центры кристаллизации. Для получения крупных кристаллов необходимо поддерживать их длительное время во взвешенном состоянии в пересыщенном растворе, что может быть обеспечено при наличии восходящего потока раствора в кристаллизаторе. При таком движении раствора создаются более благоприятные условия дя роста крупных кристаллов, так как они обладают большей энергией кристаллизации и расположены в нижней части кристаллизатора, куда подводится свежий пересыщенный раствор.
Более мелкие кристаллы и зародыши в таких условиях постепенно растворяются, так как они обладают большей растворимостью и находятся в верхней части кристаллизатора, где степень пересыщения маточного раствора незначительна. Когда размер кристаллов достигает определенной величины, они оседают на дно кристаллизатора и выводятся в качестве продукта.
Образованию крупных кристаллов способствуют более низкие температура и кислотность маточного раствора. В производственных условиях раствор постоянно контактирует с холодными стенками аппаратов и трубопроводов, в результате чего он становится пересыщенным и в этих зонах образуются новые зародыши кристаллов. При накоплении их в системе не могут быть получены крупные кристаллы из-за недостатка пересыщенного раствора. Чем выше температура маточного раствора, тем значительнее влияние местных переохлаждений раствора, тем больше содержание мелких фракций в получаемом продукте.
Для получения крупнокристаллического продукта процесс кристаллизации должен проводиться при возможно низкой температуре, а аппараты и трубопроводы должны быть теплоизолированы.
Повышение кислотности раствора приводит к увеличению содержания бисульфата аммония, возрастанию вязкости и плотности раствора, прекращению роста кристаллов. Образующийся при этом бисульфат пиридина также препятствует росту кристаллов и способствует увеличению слеживаемости соли при хранении.
Наиболее крупные кристаллы получаются при кислотности раствора 1-2%. Однако, если кристаллизация сульфата аммония производится в аппарате для поглощения аммиака серной кислотой, при такой кислотности происходит интенсивное отложение кристаллов на стенках аппарата и в трубопроводах, нарушается нормальная работа установки. По этой причине в таких установках поддерживается кислотность маточного раствора на уровне 4-5%. При этом очень важно поддерживать одинаковую кислотность во всем объеме раствора и исключать образование нейтральных зон, в которых получается серая или черная соль (пережог).
Существенное влияние на рост кристаллов и их форму оказывают различные примеси в маточном растворе. При содержании более 1 г соединений окисного (трехвалентного) железа в 1 кг раствора увеличивается содержание мелких фракций в продукте. Наличие в растворе хрома, алюминия, кадмия способствует образованию игольчатых кристаллов, которые при хранении легко ломаются, образуя пыль, и склонны к слеживанию. Наличие в растворе цианидов и хлоридов также препятствует росту кристаллов.
Отрицательное действие названных примесей может быть ограничено при введении в раствор щавелевой кислоты, сульфата магния и Щавелевокислого кальция, мочевины, соединений закисного (двухвалентного) железа, марганца, кобальта.
Примеси в маточном растворе не только препятствуют росту кристаллов, но и придают им различную окраску. Серый цвет сульфата аммония обусловлен наличием смолистых веществ, сернистых соединений железа, меди, свинца. Желтую окраску дают соединения мышьяка. Роданистые соединения в присутствии следов железа дают красную или розовую окраску. Голубой цвет придает сульфату берлинская лазурь. Кроме того, цианистые соединения образуют с железом комплексные соединения, которые в смеси с другими веществами придают сульфату цветовые оттенки от зелено-желтого до фиолетового.
Для получения сульфата аммония белого цвета необходимо производить предварительную очистку коксового газа от смолистых веществ, цианистого водорода и сероводорода, применять чистую серную кислоту и аппаратуру из коррозионностойких материалов. [3]
Абсорбцией называется процесс поглощения газа или пара жидким поглотителем (абсорбентом). Обратный процесс - выделение поглощенного газа из поглотителя - называется десорбцией.
В промышленности абсорбция с последующей десорбцией широко применяется для выделения из газовых смесей ценных компонентов (например, для извлечения из коксового газа аммиака, бензола и др.), для очистки технологических и горючих газов от вредных примесей (например, при очистке их от сероводорода), для санитарной очистки газов (например, отходящих газов от сернистого ангидрида) и т. д.
В некоторых случаях десорбцию не проводят, если извлекаемый компонент и поглотитель являются дешевыми или отбросными продуктами или если в результате абсорбции получается готовый продукт (например, соляная кислота при абсорбции хлористого водорода водой).
Равновесие между фазами.
Растворимость газов в жидкостях зависит от свойств газа и жидкости, от температуры и парциального давления растворяющегося газа (компонента) в газовой смеси.
Зависимость между растворимостью газа и его парциальным давлением характеризуется законом Генри, согласно которому равновесное парциальное давление р* пропорционально содержанию растворенного газа в растворе X (в кг/кг поглотителя)
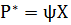
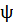
Где - коэффициент пропорциональности, имеющий размерность давления и зависящей от свойств растворенного газа и поглотителя и от температуры.
Растворимость многих газов значительно отклоняется от закона Генри. Это относится главным образом к хорошо растворимым газам, образующим растворы высокой концентрации. При низких концентрациях раствора закон Генри обычно хорошо соблюдается.
Для практических расчетов пользуются полученными из опыта значениями равновесного парциального давления газа р* и вычисляют равновесное содержание абсорбируемого компонента в газовой смеси Y* по формуле
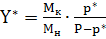
кг/кг инертного газа
где МК и МН - молекулярные массы абсорбируемого компонента и инертного (неабсорбируемого) газа;
Р-общее давление газовой смеси. По найденным значениям Y* строят линию равновесия
При небольших значениях р*, по сравнению с Р, можно приближенно написать, учитывая уравнение
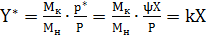
Где k=
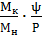
В этом случае линия равновесия представляет собой прямую, тангенс угла наклона которой равен k. [4]
Коксохимический аммиачный сульфат абсорбер
Похожие статьи
-
Особенностью данной этой схемы является то, что поглощение аммиака и пиридиновых оснований производится раздельно от кристаллизации сульфата аммония в...
-
Содержание аммиака в коксовом газе после сатуратора или бессатураторной установки не должно превышать 0,03 г/м3. Кислотность раствора, циркулирующего в...
-
Материальный расчет Материальный баланс аммиака. Материальный баланс аммиака (кг/ч) имеет следующий вид: Приход Расход С коксовым газом 828 С коксовым...
-
Характеристика перерабатываемого сырья и продукции В химически чистом сульфате аммония аммиак составляет 25,76 %, остальные 74,24 % приходятся на долю...
-
Введение - Расчет аммиачного абсорбера в условиях сульфатного отделения коксохимического завода
Роль коксохимической промышленности в народном хозяйстве Украины. Коксохимия - важное звено всего народного хозяйства. Основным потребителем кокса...
-
Определение размеров абсорберов 1-й и 2-й ступени Количество газов и паров, поступающих в абсорбер, приведено в таблице 8. Таблица 8 - Количество газов и...
-
Материальный расчет. Приход. 1. Коксовый газ. В абсорбер 1-й ступени поступают коксовый газ из нагнетателя и аммиачно-водяные пары из дефлегматора в...
-
Основные нормы технологического режима работы аммиачного абсорбера приведены в таблице 2. Таблица 2 - Показатели технологического режима [5] Наименование...
-
Основным аппаратом для абсорбционных процессов (хемосорбции) служит полый форсуночный абсорбер. Абсорбер состоит из двух секций. В первой - нижней...
-
Данный курсовой проект посвящен расчету аммиачного абсорбера в условиях сульфатного отделения коксохимического завода. В первой части записки приведена...
-
Материальный расчет. Приход 1. В абсорбер 2-й ступени поступает коксовый газ из абсорбера 1-й ступени в следующем количестве, кг/ч: Сухой коксовый газ...
-
Мороженое обладает высокой пищевой ценностью. Оно содержит молочный жир, белки, углеводы, минеральные вещества и витамины, легко усваивается организмом....
-
Особенности контроля работы аммиачного абсорбера приведены в таблице 3 и 4 Таблица 3 - Контроль работы аммиачного абсорбера [5] Наименование стадии,...
-
Под созреванием сыра понимают глубокие изменения составных частей свежеприготовленного сыра, в результате которых он приобретает свойственные ему вкус,...
-
Азотная кислота и главным образом ее природная соль - натриевая селитра известны с давних времен. В 778г. арабский ученый Гебер описал способ...
-
Как уже отмечалось в современных условиях, для организации ремонта двигателя ЯМЗ-240 рекомендуется не обезличенный поточный способ ремонта, при котором...
-
Рассчитаем необходимое число единиц гипсоварочных котлов, согласно формуле: N=Pп/(Pч-K), Где Pп - требуемая часовая производительность предприятия; Pч -...
-
Для анализа кристаллизационного процесса был выполнен ДТА сплавов системы Al - Si с содержанием Si: 0.25, 0.5, 1.0, 3.0 и 5.0 %. Основные параметры...
-
Производство стали - Разработка технологического процесса изготовления детали "зубчатое колесо"
Сущность процесса Основными материалами для производства стали являются передельный чугун и стальной лом (скрап). Содержание углерода и примесей в стали...
-
Сметана - Биохимические основы производства отдельных видов кисломолочных продуктов и мороженого
В образовании структуры продукта участвуют молочный жир и белки. Главную роль играет жир, который в результате отвердевания и кристаллизации повышает...
-
Творог - Биохимические основы производства отдельных видов кисломолочных продуктов и мороженого
Главными процессами, определяющими качество творога, являются коагуляция казеина и обработка (обезвоживание) образующегося сгустка. Для выработки...
-
Биохимические процессы, протекающие во время созревания сыра, приводят к значительным изменениям его основных составных частей. Многочисленные химические...
-
Переработка отходов сельского хозяйства в анаэробных условиях - Проблемы отходности производства
При переработке органических отходов в анаэробных условиях образуется горючий газ, на 60% состоящий из метана, и твердый остаток, содержащий почти весь...
-
Сплав Д1 - относится к числу дюралюминов. Такой вид сплавов обладает достаточно высокой прочностью, пластичностью и относится к числу нормальных...
-
Бездымное копчение. - Копчение рыбы как пример сложного тепло-массообменного процесса
Бездымное или мокрое копчение - это копчение коптильными препаратами, которые представляют собой экстракты продуктов термического разложения древесины,...
-
При неблагоприятных условиях хранения в жирах протекают различные процессы, отрицательно влияющие на их пищевые качества. Большинство изменений жиров...
-
Таблица 4.2 Расчет необходимого количества ручных огнетушителей Категория Помещений По пожарной опасности Предел Защища-емой Площади, м2 Класс пожара...
-
После описания звеньев системы определяем ее передаточную функцию, которая представляет собой произведение всех ПФ звеньев: (2.10) Подставляем в...
-
При размещении оборудования руководствовались технологическими, техническими требованиями и регламентированными нормами. При выборе варианта компоновки...
-
В состав ПО "Полимир" входят следующие производства: полиэтилена высокого давления, полиакрилонитрильных волокон, продуктов органического синтеза -...
-
По данным лабораторных анализов установлено, что удельный выброс веществ, выделяющихся при переработке полиэтилентерефталата, составляет: - уксусная...
-
Механизация и автоматизация технологических процессов Технология переработки полимеров - это область науки и техники, изучающая процессы, предназначенные...
-
Определение геометрических размеров основных элементов фланцевого соединения Расчетная температура элементов фланцевого соединения определяется по...
-
Технологический процесс производства творога Творог - белковый кисломолочный продукт. Его изготовление происходит путем сквашивания культурами...
-
Физико-химические основы переработки пластмасс - Изготовление деталей из пластмасс
В основе процессов переработки пластмасс находятся физические и физико-химические процессы структурообразования и формования: 1) нагревание, плавление,...
-
Технологический процесс производства хлеба - Технологический процесс производства хлеба
Испокон веков выпекание хлеба требовало от пекаря особого мастерства, терпеливости и старания. Невзирая на бурное развитие передовых приемов переработки,...
-
Грохочение, Основные понятия и назначение грохочения - Основы процесса грохочения
Основные понятия и назначение грохочения Грохочение - процесс разделения сыпучего зернистого материала на продукты различной крупности (классы) с помощью...
-
Физический способ состоит в термическом испарении и конденсации под специальным колпаком в вакууме наносимого вещества или его катодном распылении на...
-
Технологическая схема зависит от вида и характера, вида и качества исходных материалов, от уровня развития техники (рис.1.). Рисунок 1- Технологическая...
-
Стадии и описание биотехнологического процесса производства йогурта резервуарным способом Производство кисломолочных продуктов резервуарным способом...
Физико-химические основы процесса производства сульфата аммония из аммиака коксового газа - Расчет аммиачного абсорбера в условиях сульфатного отделения коксохимического завода