Термодинамические процессы
Термодинамические процессы.
Метод исследования т/д процессов.
Как сказано выше первый закон т/д устанавливает взаимосвязь между количеством теплоты, внутренней энергией и работой. При этом количество теплоты подводимое к телу или отводимое от тела зависит от характера процесса.
К основным т/д процессам относятся: Изохорный, изотермический, изобарный и адиабатный.
Для всех этих процессов устанавливается общий метод исследования, который заключается в следующем:
- - выводится уравнение процесса кривой Pх и TS - диаграммах; - устанавливается зависимость между основными параметрами рабочего тела в начале и конце процесса; - определяется изменение внутренней энергии по формуле, справедливой для всех процессов идеального газа: ?u = сVм|0T2-t2 - сVм|0T1-t1. (4.1)
Или при постоянной теплоемкости ?U = m-сV-(t2 - t1); (4.2)
Вычисляется работа: L = P-(V2 - V1); (4.3)
Определяется количество теплоты, участвующее в процессе:
Q = cX-(t2- t1); (4.4)
Определяется изменение энтальпии по формуле, справедливой для всех процессов идеального газа:
?i = (i2 - i1) = сPм|0T2-t2 - сPм|0T1-t1, (4.5)
Или при постоянной теплоемкости: ?i = сP-(t2 - t1); (4.6)
Определяется изменение энтропии:
- ?s = cV-ln(T2/T1) + R-ln(х 2/х 1) ; (4.7) ?s = cP-ln(T2/T1) - R-ln(P2/P1) ; (4.8) ?s = cV-ln(T2/T1) + cP-ln(х 2/х 1) . (4.9)
Все процессы рассматриваются как обратимые.
Изопроцессы идеального газа.
- 1). Изохорный процесс (Рис.4.1). ? = Const, ? 2 = ? 1. (4.10)
Уравнение состояния процесса:
P2 / P1 = T2 / T1. (4.11)
Так как х 2 = х 1, то l = 0 и уравнение 1-го закона т/д имеет вид:
Q = ?u = = сV-(t2 - t1); (4.12)

2). Изобарный процесс (Рис.4.2).
P = Const, P2 = P1
Уравнение состояния процесса:
? 2 /? 1 = T2 / T1 , (4.13)
Работа этого процесса:
L = P-(? 2 - ? 1). (4.14)
Уравнение 1-го закона т/д имеет вид:
Q = ?u + l = сР-(t2 - t1); (4.15)

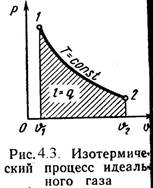
3 Изотермический процесс (Рис.4.3).
Т = Const, Т2 = Т1
Уравнение состояния:
P1 / P2 = ? 2 / ? 1 , (4.16)
Так как Т2 = Т1, то ?u = 0 и уравнение 1-го закона т/д будет иметь вид:
Q = l = R-T-ln(? 2/? 1), (4.17)
Или q = l = R-T-ln(P1/P2), (4.18)
Где R = R?/ ? - газовая постоянная [Дж/(кг-К)].
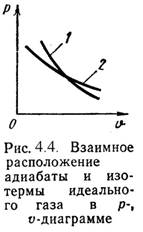
4). Адиабатный процесс (Рис.4.4).
В данном процессе не подводится и не отводится тепло, т. е. q =0.
Уравнение состояния:
P-? ? = Const, (4.19)
Где ? = cP / cV - показатель адиабаты.
Уравнение 1-го закона т/д будет иметь вид:
L = -?u = = - сV-(t2 - t1) = сV-(t1 - t2), (4.20)
Или
L = R-(T1 - T2) / (? -1); (4.21)
L = R-T1-[1 - (? 1/ ? 2) ? -1] /(? - 1); (4.22)
L = R-T2-[1 - (P2/P1) (? -1)/ ?] /(? - 1). (4.23)
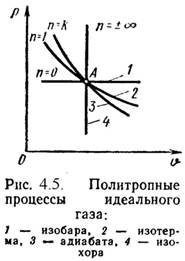
Политропный процесс.
Политропным процессом называется процесс, все состояния которого удовлетворяются условию:
P- ?N = Const, (4.24)
Где n - показатель политропы, постоянная для данного процесса.
Изобарный, изохорный, изотермический и адиабатный процессы являются частными случаями политропного процесса (Рис.4.5):
При n = ± ? ? = Const, (изохорный),
N = 0 P = Const, (изобарный),
N = 1 T = Const, (изотермический),
N = ? P- ? = Const, (адиабатный).
Работа политропного процесса определяется аналогично как при адиабатном процессе:
L = R-(T1 - T2) / (n - 1); (4.25)
L = R-T1-[1 - (? 1/ ? 2) n-1] /(n - 1); (4.26)
L = R-T2-[1 - (P2/P1) (n-1)/ n] /(n - 1). (4.27)
Теплота процесса:
Q = cN -(T2 - T1), (4.28)
Где cN = cV -(n - ?)/(n - 1) - массовая теплоемкость (4.29)
Политропного процесса.
Похожие статьи
-
Основными факторами, которые влияют на процесс термического разложения пирита являются: - температура обжига, °С (Х1); - продолжительность обжига, время,...
-
Материальный баланс процесса жидкостной экстракции - Процесс экстракции
Однократная (одноступенчатая) экстракция. Рассмотрим одноступенчатую (однократную) экстракцию. Этот простейший метод заключается в том, что исходный...
-
В зависимости от назначений и требований, предъявляемых к отдельным типам ламп накаливания их конструкция может меняться. Однако основные узлы всех типов...
-
ПРОЦЕСС СГОРАНИЯ В БЕНЗИНОВЫХ ДВС - Сгорание топлива в поршневых ДВС с внешнем смесеобразованием
Двигатель сгорание топливо Развитие процесса горения в ДВС с внешним смесеобразованием. Процесс сгорания топлива представляет собой химическую реакцию...
-
В настоящее время первичным звеном сложных производственных систем крупных предприятий является поточное производство - форма организации производства,...
-
Цель системы автоматического регулирования определяется назначением процесса: очистка газа, поступающего в абсорбер или получение готового продукта. В...
-
Введение - Разработка технологического процесса изготовления стола для компьютера
Производство компьютерных столов приобретает все большую актуальность, по мере того, как компьютерная техника проникает во все сферы жизни и деятельности...
-
Режим динамического торможения при реактивном характере нагрузке производственного механизма (участок 89 - рисунок 6) от до 0. RДв. гор+ RДТ= 2,33Ом; С....
-
Сплав Д1 - относится к числу дюралюминов. Такой вид сплавов обладает достаточно высокой прочностью, пластичностью и относится к числу нормальных...
-
Раскатка и прокладка кабеля - Описание технического процесса прокладки кабеля
При невозможности по местным условиям применять механизированную прокладку кабеля, его раскатку и прокладку производят ручным способом. При этом способе...
-
Для анализа кристаллизационного процесса был выполнен ДТА сплавов системы Al - Si с содержанием Si: 0.25, 0.5, 1.0, 3.0 и 5.0 %. Основные параметры...
-
Для начала производства технических устройств (машин, механизмов, приборов и т. п. изделий) необходимо наличие законченной и аттестованной...
-
Как уже отмечалось в современных условиях, для организации ремонта двигателя ЯМЗ-240 рекомендуется не обезличенный поточный способ ремонта, при котором...
-
Технологический процесс, как объект автоматизации - Технологический процесс сушильного барабана
Основной задачей автоматизации сушильных барабанов является получение материала определенной влажности. Важнейшим требованием автоматизации является...
-
Системы оценки качества хлеба - Технологический процесс производства хлеба
В зависимости от вида муки хлеб бывает ржаной, ржано-пшеничный и пшеничный. По рецептуре теста хлеб подразделяют на простой, улучшенный и сдобный. По...
-
Производственный и технологические процессы основного производства машиностроительного предприятия Вопросы по теме Производственный процесс и принципы...
-
Как было отмечено, процесс окисления протекает многостадийно, поэтому некоторыми авторами [4, 7-11] кислотное число принимается за основной показатель,...
-
Классификация теста По способу разрыхления все виды теста для мучных кондитерских изделий можно разделить на два вида: дрожжевое и бездрожжевое (или...
-
Запуск системы производства поролона производится по команде оператора после того, как им были введены параметры протекания процесса. Перед запуском...
-
Разработка технологических процессов - Технологическая подготовка машиностроительного производства
Для служб ТПП исходным документом является приказ руководителя предприятия, в котором определяется поэтапное выполнение мероприятий по технологической...
-
Химическая схема процесса, Сжигание серы. - Производство серной кислоты
Сжигание серы. При получении обжигового газа путем сжигания серы отпадает необходимость очистки от примесей. Стадия подготовки будет включать лишь осушку...
-
Производственный процесс -- понятие более широкое, включающее в себя кроме технологического процесса все другие вспомогательные процессы, подготовку...
-
Рассчитаем необходимое число единиц гипсоварочных котлов, согласно формуле: N=Pп/(Pч-K), Где Pп - требуемая часовая производительность предприятия; Pч -...
-
Охрана труда - меры, направленные на сохранение жизни и здоровья работников в процессе трудовой деятельности, включающие в себя правовые, социальные,...
-
Процесс плавки в жидкой ванне (ПЖВ) - Цветные металлы в строительстве
Оригинальный процесс автогенной плавки сульфидных мед-ных и медно-цинковых концентратов, названный авторами данной книги "плавкой в жидкой ванне", начал...
-
Под созреванием сыра понимают глубокие изменения составных частей свежеприготовленного сыра, в результате которых он приобретает свойственные ему вкус,...
-
Мороженое обладает высокой пищевой ценностью. Оно содержит молочный жир, белки, углеводы, минеральные вещества и витамины, легко усваивается организмом....
-
Характеристика сплава Таблица 4 Марка чугуна Массовая доля элементов,% (остальное) Механические свойства С Si Mn P S Вв HB Не более МПа СЧ 15 3.5 -3.7...
-
Получение сульфата аммония основано на поглощении аммиака из коксового газа раствором серной кислоты и протекании реакции нейтрализации....
-
Санитарные правила для предприятий общественного питания прописаны в СанПиН 42-123-5774-91. Требования к личной гигиене работников соблюдены : повара...
-
Структура. Под структурой плотного продукта понимают размеры и пространственное расположение отдельных частиц или компонентов. Рис.6. Микроструктура...
-
Механизация и автоматизация технологических процессов Технология переработки полимеров - это область науки и техники, изучающая процессы, предназначенные...
-
Пост ручной дуговой сварки (РДС) Стационарный сварочный пост комплектуется: 1. Система вентиляции, 2. освещение, 3. заземление, 4. источник питания...
-
Дефекты сварных соединений. - Характеристика процесса сварки
Согласно ГОСТ 23055 - 78* для соединений, выполненных сваркой плавлением, возможно образование шести видов дефектов. Пористость шва: сферическая,...
-
В процессе формования компаунд в виде порошка, чешуек или гранул помещают в пресс-форму и подвергают воздействию температуры и давления, в результате...
-
Сырье для экструзии профилей. - Технологические процессы производства изделий из поливинилхлорида
Исходное сырье ПВХ получают в виде мелкого белого порошка. Для того, чтобы его переработать в изделие с определенными эксплуатационными качествами, по...
-
Оценивание уровня качества продукции, в частности полукопченых колбас, будем производить методами, принятыми в квалиметрии. Квалиметрия - научная...
-
Заключение - Копчение рыбы как пример сложного тепло-массообменного процесса
Копчение рыбы это сложный тепло-массобменный процесс, в результате которого протекают изменения в физико-химическом составе продукта (рыбы): процессы,...
-
Физико-химические изменения, происходящие в процессе копчения, связаны с тепловым воздействием, влиянием посолочных веществ и значительным...
-
Формование листовых термопластов является чрезвычайно важным процессом для производства трехмерных изделий из поливинилхлорида. Схема этого процесса...
Термодинамические процессы