Зміни цитологічної картини ранового вмісту на тлі місцевого застосування комбінації препаратів ліастен та левомеколь у хворих з гнійними ранами
Вступ
Незважаючи на прогрес у розробці та удосконаленні існуючих методів лікування гнійних ран, ця проблема залишається пріоритетною в сучасній медичній галузі [4]. Спроба зробити акцент виключно на антимікробний компонент у комплексній програмі лікування цієї патології виявилась недостатньо ефективною [6]. Це зумовлено не лише зростаючою поліантибіотикорезистентністю мікроорганізмів до препаратів цієї групи, але й здатністю їх до індукції імунодефіциту [1,5,10]. Окрім цього, хірургічна обробка вогнища, як невід'ємна складова у лікуванні гнійних ран, також негативно впливає на імунну реактивність організму [12]. Тому в сучасних умовах важливим компонентом комплексного лікування ран стає використання імуномоделюючих препаратів [3,13,16,20]. Відсутність достатньої кількості інформації стосовно особливостей перебігу імунних реакцій у хворих з гнійно-запальними процесами м'яких тканин та її суперечливість у питаннях доцільності і обгрунтованості системного використання при цьому імунокорегуючих препаратів роблять обмеженим їх широке застосування у клінічній практиці [17,19]. При цьому результати численних досліджень підтверджують доцільність та високу ефективність локальної імунокорекції при рановій інфекції [15,21]. Одним із сучасних препаратів, який не проявляє виражених побічних дій та здатен "м'яко" відновлювати імунний захист організму, є представник мура - мілпептидного ряду -- ліастен [9]. Володіючи широким спектром дії на імунну систему, він проявляє антибактеріальну, противірусну, антиоксидантну, лейкопротекторну дію, сприяє зменшенню в крові циркулюючих імунних комплексів, посилює репаративні процеси в тканинах [8,11,18]. Проведені раніше дослідження підтвердили ефективність системного використання ліастену у комплексному лікуванні хворих з важким перебігом гострої хірургічної патології, що клінічно проявлялось зменшенням ознак інтоксикаційного синдрому, частоти виникнення вторинних гнійно-септичних ускладнень та покращення перебігу репаративних процесів в рані [2]. Можливість локального використання цього препарату, в тому числі у поєднанні з лікарськими засобами інших груп, дозволила розширити покази та сферу його використання, в тому числі і для місцевого лікування хворих з гнійними ранами.
Тому Метою нашої Роботи стало цитологічне дослідження ранового вмісту у хворих з гнійними ранами на тлі місцевого використання комбінації імуномодулятора ліастену з антимікробною маззю на гідрофільній основі левомеколь та порівняння отриманих показників з результатами, визначеними у хворих, лікування яких не передбачало використання імуномодулятора.
Матеріали та методи
Нами на базі відділення гнійно-септичного хірургії МКЛ ШМД м. Вінниці було обстежено 24 хворих. Досліджувані хворі були розподілені на дві групи (по 12 хворих у кожній). За основні критерії відбору хворих взято вік, локалізація гнійного вогнища та відсутність супутньої патології. Вік хворих становив від 18 до 55 років. Після обстеження та стандартної медикаментозної передопераційної підготовки всі хворі були прооперовані протягом першої доби після поступлення. Оперативне втручання передбачало розкриття, некректомію, санацію та дренування гнійного вогнища. У післяопераційному періоді пацієнтам основної групи, окрім традиційного лікування, у гнійно-некротичну фазу ранового процесу місцево застосовували комбінацію антимікробної мазі на гідрофільній основі левомеколь та імуности - мулятора ліастен в пропорційному співвідношенні 1:0,000025. Приготування зазначеної композиції проводилось в асептичних умовах безпосередньо перед нанесенням на рану. Пацієнти контрольної групи отримували подібне лікування без використання імуномодулятора.
Забір матеріалу для цитологічного дослідження проводився на другу, п'яту, сьому, десяту доби безпосередньо з поверхні рани методом "мазків-відбит - ків" [14]. Отримані мазки фарбували азур-еозином за Романовським-Гімзою і досліджували методом світлової мікроскопії. В отриманих препаратах підрахо - вовували відсоткове співвідношення нейтрофільних гранулоцитів (НГ) та їх дегенеративних форм, лімфоцитів, моноцитів, макрофагів, фібробластів і активність фагоцитозу. Аналіз отриманих цитограм проводили за 6 типами: І тип -- некротичний; ІІ тип -- деструктивно-запальний; ІІІ тип -- запальний; IV тип -- запально-регенеративний; V тип -- регенеративно-запальний; VI тип -- регенеративний [7].
Статистичне опрацювання результатів дослідження проведене з використанням комп'ютерної програми Statistica 6.1.
Результати та обговорення
При аналізі результатів цитологічного дослідження були отримані показники, наведені у таблицях 1 та 2.
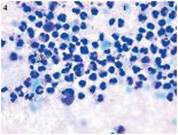
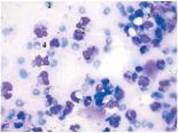
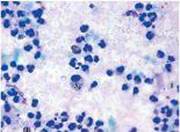
Рис. 1 Рис. 2 Рис. 3
На першу добу після розкриття гнійного вогнища (друга доба спостереження) у цитограмах хворих обох груп достовірної різниці між показниками не виявлено: у хворих основної групи кількість НГ становила 93,25 ±0,30%, у контрольній групі -- 94,75 ± 0,3 0 %, з ознаками дегенеративних змін відповідно 75,29 ±0,49% та 74,48±0,47%, подекуди з утворенням детриту, лімфоцитів -- 1,74 ± 0,07% та 1,99 ± 0,12%, моноцитів -- 1,98 ± 0,19% та 1,74 ± 0,08%, макрофагів -- 2,03 ± 0,08 та 2,21 ± 0,06%. Фібробласти не визначались. Статистично-достовірної різниці між показника активності фагоцитозу у основній (20,18 ± 0,58) та контрольній (20,70 ± 0,41) групах також не визначено (р > 0,05). Визначалась значна кількість мікроорганізмів із внутрішньо - та позаклітинним розташуванням. Тип цитограм: некротичний і дегенеративно-запальний з домінуванням частки останнього (рис. 1; рис. 2).
Цитограма мазка-відбитка з рани хворого К. (карта стаціонарного хворого №10063) основної групи на 2 добу спостереження. Дегенеративно-запальний тип цитограми. Забарвлення за Романовським-Гімзою, збільшення х 1000 (рис. 1).
- 1 --еритроцит; 2 --деструктивно-змінені нейтрофільні лейкоцити; 3 --клітинний детрит; 4 --позаклітинні мікроорганізми.
Цитограма мазка-відбитка з рани хворого Б. (карта стаціонарного хворого №1494) контрольної групи на 2 добу спостереження. Некротичний тип цитограми. Забарвлення за Романовським-Гімзою, збільшення х 1000 (рис. 2).
- 1 --еритроцит; 2 --деструктивно-змінені нейтрофільні лейкоцити; 3 --клітинний детрит; 4 --позаклітинні мікроорганізми.
Цитограма мазка-відбитка з рани хворого К. (карта стаціонарного хворого №10063) основної групи на 5 добу спостереження. Запальний тип цитограми. Забарвлення за Романовським-Гімзою, збільшення х1000 (рис. 3).
- 1 --еритроцит; 2 --нейтрофільний лейкоцит; 3 --макрофаг; 4 --лімфоцит.
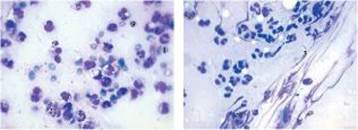
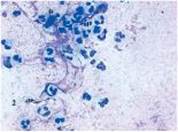
Рис. 4 Рис. 5 Рис. 6
Цитограма мазка-відбитка з гнійної рани хворого Б. (карта стаціонарного хворого №1494) контрольної групи на 5 добу спостереження. Дегенеративний тип цитограми. Забарвлення за Романовським-Гімзою, збільшення х 1000 (рис. 4). ліастен левомеколь гнійний рана
- 1 --еритроцит; 2 --фагоцитуючий нейтрофільний лейкоцит; 3 --лімфоцит.
Цитограма мазка-відбитка з гнійної рани хворого К. (карта стаціонарного хворого №10063) основної групи на 7 добу спостереження. Регенеративно-запальний тип цито - грами. Забарвлення за Романовським - Гімзою, збільшення х 1000 (рис. 5).
- 1 --нейтрофільний лейкоцит; 2 --макрофаг; 3 --фібробласт.
Цитограма мазка-відбитка з гнійної рани хворого Б. (карта стаціонарного хворого № 1494) контрольної групи на 7 добу спостереження. Запально-регенеративний тип цитограми. Забарвлення за Романовським - Гімзою, збільшення х 1000 (рис. 6).
- 1 --нейтрофільний лейкоцит; 2 --еритроцит; 3 --фібробласт; 4 --лімфоцит;
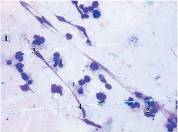
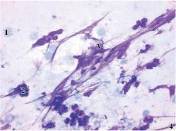
Рис. 7 Рис. 8
На п'яту добу спостереження в мазках відбитках основної групи в порівнянні з показниками, отриманими у хворих контрольної групи, визначались достовірне зменшення кількості НГ та їх дегенеративних форм до 78,61 ±0,37% і 46,37±0,59% відповідно, збільшення кількості макрофагів до 6,99±0,10%, фібробластів -- до 5,30 ± 0,19% (р<0,05). Активність фагоцитозу достовірно не відрізнялась і становила 30,53±0,30% в контрольній та 31,98±0,68% в основній групі. Цитологічна картина, визначена в основної групи, відповідала запальному типу цитограми, тоді як в контрольній групі ще зберігався дегенеративно-запальний тип (рис. 3; рис. 4).
Цитограма мазка-відбитка з гнійної рани хворого К. (карта стаціонарного хворого №10063) основної групи на 10 добу спостереження. Регенеративний тип цитограми. Забарвлення за Романовським-Гімзою, збільшення х1000 (рис. 7).
- 1 --еритроцит; 2 --макрофаг; 3 --фібробласт; 4 --колагенові волокна.
Цитограма мазка-відбитка з гнійної рани хворого Б. (карта стаціонарного хворого № 1494) контрольної групи на 10 добу спостереження. Регенеративно-запальний тип цитограми. Забарвлення за Романовським-Гімзою, збільшення х 1000 (рис. 8).
- 1 --еритроцит; 2 --нейтрофільний лейкоцит; 3 --фібробласт; 4 --колагенові волокна.
На сьому добу в основній групі спостерігалась подальша тенденція до зменшення кількості НГ до 70,78 ± 0,59%, їх дегенеративних форм до 25,88 ± 0,46%, збільшення відсоткової частки макрофагів до 9,51 ± 0,26%, фібробластів -- до 10,69 ± 0,39%, активності фагоцитозу до 52,01 ± 0,77%, що мало статистичну достовірну різницю з відповідними показниками в контрольній групі (р< 0,05). Тип цитограми в основній групі визначений як запально-регенеративний та регенеративно-запальний, тоді як в дослідній групі він залишався переважно запального типу (рис 5; рис. 6).
На десяту добу спостереження подібна залежність в динаміці змін клітинного складу ранового вмісту зберігалась: в основній групі кількість НГ становила 54,38±0,51%, тоді як в контрольній групі вона становила 61,50±0,88% (р<0,05), кількість дегенеративних форм НГ становила 8,59±0,45% і 13,45±0,39% відповідно (р<0,05), відсоткове число макрофагів -- 12,28±0,33% і 10,19±0,19% (р<0,05), фібробластів -- 22,71 ±0,43% і 16,48±0,53% (р<0,05). Активність фагоцитозу в основній групі достовірно зменшувалась і становила 35,56 ±0,70%, тоді як в контрольній групі цей показник залишався на рівні 39,91 ±0,74% (р<0,05). В мазках-відбитках основної групи визначався регенеративний та регенеративно-запальний тип цитограми, тоді як цитологічна картина ранового вмісту хворих контрольної групи відповідала регенеративно-запальному чи запально-регенеративному типу (рис 7; рис. 8).
Таблиця 1. Дані цитограми гнійних ран контрольної групи хворих (n=12)
|
Показники |
Терміни спостереження | |||
|
2 доба |
5 доба |
7 доба |
10 доба | |
|
Нейтрофільні лейкоцити,% |
94,75±0,25 |
86,27±0,45 |
78,98±0,51 |
61,50 ±0,88 |
|
З низ дегенеруючі форми, % |
74,48±0,47 |
54,91±0,69 |
34,07±0,37 |
13,45 ±0,39 |
|
Лімфоцити, % |
1,99±0,12 |
4,69±0,24 |
7,27±0,19 |
9,40±0,20 |
|
Моноцити, % |
1,74±0,08 |
1,91 ±0,08 |
1,99±0,09 |
1,88±0,09 |
|
Макрофаги, % |
2,21 ±0,06 |
5,22±0,15 |
6,64±0,09 |
10,19±0,19 |
|
Фібробласти, % |
0 |
2,48±0,14 |
6,53±0,32 |
16,48±0,53 |
|
Активність фагоцитозу, % |
20,70±0,41 |
30,53±0,30 |
46,57±0,32 |
39,91 ±0,74 |
Таблиця 2. Дані цитограми гнійних ран основної групи хворих (n=12)
|
Показники |
Терміни спостереження | |||
|
2 доба |
5 доба |
7 доба |
10 доба | |
|
Нейтрофільні лейкоцити, % |
93,25±0,30 |
78,61±0,37 |
70,78±0,59 |
54,38±0,51 |
|
З низ дегенеруючі форми, % |
75,29±0,49 |
46,37±0,59 |
25,88±0,46 |
8,59±0,45 |
|
Лімфоцити, % |
1,74± 0,07 |
6,75 ±0,18 |
7,24±0,20 |
8,85±0,24 |
|
Моноцити, % |
1,98±0,19 |
2,39±0,19 |
1,78±0,17 |
1,92±0,16 |
|
Макрофаги, % |
2,03 ±0,08 |
6,99±0,10 |
9,51±0,26 |
12,28±0,33 |
|
Фібробласти, % |
0 |
5,30±0,19 |
10,69±0,39 |
22,71 ±0,43 |
|
Активність фагоцитозу, % |
20,18±0,58 |
31,98±0,68 |
52,01 ±0,77 |
35,56±0,70 |
Висновки
Отримані результати цитологічного дослідження ранового вмісту хворих, комплексне лікування яких передбачало місцеве використання комбінації препаратів ліастену та левомеколю, в динаміці відрізнялись активнішим зменшенням кількості нейтрофільних гранулоцитів та їх деструктивних форм, більш ранньою появою макрофагів та молодих клітин грануляційної тканини, швидшим зміщенням цитограми в бік регенеративно-запального типу у порівнянні з результатами, отриманими у пацієнтів контрольної групи. Описана цитологічна картина вказує на позитивний вплив запропонованої комбінації препаратів на процеси очищення та загоєння рани.
Література
- 1. Александер Дж. У., Гуд Р. Р. (1974) Иммунология для хирургов. (Москва). "Медицина". 191 с. 2. Балтайтис Ю. В., Войтенко А. О. (1996) Отчет о клиническом исследовании нового лекарственного препарата иммуномодулятора "Лиастен". (Киев). 20 с. 3. Васина Т. А., Булава Г. В., Меньшиков Д. Д., Хватов В. Б. (1998) Этиотропная агтибиотико - и иммунотерапия больных с гнойно-воспалительными процессами. Антибиотики и химиотерапия. 11: 28-33 4. Велігоцький М. М., Бугаков І. Є. (2012) Сучасні методи в лікуванні хворих з гнійними рановими процесами. Український журнал хірургії. 1: 22-23 5. Веселов А. Я. (1990) Микрофлора гнойно-воспалительных очагов хирургических больных и чувствительность ее к антибиотикам. Антибиотики и химиотерапия. 1: 40-43 6. Винник Ю. С., Маркелова Н. М., Тюрюмин В. С. (2013) Современные методы лечения гнойных ран. Сибирский медицинский обозреватель. 1: 18-24 7. Даценко Б. М. (1995) Теорія та практика місцевого лікування гнійних ран. (Київ). "Здоров'я". 384 с. 8. Зайков С. В., Пликанчук О. В. (2010) результати лікування хворих з вперше діагностованим деструктивним туберкульозом легень при застосуванні імуномодулятора мурамілпептидного ряду. Український пульмонологічний журнал. 3: 30-32 9. Зайков С. В. (2006) Лиастен: новый оригинальный иммуномодулятор. Еженедельник АПТЕКА 562; 41: 12 10. Земсков А. М., Земсков В. М., Токмаков А. И. (2011) Клиническая эффективность применения иммунотропных препаратов при гнойных инфекциях. Хирургия. Журнал им. Н. И. Пирогова. 2: 4-10 11. Зорина В. В., Николаева Т. Н., Шаповалова О. В. (2006) Влияние бактерий рода Lactobacillus на миграционную активность макрофагов. Журнал микробиологии, эпидемиологии и иммунобиологии. 6: 40-44 12. Кризина П. С. (2007) Нові лікарські засоби широкого спектру дії на основі нанодисперсних феромагнетичних порошків для місцевого лікування ран. Україна. Здоров'я нації. 3-4: 188-190 13. Пинегин Б. В. (2000) Принципы применения иммуномодуляторов в комплексном лечении инфекционных процессов. 8: 2-10 14. Покровская М. П., Макаров М. С. (1942) Цитология раневого экссудата как показатель процесса заживления раны. (Москва). "Медгиз". 48 с. 15. Снимщикова И. А., Халилов М. А., Медведев А. И., Новикова Е. П., Гострый А. В. (2008) Современные подходы к диагностике и лечению гнойно-воспалительных заболеваний и раневой инфекции. Вестник РГМУ. 4: 95-98 16. Чадаев А. П., Нурписов А. М. (2004) Иммуномодуляторы Иммуномакс и Гепон в комплексном лечении острой гнойной хирургической инфекции в эксерименте и клинике. Антибиотики и химиотерапия. 7: 9-16 17. Шмагель К. В., Зубарева Н. А., Ренжин А. В. (2010) Местный иммунитет гнойных ран. Медицинская иммунология. 12; 4-5: 393-398 18. Шпилевая С. И., Тарутинов В. И., Мосиенко В. С., Рогац - кая В. П., Пономарев И. О., Шинкаренко Л. И., Чехун В. Ф. (2000) Коррекция лейкопении с помощью нового пробиотического иммуномодулятора (продукт Lactobacillus Delbrueckii) в комбинированном лечении больных раком молочной железы. Онкология. 2; 1-2: 83-86 19. Шувалов С. М., Рибалко С. Л., Даниленко В. П., Ісакова Н. М. (2003) Експериментальне обгрунтування комплексного застосування антибіотика та імуномодулятора при лікуванні хворих на гнійно-запальні процеси щелепно-лицевої ділянки. Вісник стоматології. 4: 45-47 20. Pollock A. (1991) Immunology in surgical practice. London. Taylor &; Francis. 448 p. 21. Falanga V., Isaacs C., Paquette D., (2002) Wounding of bioengineered skin: cellular and molecular aspects after injury. Journal of Investigative Dermatology. 119; 3: 653-660
Похожие статьи
-
Постановка проблеми і аналіз останніх досліджень та публікацій. Хірургічне лікування ускладнених форм синдрому діабетичної стопи (СДС) становить...
-
Автодермопластика та вакуумна терапія ран у хворих на синдром діабетичної стопи
На сучасному етапі хірургічне лікування гнійно-некротичних уражень нижніх кінцівок у хворих на цукровий діабет (ЦД) залишається актуальною і не до кінця...
-
Біоадаптивне управління (англ. biofeedback -- біологічний зворотний зв'язок (БЗЗ)) -- перспективний напрям сучасної медицини. Це нефармакологічне...
-
Серед різних з'єднань ртуті найбільшу популярність одержали наступні з'єднання. Двохлориста ртуть (Hg CI 2), або сулема . В чистому вигляді являє собою...
-
У пацієнтів з комплексною парціальною епілепсією із вторинними генералізованими судомами вміст лептину в сироватці крові після впливу транскраніальними...
-
Постановка проблеми і аналіз останніх досліджень та публікацій . Геморой все ще залишається одним із найпоширеніших захворювань людини. За даними ряду...
-
Підходи до лікування 1. Замісна інсулінотерапія; 2. Симптоматична терапія, лікування ускладнень; 3. Пероральні цукрознижувальні засоби [20]....
-
Завданнями ЛФК у ранньому післяопераційному періоді є: -- профілактика можливих загальних ускладнень (гіпостатична пневмонія, атонія кишечнику, тромбози...
-
Ключові слова: обміну речовин хвороби, кверцетин, черезшкірне коронарне втручання, ішемічна хвороба серця. Ішемічна хвороба серця (ІХС) за наявності...
-
Микроскопический метод исследования предусматривает наблюдение за живыми и убитыми микробами в окрашенном и неокрашенном состоянии. Различают простые и...
-
Клініко-фізіологічне обгрунтування Після операції у хірургічних хворих виникають розлади, зумовлені як самим захворюванням, так і порушеннями в...
-
За допомогою лазерної доплерівської флоуметрії оцінено стан мікрогемодинаміки та ендотеліальної функції у хворих із хронічною ішемією нижніх кінцівок на...
-
Пасифлора інкарнатна (Passiflora incarnata) містить флавоноїди (вітексин, сапонарін, віценін тощо), мальтол, кумарини, ціаноглікозиди, алкалоїди( гармін...
-
Виготовлено експериментальні зразки інактивованої концентрованої вакцини проти інфекційного ринотрахеїту великої рогатої худоби для внутрішньошкірного...
-
Цукровий діабет 2 типу (ЦД 2) характеризується значними гормонально-метаболічними зрушеннями, які охоплюють практично всі ланки обміну речовин в...
-
Застосування Біоспорин-форте у комплексі лікування на тлі антибіотикотерапії
Основним фактором захисту макроорганізму людини від агресивної дії екзогенної мікрофлори є колонізаційна резистентність біотопів природних порожнин тіла,...
-
Резюме. Проблема внутрішньоутробної інфекції (ВУІ) і в наш час не втрачає своєї актуальності. Неефективність лікування цієї патології пов'язана з...
-
Высушивание мазка, Фиксация мазка, Окраска препаратов - Изучение морфологии микроорганизмов
Мазок высушивают на воздухе при комнатной температуре. В случае необходимости его можно высушить около пламени горелки, держа стекло в горизонтальном...
-
Паспортна частина, Суб'єктивне обстеження - Хронічний бронхіт, фаза загострення
Прізвище, ім'я, по батькові: Тернадський Сергій Григорович Рік народження: 1966 Стать: Чоловіча Місце проживання: м. Вінниця, вул. Данила Нечая 64/7...
-
Аналіз клінічного випадку - ВІЛ-інфекція у дітей
Під час написання цієї роботи, я відвідала Центр інфекційних захворювань "Клініка для лікування дітей, хворих на ВІЛ/СНІД" НДСЛ "Охматдит". Було...
-
Лікування - ВІЛ-інфекція у дітей
Сьогодні в якості лікування ВІЛ-інфекції використовують антиретровірусну терапію, що спрямована на пригнічення репродукції ВІЛ. Варто зазначити, що на...
-
Механізм дії амізону - Алергічні реакції організму
Застосування при герпетичний кератит, аденовірусний кон'юнктивіт та кератокон'юнктивіт. Тактивін, тималін - препарати тимусу свиней та вилочкової залози...
-
Фактори ризику зниження захисних механізмів дихальних шляхів у підлітків
Тютюнопаління - лідер з усіх причин смерті, яким можна запобігти. Відомо, що кожні шість секунд від тютюнозалежних хвороб у світі помирає одна людина...
-
Імунний дисбаланс у патогенезі абдомінального сепсису при деструктивному панкреатиті
Постановка проблеми і аналіз останніх досліджень та публікацій. Абдомінальний сепсис (АС), за даними численних наукових досліджень, залишається одним із...
-
Загальна характеристика засобів фізичної реабілітації при хронічному пієлонефриті, гломерулонефриті Серед основних видів не медикаментозних методів...
-
У статті проведено дослідження патогенетичних факторів формування діабетичної стопи, що обгрунтовують необхідність комплексного підходу до лікування....
-
Вплив наночастинок ловастатину на остеорегенерацію при травматичному кістковому дефекті у щурів
ВПЛИВ НАНОЧАСТИНОК ЛОВАСТАТИНУ НА ОСТЕОРЕГЕНЕРАЦІЮ ПРИ ТРАВМАТИЧНОМУ КІСТКОВОМУ ДЕФЕКТІ У ЩУРІВ Панасюк Я. В., Корда М. М. Резюме. При травматичному...
-
Ад'ювантні лікарські засоби - Паліативна допомога при синдромі хронічного болю
Наведені нижче ад'ювантні лікарські засоби можуть або розширювати діапазон дії аналгетиків, або мати самостійну аналгетичну дію. Трициклічні...
-
"Трактат про хірургію та інструменти" - Абу аль Касим аль Захраві та його роль в медицині
У порівнянні з хірургією античності Аль - Захраві зробив великий крок вперед. До його пріоритетів відносять : застосування кетгуту в абдомінальній...
-
Лікування ревматизму - Ревматизм
Усі хворі з гострою ревматичною лихоманкою повинні бути госпіталізовані для уточнення діагнозу, ознайомлення із сутністю захворювання і початкового...
-
Зміни вмісту пролактину при метаболічному синдромі в період менопаузи
ВСТУП Метаболічний менопауза пролактин жінка У зв'язку зі збільшенням тривалості життя населення актуальною проблемою є діагностика, профілактика і...
-
Лекарственные препараты - Аллергия
Некоторые лекарственные препараты обладают свойством блокировать действие медиаторов аллергии, предотвращая активацию клеток и процесс дегрануляции. К...
-
Препарат Мастодинон® обладает допаминергическим действием, благодаря чему снижается секреция пролактина аденогипофизом, нормализуется продукция...
-
Україна за підсумком 2014 року експортувала 27 млн ??тонн зернових вантажів. Експорт цих вантажів відбувається через морські порти (95%), з...
-
Для визначення ефективності занять лікувальної гімнастики, відпустці процедур лікувального масажу і фізіотерапії на організм хворих на хронічний...
-
Дополнительные бронходилятаторы (препараты второй линии) - Оценка тяжести обострения
Холинолитики эффективны в связи с повышенным вагусным тонусом при обострении астмы. Комбинация В2-агонистов с холинолитиками (дополнительное назначение...
-
В распоряжении клиницистов имеется несколько препаратов, эффективно стимулирующих сердце и оказывающих мощное влияние на сосуды. В повседневной практике...
-
Вступ Постановка проблеми і аналіз останніх досліджень та публікацій. Одним з основних генетично детермінованих механізмів, які можуть суттєво впливати...
-
Состав ферментных препаратов - Ферменты в гастроэнтерологии
При нарушении пищеварения применяются различные лекарственные средства, содержащие ферменты. В зависимости от состава ферментные препараты можно...
-
Екстракт пасифлори протипоказаний при стенокардії, інфаркті міокарда, вираженому атеросклерозі. Не можна поєднувати з прийомом...
Зміни цитологічної картини ранового вмісту на тлі місцевого застосування комбінації препаратів ліастен та левомеколь у хворих з гнійними ранами