Відношення кортизол/дгеа та показники ліпідного профілю сироватки крові хворих на цукровий діабет 2 типу з різним індексом вісцерального ожиріння
Цукровий діабет 2 типу (ЦД 2) характеризується значними гормонально-метаболічними зрушеннями, які охоплюють практично всі ланки обміну речовин в організмі. Ці порушення розвиваються на основі зниженої чутливості до інсуліну периферичних тканин, або інсулінорезистентності, у зв'язку з чим даний стан отримав назву інсулінорезистентного синдрому (ІРС). Часто вживають термін "метаболічний синдром" (МС), який позначає комплекс чинників ризику серцево-судинних захворювань, таких як ожиріння, дисліпідемія, порушення вуглеводного обміну. До цих чинників останнім часом долучають порушення обміну білків, пуринів та дисбаланс гормонів і гормонально-активних біосполук [1].
Відомо, що розвитку ІРС та ЦД 2 сприяють неправильний спосіб життя, надмірне харчування, а також зовнішні токсичні речовини та гострі і хронічні стреси. Серед причин діабету розрізняють внутрішні та зовнішні патогенетичні фактори. До внутрішніх факторів належать: спадкові генетичні дефекти, гормональний дисбаланс, метаболічні порушення, деякі захворювання, вікові зміни, оксидативний стрес, мутації ядерних і мітохондріальних ДНК, апоптоз, зниження кількості стовбурових клітин. Зовнішні фактори: кліматичні, забруднення середовища, токсини, хімічні фактори, куріння, ультрафіолетове, електромагнітне, радіоактивне випромінювання, неповноцінне харчування, дефіцит вітамінів і мінеральних компонентів, психоемоційний стрес [2-5].
Наявність стресових факторів провокує включення неспецифічної реакції у вигляді загального адаптаційного синдрому, що призводить до маніфестації ЦД 2 у разі його латентного перебігу, а за генетичної схильності служить причиною виникнення захворювання. Зовнішні та внутрішні стресові впливи сприяють прояву низки несприятливих феноти - пів: аліментарно-кінетичного (включаючи ожиріння, інсулінорезистентність, дисліпідемію, прокоагуляційний і прозапальний статус), соціального (психоемоційні розлади), сексуального (розлади статевої сфери). Дані фенотипи, згідно з поглядами В. В. Корпачева, відповідають реалізації основоположних інстинктів людини: харчового (енергетичне забезпечення), соціального (самозбереження, образ і стиль життя) і відтворення, відповідно [6]. Реалізація цих фенотипів залежить від наявної комбінації зовнішніх та внутрішніх стресових факторів, які впливають на експресію або репресію відповідних генів, викликаючи стійкі епігенетичні модифікації.
Одним з найважливіших механізмів адаптації організму до стресу є активація симпато-адреналової та гіпоталамо-гіпофізарно-наднирникової систем, що проявляється підвищенням секреції ка - техоламінів і глюкокортикоїдів. Кортизол та адреналін - головні гормони, що забезпечують негайну відповідь на гострий стрес, відому як "бийся або біжи" ("fight-or-flight" response), постачаючи м'язи високоенергетичними субстратами для активної реакції. Хронічний стрес викликає аналогічні реакції, хоча і менш виразні. При цьому глюкокортикоїди підвищують рівень глюкози в крові, посилюють катаболізм жирів та білків. Швидкий ліполіз запасних ліпідів з виділенням в кров вільних жирних кислот як додаткового джерела енергії збільшує споживання кисню і протидіє анаболічним ефектам інсуліну, викликаючи периферичну інсулінорезистентність. При передозуванні препаратів глюкокортикоїдів або хворобі Іценко-Кушинга можуть розвинутись прояви позапанкреатичного "стероїдного діабету" [7-9].
Нормальна відповідь організму на будь-який стрес, одночасно з підвищенням продукції гормону стресу - кортизолу, включає синхронне посилення виділення адреналового прогормона - дегідроепіан-дростерону (ДГЕА), який згладжує деякі негативні ефекти кортизолу [10, 11]. ДГЕА розглядають як буферний стероїд, який циркулює в периферичній крові у вигляді ДГЕА-С та є природним антиглю-кокортикоїдом - антигормоном по відношенню до кортизолу. ДГЕА має слабку андрогенну активність і виступає попередником в системі синтезу статевих стероїдів. У периферичних тканинах гормон здатний перетворюватися в сильні андрогени - тестостерон і дигідротестостерон (через 5а-редуктазу) або естрогени (через Ароматазу). Під впливом ДГЕА вступають в дію декілька механізмів: збільшення чутливості до інсуліну; пригнічення глюкозо-6-фос - фатдегідрогенази (G6PD), що може модифікувати ліпідний спектр; пригнічення агрегації тромбоцитів; уповільнення росту клітин. Люди з низьким рівнем ДГЕА-С мають схильність до розвитку атеросклерозу і цукрового діабету [12, 13].
Реакцією на тривалий хронічний стрес може бути неадекватна адаптація, яка полягає у виділенні більшої кількості кортизолу і значно меншого - ДГЕА. Такий дисбаланс веде до цілого ряду пов'язаних зі стресом руйнівних метаболічних наслідків, в числі яких гіперглікемія, дисліпідемія, гіпотироїдизм, зниження загального обміну, накопичення абдомінального жиру, посилення катаболізму білків. Це може супроводжуватися гіпертензією, пригніченням імунної системи, неврологічними розладами, порушеннями в статевій і ментальної сфері, прискореним старінням, змінами кістково-хрящового і м'язового апарату. Той факт, що рівень ДГЕА помітно знижується з віком, посилює небезпеку стресів для літніх людей [14].
Інсулінорезистентність та компенсаторна гіперінсулінемія можуть бути відповідальними за мультигормональну дисрегуляцію при ЦД 2 та ІРС. Відомо, що паралельно наростанню інсулінорезистентності спостерігається підвищення рівня кортизолу і збільшення відношення кортизол/ДГЕА [4, 15]. При хронічному підвищенні рівня кортизолу організм тривало залишається в стані інсулінорезистентності, реакцією на що стає збільшення утворення інсуліну в підшлунковій залозі. Клітини, не отримуючи достатньо вуглеводів, піддаються стресу від нестачі енергії, стимулюють вироблення стресових гормонів, і коло замикається, приводячи до подальшого збільшення ІР і розвитку ЦД 2 типу [11, 13].
Обгрунтування дослідження
Відомо, що при ІРС та ЦД 2 значно страждає обмін ліпідів, що викликає порушення їх засвоєння, транспортування та утилізації для отримання енергії. Обмін ліпідів підлягає гормональній регуляції, в якій головну роль відіграють інсулін та адреналові гормони, разом із статевими та тиреоїдними гормонами. Кортизол підвищує активність ліпопротеїнліпази, головного жирозапасаючого ферменту. При цьому він також підвищує активність гормон-чутливої ліпази, головного ферменту, що вивільняє жирні кислоти з ТГ. Інсулін підвищує жиронакопичувальні властивості кортизолу і при цьому блокує його жироспалювальну функцію. Інсулін посилює активніст ь у вісцеральній жировій тканині ферменту 11-бета-гід - роксистероідегідрогенази (11-HSD), який перетворює неактивний кортизон в активний кортизол. Це веде до збільшення рівня кортизолу, який по т ім призводить до посилення резистентності до інсуліну. Інсулін і трийодтиронін (Т 3), а також статеві гормони збільшують утворення рецепторів ЛПНЩ, а глюкокортикоїди (в основному кортизол) - зменшують. Ефекти інсуліну і Т 3, ймовірно, можуть пояснити механізм гіперхолестеринемії і збільшення р и зику атеросклерозу при цукровому діабеті або гіпотиреозі [8, 12, 13].
Отже, в залежності від фенотипу організму, в патогенезі ІРС і ЦД 2 можуть брати участь як порушення аліментарно-кінетичної рівноваги, так і дисбаланс статевих стероїдів та дисрегуляція стресових і антистресових гормонів.
Для того, щоб оцінити несприятливий внесок кожного з цих чинників, важливо визначити, який з метаболічних фенотипів переважає у пацієнта. Найбільш поширеним підходом для визначення ризику ускладнень ІРС на практиці сьогодні залишаються визначення індексу маси тіла (ІМТ), обводу талії (ОТ), відношення обводу талії до обводу стегон (ОТ/ОС), а також визначення дисліпідемії (шляхом виміру в сироватці крові концентрації загального холестерину (ЗХС) і холестерину в окремих класах ліпопротеїнів). Проте ці методи не дозволяють кількісно оцінити співвідношення підшкірного та вісцерального жиру та не відбивають функціональних властивостей жирової тканини у цих депо.
Нещодавно був розроблений і почав використовуватись в клініці новий метод для визначення дисфункції жирової тканини шляхом розрахунку індексу вісцерального ожиріння (ІВО) (Visceral Adiposity Index - VAI). Цей індекс використовує як антропометричні виміри (ІМТ, ОТ), так і метаболічні параметри (ТГ, ЛПВЩ), тобто одночасно враховує характер розподілу та функцію жиру, тобто дозволяє отримати інтегральну оцінку впливу чинників ІРС через головні показники обміну ліпідів. Показано, що ІВО, на відміну від попередніх сурогатних маркерів, добре корелює зі ступенем ін - сулінорезистентності, кардіометаболічним ризиком та ЦД 2 типу [15, 16]. Проте, для диференційного встановлення провідного фенотипу у пацієнта, цей індекс доцільно доповнити дослідженням адреналових гормонів, які характеризують катаболічну спрямованість метаболізму.
Мета дослідження
Вивчення взаємозв'язків між характером розподілу жиру в організмі хворих на ЦД 2 типу (визначеним за показником ІАО), співвідношенням стресових/ антистресових гормонів та показниками ліпідного комплексу сироватки крові хворих на ЦД 2 типу.
Матеріали та методи
Обстежено 19 хворих на ЦД 2 типу віком більше за 50 років, з них 10 жінок і 9 чоловіків, які обстежувались у відділенні вікової ендокринології та клінічної фармакології ДУ "Інститут ендокринології та обміну речовин ім. В. П. Комісаренка НАМН України". Хворі отримували пероральну цукрознижуючу терапію і знаходились у стані компенсації або субкомпенсації.
У пацієнтів вимірювались: маса тіла, зріст, об'єм талії та стегон (ОТ і ОС), розраховувався індекс маси тіла (ІМТ, кг/м 2) за формулою: ІМТ=маса тіла (кг)/зріст 2 (м 2). Для оцінки стану вуглеводного обміну визначали концентрацію глюкози у капілярній крові пацієнтів за допомогою електрохімічного методу з використанням глюкометру "One Touch Ultra", натще та постпрандіально протягом дня. Рівень глікованого гемоглобіну (HbA1c) досліджували імунотурбідіметричним методом, С-пептиду, кортизолу, дегідроепіандростерону сульфату (ДГАЕ-С) оцінювали за даними аналізів, виконаних методом імуноферментного аналізу.
Стан ліпідного обміну у обстежених пацієнтів оцінювали за допомогою методу гомогенної ензиматичної колориметрії за рівнем в сироватці крові показників ліпідного спектру: загального холестерину (ЗХС), нормальні величини 3,0-6,0 ммоль/л; триглі - церидів (ТГ), норма 0,4-1,53 ммоль/л; холестерину ліпопротеїнів низької щільності (ЛПНЩ), середній нормальний рівень <3,37 ммоль/л; холестерину ліпопротеїнів високої щільності (ЛПВЩ), норма 1,031,81 ммоль/л [17].
Індекс вісцерального ожиріння (ІВО) обчислювали за формулами для чоловіків і жінок [15]:
Males: VAI =г WC Л F TG f 1.31 Л
= v 39.68 + (1.88 х BMI) JX^ 1.03 HDL J,
Females: VAI =
= г WC Л f TG Л f 1.52 Л
= v 36.58 + (1.89 X BMI) JX^ 0.81 J v HDL J'
Статистичну обробку результатів проводили за допомогою стандартного пакету аналізу "Excell" з використанням критерію Ст'юдента. Різницю показників між групами та коефіцієнти кореляції вважали достовірними при Р<0,05. Величина показника 0,05<Р<0,1 свідчила про наявність тенденції до вірогідності розходжень значень показників, що порівнювались. При величинах коефіцієнту кореляції Пірсона r<0,25 кореляцію вважали слабкою, при 0,25<r<0,75 - помірною, при r>0,75 - сильною. Нормальність розподілення отриманих результатів перевіряли за допомогою критерію Шапіро-Уілка [18].
Результати дослідження
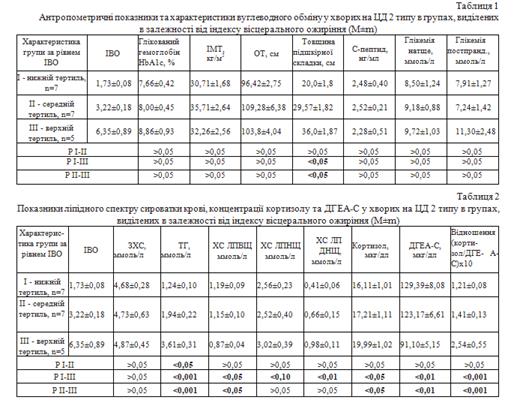
Порівняння клініко-лабораторних показників у обстежених хворих на ЦД 2 типу різної статі на виявило між групами чоловіків і жінок не вірогідної різниці з жодного з досліджуваних загально-клінічних, антропометричних, метаболічних і гормональних показників, у тому числі показників ліпідного спектру та рівнів кортикостероїдів (Р>0,05, дані не наведені). Значення ІВО між групами чоловіків і жінок також не мали достовірної різниці, становлячи відповідно 3,09±0,67 та 3,86±0,71 (Р>0,05). Це дало підставу далі розглядати об'єднані групи пацієнтів різної статі.
Обстежених хворих на ЦД 2, після ранжування за рівнем ІВО, було розділено на три групи (тертилі):
I групу (нижній тертиль) склали 7 хворих (5 чоловіків і 2 жінки) з відносно низькими значеннями ІВО, у межах від 1,39 до 1,91 (1,73±0,08; медіана 1,86);
II групу (середній тертиль) - 7 хворих (2 чоловіки і 5 жінок) з середніми значеннями ІВО, які знаходились у межах від 2,46 до 3,77 (3,22±0,18; медіана 3,02);
ІІІ групу (верхній тертиль) - 5 хворих (2 чоловіки і 3 жінки) з високими значеннями ІВО, від 4,25 до 9,01 (6,35±0,89; медіана 6,22).
Між розглянутими групами пацієнтів не спостерігалось достовірної різниці за показниками ІМТ і ОТ (табл. 1), хоча ці показники входять до формули розрахунку ІВО. Також між групами пацієнтів не було достовірної різниці за станом компенсації вуглеводного обміну: рівнів глікемії натще і постпрандіально, глікованого гемоглобіну, рівнів С-пептиду (як характеристики інсуліносекреторної функції підшлункової залози).
У ІІ і ІІІ групах відзначено збільшення товщини шкірної жирової складки (ТЖС) порівняно з І групою (табл. 1), що позначає збільшення товщини підшкірного жиру, без зростання абдомінального жиру у порівнянні з іншими групами.
У обстежених хворих спостерігались характерні для ЦД та ІРС підвищення рівнів ТГ і зниження ЛПВЩ, без помітного підвищення рівня ЛПНЩ (табл. 2).
Обговорення результатів
Для оцінки стану ліпідного обміну у пацієнтів різних груп ми проаналізували ліпідний спектр сироватки крові. Відомо, що різні фракції ліпопротеїнів в сироватці крові виступають транспортною формою ліпідних сполук, зокрема триацилгліцеридів, які доставляють жирні кислоти до місць їх споживання. Отримані результати щодо змін показників ліпідного спектру у хворих з різним рівнем ІВО, зокрема підвищення загальної концентрації ТГ, відбивають функціональні зрушення, які стосуються процесів транспорту та утилізації жирних кислот в організмі. Чим вище рівень в крові ТГ, тим значнішим є порушення активного рецепторного поглинання клітинами головних енергетичних субстратів - насичених та ненасичених жирних кислот у складі ЛПДНЩ, і тим вище небезпека енергетичного голодування периферичних тканин.
Це спостереження доповнює раніше отримані нами дані про те, що більш високі значення ІВО у тих же групах хворих на цукровий діабет 2 типу (верхній тертиль) асоціювались з найбільш виразними змінами жирнокислотного спектру фракції тригліцеридів сироватки крові, за рахунок збільшення частки пальмітинової С 16.0 і стеаринової С 18.0 ЖК і зниження вмісту ненасичених ЖК (олеїнової С№1 і лінолевої С 18.2). Оскільки ненасичені жирні кислоти вважаються більш ефективним, ніж насичені ЖК, субстратом для бета-окислення, зниження їх частки у складі фракції ТГ свідчить про погіршення енергетичного статусу периферичних тканин.
У групах хворих І-ІІІ при збільшенні ІВО виявлено вірогідне підвищення в сироватці крові концентрації ТГ, зниження рівня ЛПВЩ, і тенденцію до збільшення ЛПНЩ і ЛПДНЩ. Рівні ЗХС і ЛПНЩ у всіх трьох досліджуваних групах хворих були приблизно однаковими (Р>0,05) та залишались у межах референтних значень.
Підвищення рівня ТГ, разом зі зниженням рівня антиатерогенної фракції холестерину - ЛПВЩ, асоціюються з порушенням енергетичного та ліпідного гомеостазу в організмі та підвищеним ризиком серцево-судинних ускладнень. Звідси випливає, що індекс ІВО, включаючи до розрахунку дані ліпідні параметри, є чутливим до їх зміни як покажчик ризику ІРС та ССЗ, незалежно від показників ІМТ та ОТ.
Той факт, що у осіб з більш високим ІВО спостерігався вищий рівень ТГ та їх основної транспортної форми - ЛПДНЩ, може відображати сповільнення поглинання і засвоєння клітинами жирних кислот, які переносяться цими ліпідними фракціями.
В плазмі крові, під впливом ендотеліальної ліпопротеїнліпази, триацилгліцериди у складі ЛПД - НЩ перетворюються на ЛПНЩ - транспортну форму холестерину та ненасичених жирних кислот від печінки до органів і тканин. Підвищення рівня ЛПДНЩ в циркуляції свідчить про погіршення захоплення клітинами холестерину, необхідного для потреб формування мембран і стероїдогенезу, а також про дефіцит есенціальних поліненасичених жирних кислот. Цей дефіцит, згідно з сучасними поглядами, може бути підгрунтям процесів атерогенезу [3].
Оскільки холестерин в крові знаходиться, головним чином, у складі ЛПНЩ, відсутність підвищення рівнів та значної різниці концентрацій ЗХС та ХС ЛПНЩ між розглянутими нами групами можна вважати взаємопов'язаними. Цей зв'язок проявлявся у виявлених нами кореляціях між ЗХС та ЛПНЩ.
Визначення концентрацій стресового гормону кортизолу і "антистресового" - ДГЕА-С показало відмінність цих показників між групами хворих з різними рівнями ІВО. За умов практично незмінної в усіх групах концентрації С-пептиду, можна припустити, що більш високий індекс ІВО спостерігався у хворих, у яких більше проявлялись несприятливі ефекти порушеного відношення кортизол/ДГЕА на метаболізм ліпідів.
З підвищенням тертиля ІАО спостерігалось збільшення концентрації кортизолу з одночасним зниженням ДГЕА, внаслідок чого відношення кортизол ДГЕА достовірно підвищувалось у ІІ і ІІІ групах порівняно з І групою хворих. Відношення кортизол / ДГЕА в ІІІ групі мало максимальне значення, достовірно більше за таке у І і ІІ групах.
Кореляційний аналіз показав зміну характеру взаємозв'язку між рівнями кортизолу та ДГЕА зі збільшенням ІВО. Якщо в І групі між цими показниками відзначено помірну пряму кореляцію (r=0,33; P<0,05), то в ІІІ групі виявлялась сильна зворотна кореляція (r=-0,88; P<0,05).
Аналогічна картина спостерігалась щодо зв'язків відношення кортизол/ДГЕА та ТГ: у той час, як в І групі виявлено помірну пряму кореляцію між цими показниками (r=0,64; P<0,05), у ІІІ групі ці кореляції змінювались на зворотні (r=-0,55; P<0,05).
У ІІ і ІІІ групах виявлено помірну пряму кореляцію ТЖС з рівнем кортизолу (r=0,61 і 0,62 відповідно, Р<0,05). Крім того, у групі ІІІ мала місце зворотна кореляція між ТЖС та рівнем ДГЕА-С (r=--0,52, Р<0,05), на відміну від І групи хворих. Також виявлено сильні прямі кореляційні зв'язки між рівнями ЗХС та ЛПНЩ у хворих ІІ, ІІІ груп (r=0,83 та r=0,85 відповідно). Виявлені зміни характеру взаємозв'язку між рівнями кортизолу та ДГЕА у групах хворих з різним значенням ІВО можуть вказувати на те, що у хворих при нижчих значеннях ІВО зберігався близький до фізіологічного прямий зв'язок між рівнями кортизолу та ДГЕА, а при високих ІАО відбувався патологічний кількісний перерозподіл цих гормонів.
Виявлення взаємозв'язків між незалежними показниками, що характеризують ліпідний обмін та баланс кортикоїдних гормонів, відображає той факт, що вони знаходяться у певних взаємовідношеннях, хоча важко говорити про первинність або вторинність змін цих чинників. Відомо, що кортизол збільшує активність ліпопротеїнліпази (ЛПЛ), сприяючи перетворенню ЛПДНЩ на ЛПНЩ. Одночасно кортизол знижує утворення рецепторів ЛПНЩ, гальмуючи залежне від апо-В поглинання ЛПНЩ клітинами та елімінацію холестерину з кровотоку [19]. Кортизол як антагоніст інсуліну також підвищує активність гормон-чутливої ліпази, яка вивільняє жирні кислоти з депонованих ТГ, а циркуляція вільних ЖК викликає ІР гепатоцитів та інших тканин [2]. За умов зниження рівня "антикортизолового" гормону ДГЕА, негативні ефекти кортизолу лише посилюються [13]. Дані впливи на ліпідний обмін, поряд зі стимулюванням катаболізму білків та утворення глюкози з амінокислот, можуть пояснювати несприятливу дію виявленого нами підвищення збільшення відношення кортизол/ДГЕА на ліпідні показники у пацієнтів ІІІ групи.
Отже, при виявленні у пацієнта високих показників ІАО (>4) у поєднанні з високим відношенням кортизол/ДГЕА, можна допустити, що порушення балансу стресових і антистресових глюкокортикоїдів може бути провідною причиною змін ліпідного і вуглеводного обміну. Відповідно до цього, до лікування таких пацієнтів доцільно включити засоби впливу на даний патогенетичний механізм, що потребує дальших досліджень.
Висновки
- 1. У хворих на ЦД 2 типу з високим ІАО виявлено збільшення відношення кортизол/ДГЕА, за відсутності значного підвищення секреції інсуліну (невисокий рівень С-пептиду). 2. Індекс вісцерального ожиріння корелював із відношенням кортизол/ДГЕА та рівнем ЛПДНЩ. При цьому у групах хворих з низьким і високим ІВО виявлено різний характер кореляційних взаємозв'язків між величиною ІВО та рівнями кортизолу, ДГЕ - А-С, відношення кортизол/ДГЕА. 3. Індекс ІВО, на відміну від показників ІМТ та ОТ, є більш чутливим показником для оцінки параметрів загального та абдомінального ожиріння, порушення ліпідного спектру та балансу кортикостероїдів у хворих на ЦД 2.
Література
- 1. Geetha, L. Prevalence and Clinical Profile of Metabolic Obesity and Phenotypic Obesity in Asian Indians [Text] / L. Geetha, M. Deepa, R. M. Anjana, V Mohan // Journal of Diabetes Science and Technology. - 2011. - Vol. 5, Issue 2. - P. 439446. doi: 10.1177/193229681100500235 2. Титов, В. Н. Атеросклероз - проблема общей биологии: нарушение биологических функций питания и эндоэкологии [Текст] / В. Н. Титов // Успехи современной биологии. - 2009. - Т. 129, № 2. - С. 124-143. 3. Титов, В. Н. Статины, холестерин, жирные кислоты и сахарный диабет [Текст] / В. Н. Титов // Научный диалог. - 2013. - № 3 (15). - С. 148-183. 4. Aronson, D. Cortisol - Its Role in Stress, Inflammation, and Indications for Diet Therapy [Text] / D. Aronson // Today's Dietitian. - 2009. - Vol. 11, Issue 11. - P. 38. 5. Jablonka, E. Transgenerational epigenetic inheritance: prevalence, mechanisms, and implications for the study of heredity and evolution [Text] / E. Jablonka, G. Raz // The Quarterly Review of Biology. - 2009. - Vol. 84, Issue 2. - P. 131-176. doi: 10.1086/598822 6. Корпачев, В. В. Эволюция взглядов в диабетологии [Текст] / В. В. Корпачев, О. В. Корпачева-Зиныч. - К: Книга-плюс, 2011. - 224 с. 7. Bauer, M. E. Glucocorticoids and DHEA: Do they have a role in immunosenescence? [Text] / M. E. Bauer, C. M. M. Jeck - el, C. Bonorino, F. Ribeiro, C. Luz. - Handbook on Immunosenescence. - Springer Science, 2009. - P. 833-862. doi: 10.1007/978- 1-4020-9063-9_43 8. Hughes, K. A. Recycling Between Cortisol and Cortisone in Human Splanchnic, Subcutaneous Adipose, and Skeletal Muscle Tissues In Vivo [Text] / K. A. Hughes, K. N. Manol - opoulos, J. Iqbal, N. L. Cruden, R. H. Stimson, R. M. Reynolds et. al // Diabetes. - 2012. - Vol. 61, Issue 6. - P. 1357-1364. doi: 10.2337/db11-1345 9. Gross, K. L. Tissue-specific glucocorticoid action: a family affair [Text] / K. L. Gross, J. A. Cidlowski // Trends in Endocrinology &; Metabolism. - 2008. - Vol. 19, Issue 9. - P. 331339. doi: 10.1016/j. tem.2008.07.009 10. Buford, T. W. Impact of DHEA(S) and cortisol on immune function in aging: a brief review [Text] / T. W. Buford, D. S. Willoughby // Applied Physiology, Nutrition, and Metabolism. - 2008. - Vol. 33, Issue 3. - P. 429-433. doi: 10.1139/h08-013 11. Phillips, A. C. Cortisol, DHEA sulphate, their ratio, and all-cause and cause-specific mortality in the Vietnam Experience Study [Text] / A. C. Phillips, D. Carroll, C. R. Gale, J. M. Lord, W. Arlt, G. D. Batty // European Journal of Endocrinology. - 2010. - Vol. 163, Issue 2. - P. 919-923. doi: 10.1530/ eje-10-0299 12. McNelis, J. C. Dehydroepiandrosterone exerts antiglucocorticoid action on human preadipocyte proliferation, differentiation and glucose uptake [Text] / J. C. McNelis, K. N. Manolopou - los, L. L. Gathercole, I. J. Bujalska, P. M. Stewart, J. W. Tomlinson, W. Arlt //AJP: Endocrinology and Metabolism. - 2013. - Vol. 305, Issue 9. - P. E1134-E1144. doi: 10.1152/ajpendo.00314.2012 13. Ohlsson, C. Low serum levels of dehydroepiandros - terone sulfate predict all-cause and cardiovascular mortality in elderly Swedish men [Text] / C. Ohlsson, F. Labrie, E. Bar - rett-Connor, M. K. Karlsson, O. Ljunggren, L. Vandenput et. al // The Journal of Clinical Endocrinology &; Metabolism. - 2010. - Vol. 95, Issue 9. - P. 4406-4414. doi: 10.1210/jc.2010-0760 14. Davis, S. R. Dehydroepiandrosterone sulfate levels are associated with more favorable cognitive function in women [Text] / S. R. Davis, S. M. Shah, D. P. McKenzie, J. Kulkarni, S. L. Davison, R. J. Bell // The Journal of Clinical Endocrinology &; Metabolism. - 2008. - Vol. 93, Issue 3. - P. 801-808. doi: 10.1210/jc.2007-2128 15. Amato, M. C. Study Group: Visceral adiposity index: a reliable indicator of visceral fat function associated with car - diometabolic risk [Text] / M. C. Amato, C. Giordano, M. Galia, A. Criscimanna, S. Vitabile, M. Midiri et. al // Diabetes Care. - 2010. - Vol. 33, Issue 4. - P. 920-922. doi: 10.2337/dc09-1825 16. Petta, S. Visceral adiposity index is associated with histological findings and high viral load in patients with chronic hepatitis C due to genotype 1 [Text] / S. Petta, M. Amato, D. Ca - bibi, C. Camma, V Di Marco, C. Giordano et. al // Hepatology. - 2010. - Vol. 52, Issue 5. - P. 1543-1552. doi: 10.1002/hep.23859 17. Творогова, М. Г. Методы определения холестерина липопротеидов низкой плотности [Текст] / М. Г. Творогова // Лабораторная медицина. - 2006. - № 7. - С. 29-37. 18. Кобзарь, А. И. Прикладная математическая статистика [Текст] / А. И. Кобзарь. - М.: Физматлит, 2006. - 238 с. 19. Toth, P. P. Cardiovascular risk in patients achieving low-density lipoprotein cholesterol and particle targets [Text] / P. P. Toth, M. Grabner, R. S. Punekar, R. A. Quimbo, M. J. Czira - ky, T. A. Jacobson // Atherosclerosis. - 2014. - Vol. 235, Issue 2. - P. 585-591. doi: 10.1016/j. atherosclerosis.2014.05.914
Похожие статьи
-
Цукровий діабет. Етіологія, патогенез, клініка захворювання Цукровий діабет Цукровий діабет -- стан хронічної гіперглікемії, обумовлений абсолютним або...
-
За допомогою лазерної доплерівської флоуметрії оцінено стан мікрогемодинаміки та ендотеліальної функції у хворих із хронічною ішемією нижніх кінцівок на...
-
У пацієнтів з комплексною парціальною епілепсією із вторинними генералізованими судомами вміст лептину в сироватці крові після впливу транскраніальними...
-
Вступ Постановка проблеми і аналіз останніх досліджень та публікацій. Одним з основних генетично детермінованих механізмів, які можуть суттєво впливати...
-
Автодермопластика та вакуумна терапія ран у хворих на синдром діабетичної стопи
На сучасному етапі хірургічне лікування гнійно-некротичних уражень нижніх кінцівок у хворих на цукровий діабет (ЦД) залишається актуальною і не до кінця...
-
Постановка проблеми і аналіз останніх досліджень та публікацій . Геморой все ще залишається одним із найпоширеніших захворювань людини. За даними ряду...
-
Біоадаптивне управління (англ. biofeedback -- біологічний зворотний зв'язок (БЗЗ)) -- перспективний напрям сучасної медицини. Це нефармакологічне...
-
Імунний дисбаланс у патогенезі абдомінального сепсису при деструктивному панкреатиті
Постановка проблеми і аналіз останніх досліджень та публікацій. Абдомінальний сепсис (АС), за даними численних наукових досліджень, залишається одним із...
-
На сьогодні в літературних джерелах існують повідомлення щодо певної діагностичної цінності специфічних білків плаценти як материнської, так і плодової...
-
Серед тахіаритмій, які можуть виникати у пацієнтів із серцевою недостатністю, найчастіше зустрічається фібриляція передсердь (ФП) [1, 3]. СН і ФП часто...
-
Клініко-фізіологічне обгрунтування Після операції у хірургічних хворих виникають розлади, зумовлені як самим захворюванням, так і порушеннями в...
-
Ключові слова: обміну речовин хвороби, кверцетин, черезшкірне коронарне втручання, ішемічна хвороба серця. Ішемічна хвороба серця (ІХС) за наявності...
-
Порушення кровообігу у великих судинах - Патофізіологія порушення периферичного кровообігу
Серед порушень кровообігу у великих судинах розрізняють: 1) артеріальну гіперемію, 2) венозну гіперемію або венозний застій, 3) ішемію, 4) стаз, 5)...
-
Патогенез - Класифікація рахіту
Фосфорно-кальцієвий обмін, що є безпосереднім фактором кісткового ремоделювання, забезпечується вітаміном D (гормоноподібною його формою), паратиреоїдним...
-
Класифікація рахіту - Класифікація рахіту
Рахіт - поліетіологічне (спровоковане різними причинами) порушення обміну речовин, що виникає через невідповідність високих потреб організму дитини в...
-
ТЕТРАДА ФАЛЛО - Вроджені вади серця у дітей
Найпоширеніша вада серця синього типу. Включає 4 ознаки: 1. стеноз легеневого стовбуру (вивідного відділу ПШ на різних рівнях); 2. гіпертрофію міокарда...
-
У даній роботі представлено сучасний стан проблеми щодо механізмів ураження шлунка у хворих на хронічну хворобу нирок (ХХН). Викладено сучасні погляди...
-
Ад'ювантні лікарські засоби - Паліативна допомога при синдромі хронічного болю
Наведені нижче ад'ювантні лікарські засоби можуть або розширювати діапазон дії аналгетиків, або мати самостійну аналгетичну дію. Трициклічні...
-
Тривало, майже протягом усього ХІХ і ХХ ст. і дотепер для нейропсихологічної діагностики ВПФ в англомовній літературі широко використовується тест Струпа...
-
Вплив наночастинок ловастатину на остеорегенерацію при травматичному кістковому дефекті у щурів
ВПЛИВ НАНОЧАСТИНОК ЛОВАСТАТИНУ НА ОСТЕОРЕГЕНЕРАЦІЮ ПРИ ТРАВМАТИЧНОМУ КІСТКОВОМУ ДЕФЕКТІ У ЩУРІВ Панасюк Я. В., Корда М. М. Резюме. При травматичному...
-
Різновиди гепатитів, Клінічні аспекти гепатитів - Структурно-функціональні особливості печінки
Тепер розглянемо саме розповсюджену з усіх печінкових хвороб Гепатит. Іноді початок гепатиту нагадує грип: з підвищенням температури тіла, головним...
-
Постановка проблеми і аналіз останніх досліджень та публікацій. Хірургічне лікування ускладнених форм синдрому діабетичної стопи (СДС) становить...
-
Гігієнічні аспекти проблеми ожиріння (огляд літератури)
Ожиріння - це медико-соціальна проблема, яка зумовлена сумісною дією таких факторів, як стан харчування, дотримання здорового способу життя, традицій у...
-
Відомо, що здоров'я дитини формується під комплексним впливом спадкової схильності та зовнішніх факторів, що постійно діють як чинники ризику і чинники...
-
Психопатологічні, патоперсонологічні та психосоціальні особливості хворих із професійною патологією органів дихання та периферичної нервової системи....
-
За даними генетичного моніторингу Соматометричні показники новонароджених несуть подвійну інформативність: ретроспективного характеру як індикатор...
-
Вступ Незважаючи на прогрес у розробці та удосконаленні існуючих методів лікування гнійних ран, ця проблема залишається пріоритетною в сучасній медичній...
-
Актуальність теми : у більшості розвинутих країн світу, в тому числі і в Україні, невпинно збільшується кількість дітей, що не отримують грудного молока....
-
Актуальність проблеми. Хронічний пієлонефрит - неспецифічне інфекційно-запальне захворювання нирок, при якому до процесу залучаються ниркова балія,...
-
Встановлено, що хірургічне лікування гриж міжхребцевих дисків поперекового відділу хребта нерідко пов'язане з недостатнім і суб'єктивним прогнозуванням,...
-
Как амарант используют в медицине, Польза амарантового масла - Рожденный в Южной Америке
Амарант активно добавляют в лекарственные препараты и используют в виде пищевого масла. Самыми частыми медицинскими показаниями к его употреблению в...
-
Алкоголь та його вплив на людину
1. Сучасні проблеми алкоголізму. Причини поширення алкоголю Люди давно навчились виготовляти спиртні напої. Початково їх вживання мало обрядовий...
-
Особливості проведення занять з лікувальної фізичної культури при гіпертонічній хворобі
Вступ Постановка проблеми. Гіпертонія - це найпоширеніша патологія в Україні, яка займає перше місце в структурі непрацездатності, інвалідності та...
-
1. Чай Гонсин Основні інгредієнти: Парагвайський чай (Ilex Paraguariensis); трава материнки звичайної (Origanum vulgare L.); насіння моркви дикої (Daucus...
-
Вміст стабільних метаболітів оксиду азоту та ендотеліну-1 при різних підтипах ішемічного інсульту
Оксид азоту (NO) відіграє важливу роль у контролі мозкового кровообігу, тромбоутворенні й модулює активність нейронів. NO є посередником у багатьох...
-
Аналіз клінічного випадку - ВІЛ-інфекція у дітей
Під час написання цієї роботи, я відвідала Центр інфекційних захворювань "Клініка для лікування дітей, хворих на ВІЛ/СНІД" НДСЛ "Охматдит". Було...
-
ДОСЛІДЖЕННЯ ВІЛ-ІНФЕКЦІЇ, Особливості ВІЛ-інфекції у дітей - ВІЛ-інфекція у дітей
Особливості ВІЛ-інфекції у дітей Надамо загальну характеристику ВІЛ-інфекції у дітей: ВІЛ-інфекція у дітей характеризується раннім та стрімким розвитком...
-
Діагностика - ВІЛ-інфекція у дітей
Існує декілька методів лабораторної діагностики ВІЛ-інфекції: імунологічні(в тому числі серологічні), вірусологічні, гематологічні, а також...
-
Метаболізм - обмін речовин, хімічні перетворення, що протікають від моменту надходження поживних речовин в живий організм до моменту, коли кінцеві...
-
Моніторинг та прогноз впливу інфраструктур водного транспорту на навколишнє середовище Актуальність проблеми формування систем оперативного контролю за...
Відношення кортизол/дгеа та показники ліпідного профілю сироватки крові хворих на цукровий діабет 2 типу з різним індексом вісцерального ожиріння