Комплексообразующие свойства тиосульфатов - Тиосульфат натрия
Тиосульфат-ион - сильный комплексообразователь, использующийся в фотографии для удаления из фотопленки невосстановленного бромида серебра:
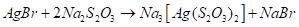
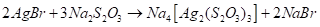
Отметим, что металлами S2O32- Ион координируется через атом серы, поэтому тиосульфатные комплексы легко превращаются в соответствующие сульфиды, например:
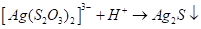
Существуют тиосульфатные комплексы многих металлов. В литературе описано наличие около 40 комплексных соединений со многими тяжелыми металлами. В наведены константы нестойкости комплексных ионов, где комплексообразующим ионом выступают атомы серебра, бария, кальция, кадмия, кобальта, меди, железа, ртути, марганца, магния, натрия, никеля, свинца, стронция и цинка. Для многих тяжелых металлов такие комплексные соединения являются чрезвычайно стойкими и с их помощью можно выводить тяжелые металлы из организма при отравлениях ими. Ниже, в таблице 2.1 приведены значения некоторых констант нестойкости комплексных ионов, которые содержат в своем составе ион тиосульфата:
Таблица 2.1. Значения констант нестойкости комплексных ионов
|
Формула иона |
Константа |
Формула иона |
Константа |
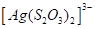
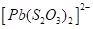
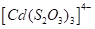
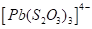
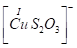
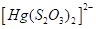
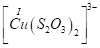
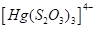
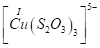
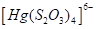
Из значений констант нестойкости комплексов можно сделать вывод, что особенно устойчивыми будут комплексы, которые включают ионы двухвалентной ртути, что можно использовать при отравлениях ею.
Похожие статьи
-
Тиосульфат натрия широко используется в быту и промышленности. Целью данной работы было рассмотреть использование тиосульфата натрия, методику его...
-
Применение тиосульфата натрия - Тиосульфат натрия
Тиосульфат натрия довольно широко применяется как в быту так и в промышленности. Основными областями применения тиосульфата натрия будут медицина,...
-
Получение тиосульфата натрия при мышьяково-содовой очистке газов - Тиосульфат натрия
В процессе очистки от сероводорода коксового и других промышленный газов мышьяково-содовым методом, помимо основной реакции: Протекают побочные реакции,...
-
Другие способы производства - Тиосульфат натрия
Среди других способов получения тиосульфата прежде всего следует обратить внимание на сероводородный способ, так как он. в отличие от описанных выше, не...
-
Химические свойства, Применение - Натрий: свойства и народнохозяйственное значение
Щелочной металл, на воздухе легко окисляется. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина. Натрий менее активный чем...
-
Полисульфидный способ - Тиосульфат натрия
Проводят за уравнением: Для приготовления раствора полисульфида Na2S2 используют горячий раствор сернистого натрия (70?С), обычно щелок, получае-мый...
-
Сульфидный способ - Тиосульфат натрия
Этим способом в раньше в СССР производили значительные ко-личества тиосульфата натрия. В настоящее время его производят другими способами. Применявшаяся...
-
Сульфитный способ - Тиосульфат натрия
Проводят согласно уравнению: Сульфитный способ получения тиосульфата натрия заключается в растворении тонкоизмельченной серы в горячем раствора сульфита...
-
История открытия тиосульфата натрия, Строение молекулы и ее влияние на свойства - Тиосульфат натрия
Имя и время открытия тиосульфата натрия нам не известны. Во всяком случае в истории химии об этом не упоминается. Но в конце XVII и в начале XVIII века,...
-
Введение, Свойства тиосульфата натрия, Общие свойства тиосульфата натрия - Тиосульфат натрия
Одним из довольно известных химических препаратов является тиосульфат натрия. Раньше о нем знал каждый фотограф и фотолюбитель. Но и на данное время...
-
В данной главе мы рассмотрим получение тиосульфата натрия. Поскольку тиосульфат натрия широко используется в медицине, промышленности, фотографии. То...
-
Оборудования, используемые для определения ртути Класс опасности - 1, ПДК в населенных пунктах (среднесуточная) -- 0,0003 мг/мі ПДК в жилых помещениях...
-
Физико-химические свойства ртути - Ртуть: свойства и токсичность
Ртуть (Hg) - химический элемент II группы периодической системы элементов Д. И. Менделеева; атомный номер 80, относительная атомная масса 200,59; в...
-
Рассмотрим химические свойства тиосульфата натрия. Изучим его окислительно-восстановительные свойства, взаимодействие с кислотами, комплексообразование....
-
ОСОБЫЕ СВОЙСТВА ЭЛЕМЕНТА И ЕГО СОЕДИНЕНИЙ, ИХ ПРИМЕНЕНИЕ. - Галлий
Не стоит брать этот элемент в руки - тепла человеческого тела достаточно, чтобы этот серебристый мягкий (его можно резать ножом) металл превратился в...
-
ФИЗИЧЕСКИЕ СВОЙСТВА, ХИМИЧЕСКИЕ СВОЙСТВА - Никель глазами химика
Металлический никель имеет серебристый цвет с желтоватым оттенком, очень тверд, вязкий и ковкий, хорошо полируется, притягивается магнитом, проявляя...
-
Физико-химические свойства кремния - Физические и химические свойства кремния
Кремний - это мелкий бурый порошок или серые, твердые, но довольно хрупкие кристаллы (пл. 2,4). В кристаллическом состоянии кремний хорошо проводит...
-
Химические свойства Галлия. - Третья группа периодической системы
На воздухе при обычной температуре Галлий стоек. Выше 260° С в сухом кислороде наблюдается медленное окисление (пленка оксида защищает металл). В серной...
-
Медицина - Серебро: основные свойства и роль в мировой культуре
Одной из важных сфер использования серебра являлась алхимия, тесно связанная с медициной. Уже за 3 тыс. лет до н. э. в Китае, Персии и Египте были...
-
Для неметаллов характерно существование газообразных соединений с водородом. У азота таким соединением является аммиак NH3, который состоит из атома...
-
АНАЛИТИКА Компиляция выдержек из различных источников - удельная б-активность U235 и U238 составляет соответственно 0,08 и 0,012 Бк/мкг (или 80 и 12...
-
Химические свойства меди - Медь
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро - и теплопроводности медь уступает...
-
Молекулярные кристаллы фуллеренов -- полупроводники, однако в начале 1991 г. было установлено, что легирование твердого С60 небольшим количеством...
-
Химические свойства, Физиологическое воздействие - Золото
Золото -- самый инертный металл, стоящий в ряду напряжений правее всех других металлов, при нормальных условиях оно не взаимодействует с большинством...
-
Получение, Изотопы, Физические свойства, Химические свойства - Краткие сведения о кобальте
Кобальт получают в основном из никелевых руд, обрабатывая их растворами серной кислоты или аммиака. Также используется методы пирометаллургии. Для...
-
Воздействие ртути на животных и человека - Ртуть: свойства и токсичность
Ртуть встречается в окружающей среде в различных химических формах и соединениях, характеризующихся различным уровнем токсичности. Наиболее опасными...
-
3. Физические свойства, Химические свойства - Золото
Чистое золото - мягкий металл желтого цвета. Красноватый оттенок некоторым изделиям из золота, например: монетам придают примеси других металлов, в...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
МЛЭ - один из современных и много обещающих технологических методов выращивания тонких монокристаллических полупроводниковых структур. Для осаждения...
-
Химические свойства Бора. - Третья группа периодической системы
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С...
-
Гибридные системы на основе квантовых точек (КТ) и органических лигандов могут быть использованы в качестве хемо-, био - и фотосенсоров, а также...
-
Принципы получения гибридных соединений на основе квантовых точек и органических хромофоров В литературе для получения соединений, обладающих...
-
На воздухе галлий устойчив при обычной температуре, так как покрывается, подобно алюминию, прочной оксидной пленкой. Выше 260 C в сухом кислороде...
-
Введение - Изменение физико-химических свойств материалов путем диффузии
Медь (лат. Cuprum) - химический элемент. Один из семи металлов, известных с глубокой древности. По некоторым археологическим данным - медь была хорошо...
-
Пайка меди и ее сплавов - Изменение физико-химических свойств материалов путем диффузии
Технически чистая медь имеет высокие теплопроводность и электропроводность, и достаточно высокую коррозионную стойкость. Она устойчива к атмосферной...
-
Математическое ожидание генеральной совокупности назовем генеральной средней, т. е. . Теорема. Выборочное среднее есть состоятельная и несмещенная оценка...
-
Химические свойства меди - Изменение физико-химических свойств материалов путем диффузии
Природная медь состоит из двух стабильных нуклидов 63Cu (69,09% по массе) и 65Cu (30,91%). Конфигурация двух внешних электронных слоев нейтрального атома...
-
Свойства веществ при низких температурах - Свойства веществ при низких температурах
Работы в области жидкого гелия представляют интерес в основном потому, что проводятся вблизи абсолютного нуля, т. е. при очень низких температурах. В то...
-
Электротехника и ювелирное дело Так как обладает наибольшей электропроводностью, теплопроводностью и стойкостью к окислению кислородом при обычных...
-
Кислород: история открытия и основные свойства
Кислород - элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8....
Комплексообразующие свойства тиосульфатов - Тиосульфат натрия