Технология производства соляной кислоты - Анализ и технологическая оценка химического производства
Соляная кислота--бесцветная жидкость, представляющая собой раствор хлористого водорода в воде. Она энергично растворяет многие металлы и их окислы. В технике применяется как соляная кислота, так и хлористый водород.
Хлористый водород используют для производства хлорорганических продуктов путем гидрохлорировании органических соединений, например этилена, ацетилена.
(Соляную кислоту применяют для получения хлоридов Zn, Ba. Mg, Са, Fe, A1 и т. д., для травления при пайке и лужении, и цветной металлургии (извлечение Pt, An), при гидролизе древесины, в производетве красителей, для гидрохлорировании органических соединении и т. д.
Процесс получения соляной кислоты имеет две стадии;
- 1) получение хлористого водорода; 2) абсорбция xлористого водорода водой.
Существуют два способа получения хлористого водорода: сульфатной и синтетический. Кроме того, в производстве; соляной кислоты используют хлористый водород, являющийся отходом при хлорировании насыщенных углеводородов
Сульфатный способ получения хлористого водорода основан на взаимодействии твердой поваренной соли с серной кислотой
2NaCl + H2SO4 = Na2SO4 + 2НС1 -- Q.
Процесс синтеза проводят в муфельных печах при температуре 500--550° С, обогреваемых через стенку топочными газами. Концентрация хлористого водорода н газе от 30 до 50% НС1. Способ находит применение, но новых производств не организуют.
При Синтетическом способе синтез хлористого водорода проводится по реакции
Н2 + С12--" 2НС1 + 184,33 Кдж
Cyxoй хлор и водород при нормальных условиях и в темноте не реагируют между собой, но на свету или при нагревании в присутствии паров воды реакция взаимодействия их сопровождается взрывом.
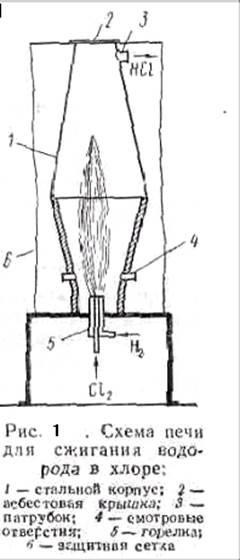
Синтез проводят при избытке 5--10% водорода и высокой температуре в печи, корпус которой изготовляют из углеродистой или легированной стали, а крышку из асбеста. Нижняя часть печи (рис.1) выложена огнеупорным материалом. В ней помещена горелка, состоящая из двух концентрически расположенных стальных трубок. По наружной трубке в печь подается водород, а по внутренней -- хлор. Которые на выходе из горелки смешиваются и спокойно реагируют; образуя факел горения с температурой 2000--2400° С.
Абсорбция хлористого водорода в воде идет с выделением большого количества тепла (образование гидратов), которого достаточно для нагревания кислоты до кипения. Для получения более концентрированной соляной кислоты необходим отвод тепла, так как растворимость хлористого водорода в воде с повышением температуры уменьшается.
Поглощение НС1 проводят в абсорберах с отводом тепла. Через стенку (изотермическая абсорбция) или с отводом тепла в результате испарения части воды (адиабатическая абсорбция).
Соляная кислота выпускается следующих сортов: техническая (27,5% НС1); синтетическая (31% НС1), ингибиторная (20% НС1) и реактивная (35--38% НС1, плотность при 20°С равняется 1,17-- 1,19 г/см3).
Кислоту перевозят и хранят в гуммироваявых стальных цистернах и контейнерах, в фаолитовых баках и контейнерах и в емкостях, изготовленных из керамики и стекла При введении в кислоту 1--3% ингибитора активность НС1 к стали снижается в 150--200 раз, поэтому ингибиторную кислоту перевозят в стальных нефутерованных цистернах.
Похожие статьи
-
Получение синтезированного газа - Анализ и технологическая оценка химического производства
Химические методы переработки нефти проводят при высоких температурах без катализатора (термический крекинг), при высоких температурах в присутствии...
-
Производство азотной кислоты - Анализ и технологическая оценка химического производства
Безводная азотная кислота HNO3--тяжелая бесцветная жидкость плотностью 1520 Кг/м 3 (при 15° С). Она замерзает при температуре --47° С и кипит при 85°С,...
-
Актуальность темы. В современных условиях глобальной конкуренции на все более интегрирующихся мировых рынках, развитие химической промышленности...
-
Синтезы на основе ацетилена - Анализ и технологическая оценка химического производства
Ацетилен СН=СН -- газ, легко вступающий в самые различные химические реакции с образованием многочисленных соединений, используемых при получении...
-
Подготовка угля к коксованию - Анализ и технологическая оценка химического производства
Коксование-- Процесс сухой перегонки каменных углей при их нагревании до 900--1050° С без доступа воздуха. В результате сложных физических и химических...
-
Производство химических волокон - Анализ и технологическая оценка химического производства
Волокнами называют тела, длина которых во много раз превышает очень малые (микроны) размеры их поперечного сечения. По происхождению волокна делят на...
-
Производство пластмасс - Анализ и технологическая оценка химического производства
Пластические массы делят на простые (ненаполненные) и сложные (композиционные). Основу пластических масс составляет высокомолекулярное соединение --...
-
Производство полимеров - Анализ и технологическая оценка химического производства
Высокомолекулярные соединения получают из мономеров полимеризацией, сополимеризацией, поликонденсацией и методами привитой полимеризации и...
-
Этот способ концентрирования обеспечивает получение чистой концентрированной азотной кислоты без вредных выбросов в атмосферу. Однако у него есть ряд...
-
Запасы этих растворов, несоответствующих показателям качества, исчисляются сотнями тысяч тонн и дальнейшее их хранение становится очень опасным для...
-
Полимеризация двуокиси азота. Переработка нитрозных газов в азотную кислоту обычно происходит при температурах от О до 50 °С. В этих условиях двуокись...
-
Азотный кислота утилизация оксид Методы получения азотной кислоты Первый завод по производству HNO3 из аммиака коксохимического производства был пущен в...
-
Процесс получения фосфорной кислоты, не смотря на крупнотоннажность производства и довольно длительное использование в различных сферах...
-
Введение - Производство нитратной кислоты АК-72. Анализ стадий переработки оксидов азота в HNO3
Азотная кислота - одна из важнейших минеральных кислот. По объему производства в химической промышленности она занимает второе место после серной...
-
Таблица 2 - Структура сырья в производстве метанола, %. Сырье В мире Беларусь и Россия Природный газ 73,8 70,7 Нефть и нефтепродукты 24,4 4,0 Отходы...
-
Технологии производства метанола - Синтез на основе оксидов углерода и водорода
Способ, основанный на сухой перегонке древесины, до 1913 года оставался единственным освоенным процессом получения метанола, а в 1913 г. был разработан...
-
Технология производства, Обоснование способа и технологии - Пиролиз углеводородного сырья
Обоснование способа и технологии Проект выполнен на основе действующего производства пиролиза углеводородов нефти объекта 2-3-5/III АО "Уфаоргсинтез",...
-
Опыт проводили в условиях, имитирующих периодическую экстракцию: в стакан одновременно загружали все реагенты и перемешивают их в течение заданного...
-
Азотная кислота широко применяется для производства многих продуктов, используемых в промышленности и сельском хозяйстве Список использованной литературы...
-
ПРОМЫШЛЕННОЕ ПРОИЗВОДСТВО: ТЕХНОЛОГИЧЕСКИЕ АСПЕКТЫ - Технология получения винилхлорида
На 2010 год существуют четыре основных способа получения винилхлорида, реализованные в промышленных масштабах. Винилхлорид можно получить различными...
-
Выбор метода производства (или выделение) готового продукта Современные методы производства азотной кислоты основаны на применении синтетического аммиака...
-
Схема 1. Технологическая схема производства серной кислоты по методу ДК. 1-серная печь; 2- котел-утилизатор; 3- экономайзер; 4- пусковая топка;...
-
Все аминокислоты, из которых состоят белки, являются" L-а-амино - (или имино-) кислотами. Они находят применение как пищевые добавки, приправы, усилители...
-
Процессы, основанные на микробиологической ферментации, разработаны и для получения ряда других органических кислот. Среди них -- глюконовая кислота и ее...
-
Технология получения стекла Технология получения стекла состоит из двух производственных циклов. Цикл технологии стекломассы включает операции: А)...
-
Физические свойства воды. В современной шкале измерений вода принята за эталон по очень многим показателям. Температурой таяния льда является 0 градусов...
-
В 1960-х годах разработан агрегат по производству азотной кислоты мощностью 120 тыс. т год под давлением 0,716 МПа с использованием высокотемпературной...
-
Ангидритным способом в лабораторных условиях Разложение фосфата серной кислотой проводим согласно уравнению реакции: Ca3(PO4)2 + 3H2SO4 > 3CaSO4(тв)...
-
Получение., Применение. - Свойства фтора как химического элемента
Источником для производства фтора служит фтористый водород, получающийся в основном либо при действии серной кислоты H2SO4 на флюорит CaF2, либо при...
-
Температура кислоты, Защита от коррозии, Цвет кислоты - Работа сернокислотного производства
Значения температуры кислоты на входе в сушильную башню (7506U) отображаются на устройстве цифровой индикации TIC-750607 в операторной. Датчик...
-
Технологическая схема производства - Пиролиз углеводородного сырья
В данном разделе излагается описание технологического процесса и технологической схемы отделения пиролиза углеводородов нефти. Сырье с температурой...
-
На холоду даже дымящаяся серная кислота (олеум) почти не действует на предельные углеводороды, но при высокой температуре она может их окислять. При...
-
Процесс получения винилхлорида сбалансированным методом из этилена состоит из шести стадий: 1. синтез 1,2-дихлорэтана прямым жидкофазным хлорированием...
-
Производство лимонной кислоты методом ферментации - Бродильное производство органических кислот
Производство лимонной кислоты методом ферментации при участии грибов также принадлежит к числу давних биотехнологических процессов; оно было налажено в...
-
Существует два основных способа получения полиарилатов: переэтерификация и взаимодействие хлорангидридов карбоновых кислот с двухатомными фонолами. 1....
-
В конце XIX в. началось промышленное производство молочной кислоты при участии молочнокислых бактерий Lactobacillus delbrueckii, L. leichmannii и L....
-
Введение - Бродильное производство органических кислот
Биомасса представляет собой сложную химическую систему, а большинство процессов и продуктов биотехнологии имеют биохимическую природу, будь то...
-
Технологическая схема производства - Производство хлорида калия галургическим способом
Принципиальная технологическая схема приведена на рис. 2. Перед выщелачиванием сырую руду подвергают дроблению. В калийной промышленности в последние...
-
Использование предшественников при производстве аминокислот позволяет успешно обходить метаболический контроль, осуществляющийся по механизму обратной...
-
Один из способов повысить селективность - это правильно подобрать катализатор. Рассмотрим этот метод, на примере получения анизола и крезола. Анизол и...
Технология производства соляной кислоты - Анализ и технологическая оценка химического производства