Введение - Изучение научно-производственных принципов химической технологии экстракционной фосфорной кислоты в лабораторных условиях
Актуальность темы. В современных условиях глобальной конкуренции на все более интегрирующихся мировых рынках, развитие химической промышленности Казахстана имеет особенное значение. Оно предусматривает ускоренное создание новой, современной технологии и химической отрасли, освоение производства конкурентоспособных видов продукции и выход в фазу устойчивого социально-экономического развития химической промышленности и сопутствующих ей отраслей. Химическая промышленность является крупным поставщиком сырья, полупродуктов, материалов для многих отраслей национальной экономики.
В Плане действий по развитию химической промышленности Республики Казахстан на 2009 - 2015 годы предусмотрены реконструкция, модернизация и расширение мощностей действующих предприятий, а также строительство новых производств.
Одним из ведущих направлений химической промышленности Казахстана является фосфорная промышленность (производство фосфорсодержащих продуктов путем освоения богатейших запасов фосфоритов Южного и Западного Казахстана), поскольку эта отрасль служит основой для развития сельского хозяйства.
Продукция отечественной фосфорной промышленности представлена желтым фосфором, термической и экстракционной фосфорной кислотой, минеральными удобрениями и др.
Основными промышленными способами производства фосфорной кислоты в мире являются термический и экстракционный. Следует отметить, что сегодня за рубежом и на территории СНГ наблюдается спад производства термической фосфорной кислоты и рост производства очищенной экстракционной фосфорной кислоты (ЭФК). Термический способ позволяет получать наиболее чистый продукт, но представляется весьма энергоемким, дорогостоящим и экологически опасным. Экстракционный способ получения фосфорной кислоты имеет преимущества: низкая себестоимость и энергоемкость, высокая технологичность и возможность получения кислоты любого качества. ЭФК, получаемая сернокислотным разложением фосфатного сырья, является основным сырьем в производстве высококачественных фосфорных и сложных удобрений, очищенной фосфорной кислоты и кормовых фосфатов. В настоящее время ее мировое производство составляет 48,1 млн. т в пересчете на Р2О5. Многообразное использование фосфорной кислоты практически во всех сферах нашей жизни дает право назвать производство фосфорной кислоты крупнотоннажным производством. Данная научная работа имеет Теоретическое и практическое значение с точки зрения проблем и задачи переработки фосфатного сырья в целевой продукт - фосфорную кислоту с соблюдением условий оптимальных технологических режимов выхода.
Целью Научного проекта является получение сведений о важнейших физико-химических свойствах фосфорной кислоты и ее применении, сырье, экстракционном способе получения и его использования. Важной задачей является исследование научно-производственных принципов химической технологии ЭФК в лабораторных условиях. Расчетная часть включает задание на материальный баланс процесса получения ЭФК сернокислотным разложением; провести экстракцию и фильтрование полученной суспензии в лабораторных условиях.
Научная новизна. Практическое изучение научно-промышленных принципов синтеза ЭФК в условиях модернизации производства.
1. Общая характеристика фосфорной кислоты
Ортофосфорная кислота H3PO4, молярная масса 97,995; бесцветные гигроскопичные кристаллы моноклинной сингонии; расплывается на воздухе; температура плавления 42,5 0С; плотность 1,88 г/см3; -1283 кДж/моль; наиболее стабильное соединение в ряду кислородсодержащих кислот фосфора. В расплавленном состоянии склонна к переохлаждению; при 15 0C образует густую маслянистую жидкость, при -121 0C - стеклообразную массу.
Фосфорная кислота смешивается с водой в любых соотношениях. Разбавленные водные растворы имеют кисловатый вкус. Из высококонцентрированных растворов кристаллизуется в виде гемигидрата H3PO4-0,5H2O - бесцветные кристаллы моноклинной сингонии. Молекула безводной H3PO4 и ее кристаллогидрата содержит тетраэдрическую группу PO4. В безводной фосфорной кислоте образуются водородные связи типа P -- О -- H... O = P (расстояние между атомами О 0,253 нм), которые удерживают структуры PO4 в виде слоев, параллельных одной из плоскостей кристалла. Водородные связи сохраняются и в концентрированных (70-80%) растворах фосфорной кислоты, что отчасти обусловливает ее сиропообразную природу. В разбавленных до 40-50% растворах отмечена более устойчивая водородная связь фосфат-анионов с молекулами воды, а не с другими фосфат-анионами. В растворах фосфорная кислота имеет место обмен атомами кислорода между группами PO4 и водой.
H3PO4 - слабая трехосновная кислота, K1 7,1-10-3 (рКа 2,12), K2 6,2-10-8 (рКа 7,20), K3 5,0-10-13 (рКа 12,32); значения K1 и K2 зависят от температуры. Диссоциация по первой ступени экзотермична, по второй и третьей - эндотермична.
Фосфорная кислота при нормальных условиях малоактивна и реагирует лишь с карбонатами, гидроксидами и некоторыми металлами. При этом образуются одно-, двух - и трехзамещенные фосфаты. При нагревании выше 80 0C реагирует даже с неактивными оксидами, кремнеземом и силикатами. При повышенных температурах фосфорная кислота - слабый окислитель для металлов. При действии на металлическую поверхность раствором фосфорной кислоты с добавками Zn или Mn образуется защитная пленка (фосфатирование). Фосфорная кислота при нагревании теряет воду с образованием последовательно пиро - и метафосфорных кислот:
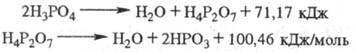
Фосфолеум (жидкий фосфорный ангидрид, суперфосфорная кислота) включает кислоты, содержащие от 72,4 до 88,6% P2O5, и представляет собой равновесную систему, состоящую из орто-, пиро-, триполи-, тетраполи - и других фосфорных кислот. При разбавлении суперфосфорной кислоты водой выделяется значительное количество тепла, и полифосфорные кислоты быстро переходят в ортофосфорную.
От других фосфорных кислот H3PO4 можно отличить по реакции с AgNO3 - выпадает желтый осадок Ag3PO4. Остальные фосфорные кислоты образуют белые осадки [1-2].
Фосфорная кислота - важный полупродукт для производства удобрений, технических реактивов, в синтезе ряда органических продуктов, в производстве активированного угля, для создания на металлах защитных покрытий. Очищенная, или так называемая пищевая Н3РО4, применяется в производстве безалкогольных напитков, фармацевтических препаратов, для приготовления кормовых концентратов и т. д.
2. Получение экстракционной фосфорной кислоты
Более экономичный экстракционный метод получения фосфорной кислоты основан на разложении природных фосфатов кислотами (в основном серной, в меньшей степени азотной и незначительно соляной). Фосфорнокислые растворы, полученные разложением азотной кислотой, перерабатывают в Комплексные удобрения, Разложением соляной кислотой - в преципитат.
Сернокислотное разложение фосфатного сырья (апатитового или фосфоритового концентрата) - хорошо исследованный метод получения ЭФК, применяемой для производства концентрированных фосфорных и комплексных удобрений. Суть метода - извлечение (экстрагирование) P4O10 (обычно P2O5) в виде H3PO4. По этому методу природные фосфаты обрабатывают H2SO4 с последующим фильтрованием полученной пульпы для отделения фосфорной кислоты от осадка сульфата кальция. Часть выделенного основного фильтрата, а также весь фильтрат, полученный при промывке осадка на фильтре, возвращают в процесс экстрагирования (раствор разбавления) для обеспечения достаточной подвижности пульпы при ее перемешивании и транспортировке. Массовое соотношение между жидкой и твердой фазами от 1,7 :1 до 3,0:1.
Природные фосфаты разлагаются по схеме (гетерогенная химическая реакция "жидкость - твердое тело"):
Ca5F(PO4)3 + 5H2SO4 > 5CaSO4(тв)v + 3Н3РО4 + HF
В случае смешения фосфата с серной кислотой средних концентраций образуется густая малоподвижная пульпа, не поддающаяся разделению. Поэтому разложение фосфата проводят в присутствии некоторого количества циркулирующей продукционной фосфорной кислоты и возвращаемых в процесс промывных растворов. В результате этого вначале фосфат реагирует в той или иной степени с фосфорной кислотой, содержащейся в растворе разбавления:
Ca3F(PO4)3 + nH3PO4>5 Ca(H2PO4)2+ (n-7)H3PO4+ HF
Затем образовавшийся Ca(H2PO4)2 взаимодействует с серной кислотой в присутствии фосфорной кислоты:
Ca(H2PO4)2 + H2SO4 + mH3PO4 > CaSO4+ (m+2)H3PO4
Разложению кислотами подвергаются также сопутствующие примеси: кальцит, доломит, сидерит, нефелин, глауконит, каолин и другие минералы.
Разложение примесей:
CaCO3*MgCO3 +2H2SO4+(n-2)H2O>CaSO4* nH2O+MgSO4+2CO2
K2O*Na2O*Al2O3*2SiO2+5H2SO4> Na2SO4+K2SO4+Al2(SO4)3+2SiO2+5H2O
SiO2+4HF> SiF4+2H2O
SiF4+2HF>H2SiF6
Это приводит к увеличению расхода используемой кислоты, а также снижает извлечение P2O5 в целевой продукт вследствие образования нерастворимых фосфатов железа FeH3(PO4)2 -2,5H2O при концентрациях P2O5 выше 40% и FePO4 - 2H2O - при более низких концентрациях. Выделяющийся при разложении карбонатов СО2 образует в экстракторах стойкую пену; растворимые фосфаты Mg, Fe и Al снижают активность фосфорной кислоты, а также уменьшают содержание усвояемых форм P2O5 в удобрениях при последующей переработке фосфорной кислоты.
С учетом влияния примесей определены требования к фосфатному сырью, согласно которым природные фосфаты с повышенным содержанием Fe, Al, Mg, карбонатов и органических веществ непригодны для производства фосфорной кислоты.
При разложении фосфатов серной кислотой наряду с фосфорной кислотой образуется практически нерастворимый сульфат кальция.
Сульфат кальция может быть выделен в форме дигидрата CaSO4-2H2O (гипса), полугидрата (гемигидрата) CaSO4-0,5H2O или водного CaSO4 (ангидрита). В зависимости от этого процесс можно вести дигидратным, полугидратным (гемигидратным) или ангидритным способами при разных температурах с получением фосфорной кислоты различной концентрации. Количество воды, вводимой в систему определяется не только степенью окисления выделившегося сульфата кальция, сколько отмывкой кислоты из осадка и необходимостью создания текучести пульпы и концентрации кислоты [1-4].
На процесс получения ЭФК влияют:
- 1. Активность жидкой фазы (H2SO4). По мере расхода H2SO4 концентрация иона Н+ уменьшается, снижается активность жидкой фазы, скорость разложения снижается. 2. С повышением t за счет реакции, наблюдается увеличение скорости разложения. 3. Примеси оказывают отрицательное влияние. 4. Скорость перемешивания до определенного предела влияет на смешивания Т-Ж. 5. Состав и тонкость помола сырья.
На рисунке 1 представлена функциональная схема производства ЭФК.
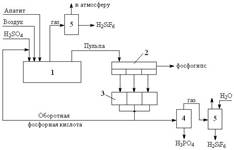
Рис. 1 Функциональная схема производства ЭФК
1 - реактор разложения природных фосфатов (экстрактор); 2 - вакуум фильтр; 3 - сборник фильтратов; 4 - колона выпарки фосфорной кислоты; 5 - система очистки газов
Получение ЭФК дигидратным способом
Схемы дигидратного процесса различаются применением или отсутствием циркуляции пульпы, распределением реагентов между реакторами, способами охлаждения пульпы, методами разделения твердой и жидкой фаз и промывки фосфогипса.
Основная цель процесса - ведение без резких колебаний концентраций, температуры и образование более крупных кристаллов сульфата кальция, поэтому создают условия:
- - чем больше продолжительность взаимодействия реагентов, тем крупнее и однороднее получаются кристаллы (ф=4-6 ч); - для увеличения скорости кристаллизации процесс проводят в присутствии большого количества растущих кристаллов сульфата кальция (затравка); - оптимальная концентрация серной кислоты в жидкой фазе при осаждении сульфата кальция поддерживается 1-1,8% (в пересчете на SO3); - для выращивания крупных кристаллов гипса в экстракторах поддерживают температуру 70-75 0С.
На рисунке 2 приведена технологическая схема получения фосфорной кислоты (28-32% Р2О5) из апатитового или (20-22% Р2О5) фосфоритового концентрата.
По схеме в первый реактор экстрактора 3 из бункера 1 дозатором 2 непрерывно вводят фосфат. В этот же реактор погружными насосами 5 вводят оборотную фосфорную кислоту из барометрического сборника 16 и циркуляционную суспензию после вакуум-испарительной установки 8 (кратность циркуляции (8ч12):1) и серную кислоту из сборника 4. Серную кислоту возможно частично или полностью вводить во второй реактор. Соотношение Ж:Т в суспензии в экстракторе поддерживают равным (1,7ч2,5):1. Из первого реактора суспензия протекает во второй, откуда основная часть ее погружным насосом 7 подается в вакуум-испаритель 8, представляющий собой резервуар, в котором вакуум - насосом поддерживают пониженное давление.
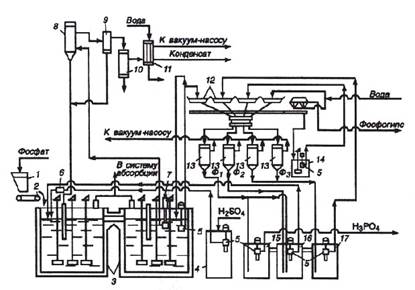
Рис. 2 Схема получения ЭФК дигидратным способом
1 - бункер фосфатного сырья; 2 - дозатор; 3 - двухступенчатый экстрактор; 4 - сборник серной кислоты; 5 - погружные насосы, 6-расходомер серной кислоты; 7- погружной насос; 8 - испаритель; 9 - брызгоуловитель; 10- конденсатор; 11 - барботажный нейтрализатор; 12 - лотки карусельного вакуум-фильтра; 13-ресиверы (сепараторы); 14- промежуточный сборник суспензий - после регенерации фильтровальной ткани; 15,16,17 - барометрические сборники: для первого (основного) фильрата (15), для оборотной фосфорной кислоты (16), для промывного фильтрата (17)
Вследствие этого поступающая в него жидкость оказывается перегретой и закипает с выпаркой части воды. Это приводит к понижению температуры на 3-5 0С. Газы из вакуум-испарителя через брызгоуловитель отводят в поверхностный конденсатор 10, в котором конденсируются пары воды и улавливается часть соединений фтора. Окончательную очистку газа от соединений фтора производят в барботажном нейтрализаторе 11.
Продукционная суспензия поступает на лотковый карусельный вакуум - фильтр, в котором гипс отделяется от раствора, а осадок промывается по трехфильтратной системе.
Карусельный лотковый фильтр состоит из 24 отдельных лотков на днищах которых уложена фильтровальная ткань (капрон, лавсан и т. п.), лотки установлены на каретках с колесами, движущимися по круговым рельсам. С помощью двух шайб, образующих головку фильтра, - подвижных, вращающейся вместе с лотками, и неподвижной - фильтраты отсасываются в соответствующие вакуум-сборники (15, 16, 17). После прохождения зон фильтрации и промывок каждый лоток с помощью направляющих автоматически опрокидывается для выгрузки лепешки фосфогипса. Фильтровальная ткань промывается водой и подсушивается воздухом. Затем лоток вновь принимает рабочее положение и перемещается в зону основного фильтрования. Воду, используемую для регенерации фильтровальной ткани, подают на последнюю или предпоследнюю зону промывки осадка, что сокращает потери Р4О10 и позволяет создать на экстракционных установках замкнутую систему водооборота. Гигроскопическая влажность фосфогипса 15-40%. Количество фосфогипса (в пересчете на сухое вещество) составляет 1,2- 1,6 т на 1т переработанного природного фосфата. В процессе переработки 1т апатита выход гемигидрата кальция равен 1,4; гипса -1,6 т.
Газожидкостная смесь разделяется в сепараторах 13, в которых поддерживается разрежение 65-85 кПа. Первый фильтрат Ф1 направляется в сборник готовой продукции, а часть его переливается в барометрический сборник оборотной кислоты 16, куда также поступает и второй фильтрат Ф2, полученный в процессе промывки осадка третьим фильтратом Ф3. Фильтрат Ф3 образуется при промывке осадка суспензией, получаемой в процессе регенерации фильтровальной ткани, и свежей горячей (60-70 0С) водой. Промытый гипс передается с лотка в сборник 14, из которого в виде суспензии перекачивается в отстойник гипса. Содержание Р2О5 в фильтратах: Ф1- 28-32%, Ф2-22-25%, Ф3 - 5-10%.
В процессе получения фосфорной кислоты дигидратным способом
Выделение фтора в атмосферу невелико - 3-5% от содержащегося в исходном сырье (около 80% переходит в целевой продукт, 15-17% - в фосфогипс). Соответственно концентрация фторидов в отводимых из экстрактора газах в зависимости от способа охлаждения и вытяжки вентилятора в пересчете на фтор составляет 0,2 - 2,5 г/м3.
Согласно дигидратному способу, на 1 т продукционного Р2О5 расходуется 2,65 - 2,73 т апатита и 2,45 - 2,48 т 100%-ной серной кислоты. ЭФК, полученная из апатита дигидратным способом, содержит: 25-32% Р2О5, 1,8-2,8% СаО, 0,3-0,4% Al2O3, 0,3-0,5% Fe2O3, 1,7-2,20% F.
Получение ЭФК полугидратным способом
Способ заключается в практически полном разложении апатита в избытке фосфорной кислоты и в обработке полученной пульпы серной кислотой при регулируемой кристаллизации CaSO4*0,5Н2О. Полугидратный процесс отличается от дигидратного температурным режимом, концентраций фосфорной и свободной серной кислот, соединений фтора; растворимостью, устойчивостью, размером и формой кристаллов сульфата кальция, а также режимом промывки сульфата кальция. Гемигидратный (полугидратный) способ осуществляется точно так же, как и дигидратный с введением всех исходных реагентов в реактор.
Разложение апатита производится в 2-3 кратном избытке фосфорной кислоты (45 - 48% Р2О5) от стехиометрического количества, при температуре 95 - 1020С, в течение 1,2 - 1,7 часа. Образовавшаяся суспензия содержит дигидрофосфат кальция, который обрабатывается 92-93% H2SO4. Степень
Разложения апатита составляет 98,5 - 99%. Полученная концентрированная фосфорная кислота содержит 45 - 48 % Р2О5.
По полугидратному способу в процессе разложения к апатиту добавляют немного соды, с целью удаления в осадок переходящего в раствор иона SiF4. При этом ~50% фтора осаждается в виде Na2SiF6 и 35% фтора выделяется в газовую фазу.
Размеры одиночных кристаллов зависят от концентрации кислоты и плотности пульпы, а также от наличия примесей. Присутствие до 2% Fe2O3 и или Al2O3 в фосфорнокислых растворах, содержащих 45-50% Р2О5, ведет к уменьшению размеров кристаллов полугидрата.
Наличие в растворе 0,5 - 0,6% фтористых и кремнефтористых соединений приводит к резкому уменьшению размеров кристаллов и получению их в игольчатой форме. Увеличение содержания фтористых соединений до 1% замедляет фильтруемость в 5 раз.
Совместное присутствие соединений алюминия и ионов фтора в количестве до 2% Al2O3 и 0,4 - 0,5% F приводит к образованию изометричных кристаллов с лучшими фильтрующими свойствами.
Получение ЭФК ангидритным способом
В настоящее время в промышленности ангидритным способом ЭФК не производят, т. к. процесс протекает при высоких температурах 100 - 110 0С, при этом образуется концентрированная фосфорная кислота ~50% Р2О5, которая создает интенсивные коррозионные условия и образование труднофильтруемого мелкокристаллического сульфата кальция, что требует большего числа ступеней противоточной промывки.
Преимущество ангидритного способа от других способов заключается в том, что позволяет без упаривания получать кислоту, содержащую 50% Р2О5, а также в процессе экстракции большая часть фтора выделяется в газовую фазу и получаемая кислота меньше загрязнена CaSО4.
Получение ЭФК комбинированными способами
Комбинированные способы (дигидратно-гемигидратный и гемигидратно - дигидратный) получения ЭФК наиболее распространены за рубежом, так как
Более технологичны и экономичны. Они обеспечивают повышение степени использования исходного фосфатного сырья, повышение концентрации целевого продукта, более чистого CaSO4 с большими возможностями его дальнейшей переработки. Комбинированные процессы усложнены двойным фильтрованием или нетехнологичны из-за продолжительной стадии перекристаллизации в гемигидратном-дигидратном способе. термохимический физический оборудование фосфорный
В комбинированных процессах предусмотрено регулирование условий гидратации с получением крупнокристаллического гипса с незначительным содержанием Р2О5. Комбинированный процесс получения ЭФК предусматривает следующие стадии:
- 1) осаждение гемигидрата смешением исходного фосфорита с оборотной фосфорной и серной кислотами при температуре 90-95 0С; 2) охлаждение суспензии до 50-65 0С; 3) гидратация гемигидрата с введением затравочных кристаллов гипса, серной кислоты и активного диоксида кремния для связывания фторид-ионов, замедляющих в сочетании с ионами алюминия обводнение. Продолжительность процесса гидратации составляет 5-16 часов.
Описанный способ позволяет получать фосфорную кислоту, содержащую не более 32% Р2О5 [5-7].
3. Экспериментальная часть работы (синтез ЭФК в лабораторных условиях)
На практике для разложения фосфата применяют серную кислоту, разбавленную раствором фосфорной кислоты ("раствор разбавления"). Образующийся осадок сульфата кальция (гипс) должен быть получен в виде однородных крупнокристаллических частиц, которые можно было бы легко отфильтровать от фосфорной кислоты и хорошо промыть небольшим количеством воды.
Продолжительность и технологический режим процесса экстракции определяются в основном условиями кристаллизации гипса, так как скорость самого разложения фосфатов достаточно велика. Время, необходимое для разложения фосфата, зависит от сорта сырья и колеблется в пределах 4-8 часов.
Оптимальная температура образования крупных кристаллов гипса 75-80 0С. При этих условиях гипс имеет наибольшую растворимость в фосфорной кислоте, вследствие чего уменьшается степень пересыщения раствором гипсом и улучшаются условия кристаллизации. Процесс можно осуществить и по так называемым полугидратному и ангидритному режимам. В этих случаях для образования кристаллов полугидрата и ангидрита поддерживают более высокую температуру - до 105 0С.
Формы и размер кристаллов гипса зависят также от концентрации в растворе ионов кальция и серной кислоты. Для получения крупнокристаллического однородного осадка необходимо поддерживать в растворе концентрации, в %: SО3 - 1-2, СаО - 0,35-0,75. Поэтому концентрацию серной кислоты на первой стадии разложения (в первом экстракторе) поддерживают на уровне 20 г/дм3, а на последующих стадиях, когда происходит доразложение фосфата, от 10 г/дм3 и меньше.
Оптимальные условия кристаллизации и отмывки гипса, а также необходимость разбавления серной кислоты раствором фосфорной кислоты предопределяют применение серной кислоты концентрацией 75% Н2SО4. Применение более концентрированной (93%) кислоты позволяет несколько уменьшить потери фосфорной кислоты с фосфогипсом, но не отражаются на концентрации получаемой кислоты.
Разложение фосфата с образованием фосфорной кислоты проводили в фарфоровом стакане на 1дм3, установленном в вытяжном шкафу. В стакан помещали мешалку и устанавливали его в баню или на электрическую плитку для подогрева до требуемой температуры.
Похожие статьи
-
Опыт проводили в условиях, имитирующих периодическую экстракцию: в стакан одновременно загружали все реагенты и перемешивают их в течение заданного...
-
Процесс получения фосфорной кислоты, не смотря на крупнотоннажность производства и довольно длительное использование в различных сферах...
-
Ангидритным способом в лабораторных условиях Разложение фосфата серной кислотой проводим согласно уравнению реакции: Ca3(PO4)2 + 3H2SO4 > 3CaSO4(тв)...
-
Технология производства соляной кислоты - Анализ и технологическая оценка химического производства
Соляная кислота--бесцветная жидкость, представляющая собой раствор хлористого водорода в воде. Она энергично растворяет многие металлы и их окислы. В...
-
На холоду даже дымящаяся серная кислота (олеум) почти не действует на предельные углеводороды, но при высокой температуре она может их окислять. При...
-
Существует два основных способа получения полиарилатов: переэтерификация и взаимодействие хлорангидридов карбоновых кислот с двухатомными фонолами. 1....
-
ТЕХНОЛОГИЯ СЕРНОЙ КИСЛОТЫ., ПРИМЕНЕНИЕ СЕРНОЙ КИСЛОТЫ. - Получение серной кислоты
Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Объясняется...
-
Кислота из гипса - Сера и ее соединения
Если сульфидов металлов мало (как, например, в ГДР), то исходными продуктами для получения серной кислоты могут служить ангидрит CaSO4 и гипс СаSO4*2Н2О....
-
Запасы этих растворов, несоответствующих показателям качества, исчисляются сотнями тысяч тонн и дальнейшее их хранение становится очень опасным для...
-
АБСОРБЦИЯ ТРИОКСИДА СЕРЫ. - Получение серной кислоты
Последней стадией процесса производства серной кислоты контактным способом является абсорбция триоксида серы из газовой смеси и превращение его в серную...
-
Задача количественного химического анализа состоит в определении содержания тех или иных элементов в анализируемом материале; при этом главное требование...
-
Производство азотной кислоты - Анализ и технологическая оценка химического производства
Безводная азотная кислота HNO3--тяжелая бесцветная жидкость плотностью 1520 Кг/м 3 (при 15° С). Она замерзает при температуре --47° С и кипит при 85°С,...
-
Винилхлорид -- достаточно активное химическое соединение, чьи химические свойства определяются как наличием двойной связи, так и атома хлора. Наибольший...
-
Введение - Бродильное производство органических кислот
Биомасса представляет собой сложную химическую систему, а большинство процессов и продуктов биотехнологии имеют биохимическую природу, будь то...
-
Химические свойства меди - Медь
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро - и теплопроводности медь уступает...
-
Характеристика элемента - Химический элемент Магний
Название "магнезия" встречается уже в III веке н. э., хотя не вполне ясно, какое вещество оно обозначает. Долгое время магнезит - карбонат магния -...
-
Все аминокислоты, из которых состоят белки, являются" L-а-амино - (или имино-) кислотами. Они находят применение как пищевые добавки, приправы, усилители...
-
Производство лимонной кислоты методом ферментации - Бродильное производство органических кислот
Производство лимонной кислоты методом ферментации при участии грибов также принадлежит к числу давних биотехнологических процессов; оно было налажено в...
-
Введение., Способы получения перхлоратов - Производство перхлоратов в промышленности
Получение перхлората калия или перхлоратов вообще имеет большое значение для промышленности. Ведь перхлораты широко используются как в проведении...
-
Химические свойства алюминия и его соединений - Алюминий и его свойства
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид). I. Взаимодействие с простыми...
-
ВВЕДЕНИЕ - Технология получения винилхлорида
Важнейшей областью химической технологии органических веществ является промышленное производство хлорорганических соединений и продуктов. Среди них...
-
Введение - Проектирование химического реактора идеального смешения
Промышленный химический процесс - это экономически и экологически целесообразное производство требуемого продукта из исходного сырья....
-
Реакторами идеального (полного) смешения называются реакторы непрерывного действия, в которых осуществляется турбулентный гидродинамический режим. В них...
-
Способы получения и химические свойства кислот - Основы химии
Бескислородные кислоты получают: 1. Взаимодействием неметалла с водородом. Например H2 + Cl = 2HCl 2. Действием на соль более сильной или менее летучей...
-
Введение, Химическая природа, Биологическая роль фолацина - Витамин Вс (фолиевая кислота)
Фолиевая кислота (от лат. "folium" - лист) поскольку впервые она была выделена из листьев шпината. Она широко распространена в биологических системах....
-
Применение - Важнейшие представители полимеров
В строительной технике полистирол в основном применяют для производства пенополистирола методом поризадии полистирола, в результате чего он получает...
-
Воздушная известь - одно из древнейших вяжущих, широко применяемых в строительстве и промышленности. Известь - продукт умеренного обжига кальциевых и...
-
О-КРЕЗОЛ - Разработка технологической схемы получения анизола и крезола
C7H8O/CH3C6H4OH Молекулярная масса: 108.2 Температура кипения: 191°C Температура плавления: 31°C Относительная плотность (вода = 1): 1.05 Растворимость в...
-
Хлор - Описание и сущность галогенов
Хлор (лат. Chlorum), Cl, химический элемент VII группы периодической системы Менделеева, атомный номер 17, атомная масса 35,453; относится к семейству...
-
Физические свойства Таллия - Третья группа периодической системы
. Таллий мягкий металл, на воздухе легко окисляется и быстро тускнеет. Таллий при давлении 0,1 Мн/м2 (1 кгс/см2) и температуре ниже 233 °С имеет...
-
Процесс нитрования углеводородов смесью азотной и серной кислот протекает в гетерогенной среде, так как образуются две фазы - органическая...
-
Физические и химические свойства - Магний и его сплавы. Резиновые материалы. Быстрорежущая сталь
Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. На воздухе он покрывается тонкой...
-
Химические свойства Галлия. - Третья группа периодической системы
На воздухе при обычной температуре Галлий стоек. Выше 260° С в сухом кислороде наблюдается медленное окисление (пленка оксида защищает металл). В серной...
-
В сухую колбу Кьельдаля вносят 0,1 г исследуемого продукта, наливают 5 см3 концентрированной серной кислоты. Добавляют небольшое количество катализатора....
-
Производство полимеров - Анализ и технологическая оценка химического производства
Высокомолекулярные соединения получают из мономеров полимеризацией, сополимеризацией, поликонденсацией и методами привитой полимеризации и...
-
Строение и физико-химические свойства аскорбиновой кислоты - Аскорбиновая кислота
Аскорбиновая кислота (Acidumascorbinicum) - это белые кристаллы с резким кислым вкусом. Молекулярная масса = 176,13. Температура плавления аскорбиновой...
-
ПОДГОТОВКА ОБЖИГОВОГО ГАЗА К КОНТАКТНОМУ ОКИСЛЕНИЮ. - Получение серной кислоты
Подготовка обжигового газа к контактному окислению заключается в удалении из него примесей, присутствие которых может вызвать затруднения при проведении...
-
СЫРЬЕ ДЛЯ СЕРНОЙ КИСЛОТЫ И МЕТОДЫ ЕЕ ПОЛУЧЕНИЯ. - Получение серной кислоты
Исходными реагентами для получения серной кислоты могут быть элементная сера и серосодержащие соединения, из которых можно получить либо серу, либо...
-
Физические свойства воды. В современной шкале измерений вода принята за эталон по очень многим показателям. Температурой таяния льда является 0 градусов...
-
К числу бактерий, способных вырабатывать салициловую кислоту (рис. 4.4) при росте в средах с нафталином, принадлежат многие виды Pseudomonas,...
Введение - Изучение научно-производственных принципов химической технологии экстракционной фосфорной кислоты в лабораторных условиях