Гетерогенные процессы в системе "газ - жидкость" - Химические процессы и реакторы
Газожидкостные реакции - гетерогенные процессы, включающие в себя химическое взаимодействие между реагентами, один из которых находится в газовой фазе, а другой - в жидкой. Жидкость может представлять собой раствор вещества, химически взаимодействующего с газообразным реагентом; в ряде случаев происходит взаимодействие растворяющегося газа с самим растворителем.
Газожидкостные реакции широко используют в химической технологии. Примеры их применения как самостоятельных процессов получения необходимых продуктов: абсорбция аммиака растворами азотной кислоты при производстве аммиачной селитры или растворами серной кислоты при производстве сульфата аммония (производство удобрений); хлорирование жидких ароматических углеводородов (органический синтез). Примеры их применения в качестве вспомогательных процессов очистки газовых смесей: абсорбция диоксида углерода СО2 водными растворами моноэтаноламина или карбоната калия для очистки синтеза газа в производстве аммиака; абсорбция диоксида серы SO2 растворами сульфита и гидросульфита аммония при санитарной очистке газов.
Газожидкостные реакции принято рассматривать как процессы абсорбции, сопровождающиеся химическим взаимодействием. Такой подход позволяет применить к этой группе химических процессов закономерности массопередачи. При этом считают, что протекание химической реакции на границе раздела газовой и жидкой фаз или в глубине жидкой фазы приводит к ускорению процесса абсорбции.
Возможность таким образом ускорить процесс массопередачи широко используется в практике. Добавляя к растворителю реагенты, вступающие в быстрые химические реакции с компонентами, извлекаемыми из газовой фазы, удается существенно интенсифицировать процесс абсорбции. Например, диоксид углерода СО2 можно извлечь из газовой смеси абсорбцией водой под давлением. Применение вместо воды растворов этаноламинов или карбонатов, вступающих в химическое взаимодействие с СО2, позволяет во много раз повысить интенсивность абсорбции.
Массопередача между газом и жидкостью. Растворимость газа в жидкости во многих случаях, когда концентрация растворенного газа невелика, а температура и давление далеки от критических, подчиняется закону Генри, согласно которому равновесное парциальное давление растворенного газа сА,E над раствором прямо пропорционально его концентрации в жидкой фазе cA,L:

(7.39)
Где коэффициент пропорциональности НА называется константой Генри, или константой фазового равновесия.
Скорость массоотдачи от газа к жидкости пропорциональна движущей силе - разности парциальных давлений компонента А в ядре газового потока сА и на границе раздела фаз сА,B (см. рис. 7.7):
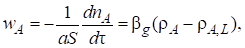
(7.40)
Где вG - коэффициент массоотдачи со стороны газовой фазы.
В свою очередь скорость массоотдачи от жидкости к газу

(7.41)
Где вL - коэффициент массоотдачи со стороны жидкой фазы; СА,B - концентрация растворенного реагента А на границе раздела фаз; CA,L - концентрация растворенного компонента А в основной массе жидкой фазы.
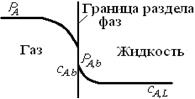
Рис. 7.7. Распределение парциального давления и концентрации растворяемого газообразного вещества А в фазах при массопередаче
Обычно при расчете процессов массопередачи принимают, что на границе раздела фаз достигается равновесие. Это предположение равносильно допущению о том, что сопротивлением переносу через границу раздела фаз можно пренебречь, а все сопротивление массопередачи сосредоточено, с одной стороны, в слое газа, примыкающем к поверхности раздела фаз, с другой - в граничащем с ним слое жидкости.
При равновесии в соответствии с законом распределения [см. формулу (7.39)]

(7.42)
Для вывода уравнения скорости массопередачи, учитывающего сопротивление со стороны жидкой и газовой фаз, запишем уравнения (7.40) и (7.41) в следующем виде:

(7.43)

(7.44)
В уравнении (7.44) концентрация растворенного реагента на границе раздела фаз СA,B выражена через парциальное давление этого вещества на границе радела фаз в соответствии с уравнением (7.42).
В условиях равновесия скорости массоотдачи от газовой фазы к жидкой или от жидкой фазы к газовой равны между собой и равны скорости массопередачи WA в целом.
Почленно складывая уравнения (7.43) и (7.44), получим уравнение, не содержащее неизвестного значения парциального давления сА,B на границе раздела фаз:

Или

(7.45)
Уравнение (7.45) для расчета скорости массопередачи содержит лишь экспериментально определяемые величины сА (парциальное давление растворяемого компонента в газовой фазе) и СА,L (концентрация этого компонента в основной массе жидкости), а также коэффициент массопередачи

(7.46)
В уравнение (7.46) для определения коэффициента массопередачи КТ входят коэффициенты массоотдачи вG и вL, которые, как правило, могут быть определены с помощью критериальных уравнений, описывающих абсорбционные процессы в различных аппаратах. Константа фазового равновесия HА определяется по равновесным данным о растворимости газов.
При протекании процессов массопередачи сопротивление может быть равномерно распределено в жидкой или газовой фазе. Возможны также случаи, когда преобладает сопротивление в жидкой фазе или, наоборот, в газовой.
Например, если сопротивление сосредоточено в основном в газовой фазе, т. е. 1/вG>>HA/ВL, уравнение (7.45) примет более простой вид:

Если же вещество А, растворившись, вступает в быструю химическую реакцию с компонентами, находящимися в жидкой фазе, его концентрация в основной массе жидкости будет пренебрежимо мала и тогда

Наличие или отсутствие лимитирования процесса массоотдачей в одной из фаз в значительной степени зависит от числового значения константы Генри HА. При малых значениях НА, что отвечает высокой растворимости газа в жидкости [см. уравнение (7.39)],

,
Т. е., как и в описанном выше случае, процесс абсорбции лимитируется массоотдачей в газовой фазе.
При больших значениях НА
Т. е. сопротивление массопередаче сосредоточено в жидкой фазе.
Кинетические модели газожидкостных реакций. В промышленных условиях взаимодействие газообразных и жидких реагентов происходит, как правило, в проточных реакторах, где на процесс абсорбции значительное влияние оказывает интенсивность перемешивания. Перемешивание газожидкостной системы ведет к увеличению и обновлению поверхности контакта фаз и тем самым способствует росту производительности реактора.
Перемешивание может осуществляться разными методами. Одним из вариантов перемешивания является применение барботажа газа через жидкость (например, в тарельчатых колоннах), когда его пузырьки служат своеобразными перемешивающими агентами. Жидкость может перемешиваться и механическими мешалками, в том числе и при одновременном использовании пузырьков газа. Перемешиванию жидкости способствует турбулентный характер движения потока при ее стекании по вертикальной или наклонной стенке. Возможно, также распределение жидкости в виде капель или струи в газовом потоке.
Во всех этих случаях для абсолютно строгого описания процесса абсорбции необходимо совместно решить уравнения диффузионного и конвективного переноса, химической кинетики и т. д. Часто затруднительно не только решить, но и правильно составить такую систему уравнений. Поэтому на практике используют упрощенные модели, которые, однако, достаточно хорошо подтверждаются экспериментальными данными. Наиболее распространены пленочная модель и модели обновления поверхности.
Пленочная модель Основывается на предположении о том, что у поверхности жидкости, граничащей с газом, имеется неподвижная пленка (диффузионный слой) толщиной д. В пределах этой пленки газообразный реагент переносится исключительно вследствие молекулярной диффузии при полном отсутствии конвективного переноса. Принимается, что состав основной массы жидкости за пределами пленки однороден вследствие перемешивания, а изменение концентрации растворяемого реагента от величины СА,G (постоянная концентрация в газовой фазе) до CA,L (концентрация в основной массе жидкости) происходит внутри пленки (см. рис. 7.8, А, б). При отсутствии химической реакции между растворяемым компонентом А и растворителем профиль концентрации компонента А будет линейным (линия 1). Массоотдача от газа к жидкости через пограничную пленку описывается законом Фика для молекулярной диффузии:
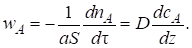

Рис. 7.8. Схема пленочной модели (А) и профиль изменения концентрации растворяемого компонента А (Б): 1, 2 - Соответственно при отсутствии и наличии химической реакции
В стационарном режиме поток через поверхность будет постоянным, следовательно, при постоянстве коэффициента молекулярной диффузии

(7.47)
Тогда

Где вL - коэффициент массоотдачи в диффузионной пленке.
Коэффициент массоотдачи
(7.48)
При химической реакции между растворяемым реагентом А и веществом В, находящимся в жидкой фазе,
А А + bВ Продукты
Газ жидкость
Уменьшение концентрации реагента А в пограничной пленке происходит не только вследствие диффузионных процессов, но и в связи с расходованием его на реакцию. Профиль концентрации в пограничном слое вследствие этого искривляется (кривая 2). Это приводит к увеличению градиента концентрации реагента у границы раздела фаз (растет числовое значение тангенса угла наклона касательной к кривой СА(Z) в точке М, равное grad CA). В результате произойдет увеличение скорости переноса вещества из газовой фазы в жидкую WA = D Grad СA, что, как указывалось, и является характерной чертой газожидкостных реакций.
Формально в рамках пленочной модели можно ввести и коэффициент ускорения абсорбции под влиянием химической реакции. Криволинейный профиль концентрации реагента А внутри пограничной пленки при наличии реакции можно условно изобразить ломаной линией (рис. 7.9). В соответствии с этим приближением изменение концентрации реагента происходит в пленке, имеющей толщину д/. "Уменьшение" толщины пленки приведет к росту коэффициента массоотдачи

(7.49)
Где в/L - коэффициент массоотдачи при наличии химической реакции; е - коэффициент ускорения абсорбции при наличии химической реакции, показывающий, во сколько раз увеличится скорость абсорбции при наличии химической реакции в жидкой фазе (е = в/L / вL).
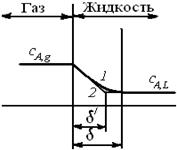
Рис. 7.9. Аппроксимация нелинейного концентрационного профиля при наличии химической реакции: 1 - реальный (нелинейный); 2 - приближенный
С учетом уравнения (7.49) выражение (7.46) примет вид

Если модель Двухпленочная, считают, что пограничный диффузионный слой, примыкающий к границе раздела фаз, имеется со стороны не только жидкой фазы, но также и газовой фазы.
Пленочная модель газожидкостных реакций лишь приближенно описывает гетерогенный процесс в системе "газ - жидкость". В действительности, конечно, изменение концентрации растворяемого реагента происходит не только внутри очень тонкой пленки, имеющей к тому же везде одинаковую толщину, но и в основной массе потока. Однако, как показала практика, количественные расчеты на основе пленочной модели, как правило, мало отличаются от результатов, полученных с использованием более сложных моделей. Поэтому применение пленочной модели, опирающейся на сравнительно простой математический аппарат, часто является оправданным.
Модели обновления поверхности (или модели проницания) основываются на предположении о том, что через некоторые промежутки времени происходит замещение элементов жидкости у поверхности раздела фаз жидкостью из глубинных слоев, состав которой такой же, как и средний состав основной массы. Пока элемент жидкости находится у поверхности и соприкасается с газом, абсорбция газа жидкостью происходит при таких условиях, как если бы этот элемент был неподвижен и имел бесконечную глубину. Скорость абсорбции является в такой модели функцией предполагаемого "времени пребывания" элемента жидкости у поверхности раздела фаз. В начальный период, когда ф = 0, скорость велика, а по мере увеличения времени пребывания уменьшается.
Таким образом, абсорбцию газа жидкостью в соответствии с моделями обновления поверхности рассматривают как нестационарный процесс, когда условия абсорбции непостоянны во времени.
В первоначальном варианте модели обновления поверхности принимали, что каждый элемент жидкости у поверхности соприкасается с газом перед заменой другим элементом жидкости основного состава в течение одного и того же промежутка времени ф. За это время элемент жидкости абсорбирует единицей своей поверхности одно и то же количество Q Газа, соответствующее сделанным предположениям о неподвижности жидкости. Средняя скорость абсорбции составит Q/Ф.
В действительности время пребывания отдельных элементов жидкости у поверхности раздела фаз неодинаково. В разных вариантах моделей обновления поверхности принимают различные виды распределения времени пребывания отдельных элементов жидкости.
Модели обновления поверхности для случая абсорбции газов перемешивающимися жидкостями представляются более реалистичными. Однако математический аппарат, используемый в них, существенно сложнее, чем у пленочной модели. В то же время количественные прогнозы, сделанные на основе пленочной модели, как правило, мало отличаются от расчетов, выполненных на основе моделей обновления поверхности.
Вопросы и упражнения
Для повторения и самостоятельной работы
- 1. В чем заключается главная кинетическая особенность гетерогенных химических процессов? 2. Какие кинетические модели обычно используют для описания гетерогенных процессов в системах "газ - твердое", "газ - жидкость"? 3. Какой смысл вкладывается в понятия "кинетическая область гетерогенного процесса" и "диффузионная область"? 4. Как увеличить коэффициент массоотдачи на стадии внешней диффузии? 5. Выведите уравнение для расчета константы скорости гетерогенного процесса в системе "газ - твердое", включающего химическую реакцию первого порядка. 6. Изобразите профиль изменения концентрации газообразного реагента, при протекании гетерогенного процесса, описываемого моделью с фронтальным перемещением зоны реакции в случаях:
- А) когда гетерогенный процесс лимитируется внешней диффузией; Б) когда гетерогенный процесс лимитируется внутренней диффузией; В) когда гетерогенный процесс лимитируется химической реакцией; Г) когда гетерогенный процесс не имеет лимитирующей стадии (протекает в переходной области).
Похожие статьи
-
Диффузионные стадии - Химические процессы и реакторы
В результате протекания гетерогенной химической реакции в разных точках реакционного пространства устанавливаются различные концентрации реагирующих...
-
Гетерогенные процессы в системе "газ - твердое вещество" - распространенный вид промышленных химико-технологических процессов. Это процессы обжига...
-
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ, Общие особенности - Химические процессы и реакторы
Большинство химических реакций, используемых в химико-технологических процессах, протекает с участием веществ, находящихся в разных фазах. В зависимости...
-
Скорость гомогенных химических реакций - Химические процессы и реакторы
Скорость химической реакции W RJ принято выражать количеством (моль) N J одного из реагентов или продуктов, прореагировавшим (или образовавшимся) в...
-
Способы изменения скорости простых и сложных реакций - Химические процессы и реакторы
Как указывалось, скорость химической реакции зависит от большого числа различных факторов. Из кинетических уравнений следует, прежде всего, что скорость...
-
В современной химии известно большое число различных химических реакций. Многие из них осуществляются в промышленных химических реакторах и,...
-
Как видно из примеров 5.1 и 5.2, при одинаковых условиях проведения одной и той же реакции для достижения равной глубины превращения среднее время...
-
Реактор идеального смешения - Химические процессы и реакторы
Для модели идеального смешения принимается ряд допущений. Допускается, что в результате интенсивного перемешивания устанавливаются абсолютно одинаковые...
-
Прежде чем рассмотреть отдельные типы химических реакторов в соответствии с приведенной классификацией, составим уравнение материального баланса по...
-
Равновесие химических реакций - Химические процессы и реакторы
Под воздействием подвода или отвода энергии в форме теплоты или работы происходит изменение состояния термодинамической системы (значений...
-
Теоретические основы процесса Реакторы смешения - это емкостные аппараты с мешалкой или циркуляционным насосом. Человечество давно пользуется...
-
Об эффективности осуществления любого промышленного процесса судят прежде всего по экономическим показателям, таким, как приведенные затраты,...
-
Структура математической модели химического реактора - Химические процессы и реакторы
Математические модели высоких уровней иерархии включают в себя, как правило, несколько уравнений, как конечных, не содержащих операторов...
-
В предыдущих параграфах были рассмотрены варианты тепловых режимов химических реакторов и способы учета теплопереноса в реакторе при разработке...
-
Каскад реакторов идеального смешения - Химические процессы и реакторы
Каскад представляет собой несколько последовательно соединенных проточных реакторов (секций) идеального смешения (рис. 5.9). Реакционная смесь проходит...
-
Реактор идеального вытеснения - Химические процессы и реакторы
Реактор идеального вытеснения представляет собой длинный канал, через который реакционная смесь движется в поршневом режиме (рис. 5.4). Каждый элемент...
-
Скорость химического превращения зависит от большого числа переменных. Результаты экспериментальных исследований различных реакций показали, что на...
-
Классификация химических реакторов и режимов их работы - Химические процессы и реакторы
Химические реакторы для проведения различных процессов отличаются друг от друга по конструктивным особенностям, размеру, внешнему виду. Однако, несмотря...
-
Расчет равновесия по термодинамическим данным - Химические процессы и реакторы
Расчет константы равновесия и изменения энергии Гиббса позволяет определить равновесный состав реакционной смеси, а также и максимально возможное...
-
Уравнение теплового баланса. Тепловые режимы химических реакторов - Химические процессы и реакторы
В уравнении теплового баланса учитываются все тепловые потоки, входящие в реактор и выходящие из него. Такими потоками являются: Q Вых - физическая...
-
ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ПРОЦЕСС И ЕГО СОДЕРЖАНИЕ - Химические процессы и реакторы
Химико-технологический процесс представляет собой совокупность операций, позволяющих получить целевой продукт из исходного сырья. Все эти операции входят...
-
Исходные данные для расчета реакторов - Проектирование химического реактора идеального смешения
При выборе конструкции и определении размеров реактора необходимо принимать во внимание различные факторы и, прежде всего, располагать данными о скорости...
-
Общие понятия и определения. Термодинамический и кинетический критерий реакционной способности химической системы. Скорость химической реакции. Факторы,...
-
Центральным аппаратом в любой химико-технологической системе, включающей целый ряд машин и аппаратов, соединенных между собой различными связями,...
-
Химическая термодинамика позволяет решать вопрос о направлении протекания химических реакций и оценить предельно достижимые (равновесные) состояния...
-
Рассмотрение химических реакторов как сложных объектов в рамках иерархического подхода целесообразно провести на основе предварительного построения...
-
Тепловая устойчивость химических реакторов - Химические процессы и реакторы
При анализе совместного решения уравнений материального и теплового балансов адиабатического реактора идеального смешения для экзотермических реакций...
-
Проточный реактор идеального смешения в неизотермическом режиме - Химические процессы и реакторы
При составлении балансовых уравнений в качестве элементарного объема для реактора идеального смешения принимают полный реакционный объем V. Тепловые...
-
Способы смещения равновесия - Химические процессы и реакторы
Положение равновесия всегда зависит от внешних условий, а так как внешние условия не могут сохраняться неизменными, то равновесие рано или поздно...
-
ТЕПЛОПЕРЕНОС В ХИМИЧЕСКИХ РЕАКТОРАХ - Химические процессы и реакторы
Характер распределения температуры в химическом реакторе чрезвычайно важен при анализе протекающих в нем процессов, так как температура - один из...
-
Зависимость константы равновесия от температуры - Химические процессы и реакторы
Функциональная зависимость константы равновесия от температуры при постоянном давлении передается Уравнением изобары Вант-Гоффа (2.9) Где ?H° -...
-
Стехиометрия химических реакций - Химические процессы и реакторы
Для описания химических реакций, лежащих в основе промышленных химико-технологических процессов, используют основные законы химии - законы стехиометрии,...
-
Реакторами идеального (полного) смешения называются реакторы непрерывного действия, в которых осуществляется турбулентный гидродинамический режим. В них...
-
СО2 + С = 2СО Если известно, что для СО2 ДG2980 = - 394572 Дж/моль и для СО ДG2980 = - 137334 Дж/моль. Рассчитаем ДG2980 = 2ДGСО - ДGСО2 = 2*(137,334)...
-
Химическая технология как наука
Внешняя диффузная область протекания гетерогенного процесса в системе газ/твердое вещество. Для расчета скорости процесса в системе газ/твердое вещество...
-
Химическое равновесие - Скорость химических процессов. Химическое равновесие, принцип Ле-Шателье
Химическое равновесие и его признаки. Равновесие истинное и заторможенное (ложное). Принцип Ле-Шателье. Константа равновесия и ее связь с...
-
Общие сведения Гетерогенные реакции еще труднее для изучения, чем гомогенные, и в обычных учебниках общей химии им уделяется мало внимания, хотя они...
-
Материальный баланс производства Основанием для получения уравнения реактора любого типа является материальный баланс, составленный по одному из...
-
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально...
-
Система усовершенствованных моделей позволяет удовлетворительно воспроизводить кинетику СО-токсичности ДВС при изменении нагрузки, цикловой подачи...
Гетерогенные процессы в системе "газ - жидкость" - Химические процессы и реакторы