Антациды - Лекарственные препараты, применяемые при заболеваниях желудочно-кишечного тракта
Антациды - (от греч. ?нф?- -- против, лат. acidus -- кислый) -- лекарственные препараты, механизм действия которых основан на химической нейтрализации кислоты желудочного сока.
Состав антацидных препаратов
Основными кислотонейтрализующими действующими веществами современных антацидов являются соединения магния, алюминия и кальция. Многие из современных антацидных препаратов, кроме того, содержат компоненты, воздействующие на желудочно-кишечный тракт, иным, отличным от нейтрализации кислоты способом: слабительные, ветрогонные, спазмолитики, анастетики и другие.
Всасывающиеся антациды. Всасывающимися называют антациды, которые или сами, или продукты их реакции с кислотой желудочного сока растворяются в крови. Положительным качеством всасывающихся антацидов является быстрое снижение кислотности после приема лекарства. Отрицательными -- кратковременность действия, увеличение секреции соляной кислоты после окончания действия лекарства.
Примеры всасывающихся антацидов:-гидрокарбонат натрия (пищевая сода)
- -карбонат кальция -карбонат магния основной -магния оксид -смесь "Бурже" (смесь бикарбоната, сернокислого и фосфорнокислого натрия) -лекарственные препараты "Ренни", "Тамс", "Эндрюс антацид" (смесь карбоната кальция и карбоната магния).
Ренни - Кальция карбонат + Магния карбонат
Определение подлинности. 1. Определение ионов Mg2+
К 1 мл раствора субстанции, содержащей ион магния (0.002-0.005 г магния), добавляют 1 мл раствора аммония хлорида, 1 мл раствора аммиака и 0,5 мл раствора фосфата натрия; образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и уксусной кислоте:
Мg2+ + Na2HPO4 + NH3 NH4Cl NH4МgPO4+ 2 Na+
- 2. Определение ионов Ca2+ - 1 мл раствора соли кальция (0,002--0,02 г иона кальция) прибавляют 1 мл раствора оксалата аммония
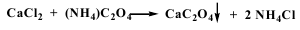
Образуется белый осадок. Осадок нерастворим в разведенной уксусной кислоте и растворе аммиака, растворим в разведенных минеральных кислотах. Соль кальция, смоченная хлористоводородной кислотой и внесенная в бесцветное пламя, окрашивает его в кирпично-красный цвет.
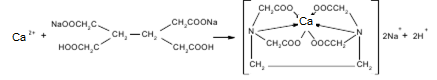
Количественное определение. В мерную колбу емкостью 25 мл вносят навеску порошка 0,1 г, растворяют в разведенной соляной кислоте, объем доводят до метки. 10 мл полученного раствора переносят в колбу для титрования и нейтрализуют NAOH по индикатору метиловому красному.
Далее прибавляют избыток раствора гидроксида, индикаторную смесь мурексида и титруют 0,05 М трилоном Б (А мл) до перехода красного окрашивания в фиолетовое. 1 мл 0,05 М трилона Б соответствует 0,005004 г кальция карбоната.
Са2+ + Ind = CaInd
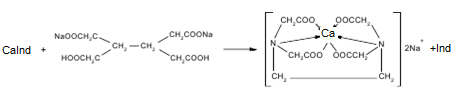
Т(трилонБ/Са2+)=C(трилонБ)*М(CaCO3)/1000
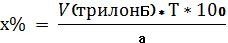
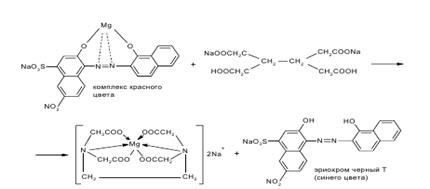
В колбу для титрования вносят 10 мл ранее подготовленного раствора, нейтрализуют NAOH по индикатору метиловому красному. Прибавляют индикатор эриохром черный Т и сумму препаратов титруют 0,05 М трилоном Б (Б мл) до появления сине-фиолетового окрашивания.
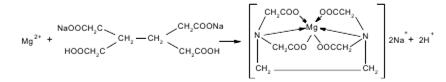
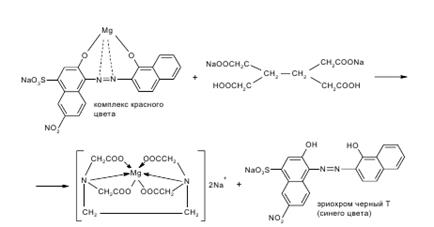
Количество 0,05 М раствора трилона Б, израсходованного на титрование магния карбоната Х, рассчитывают по разности Х=Б-А
Т(трилонБ/Mg2+)=C(трилонБ)*М(MgCO3)/1000
Алмагель - Моногидрат оксида алюминия+Магния гидроксид
Определение подлинности. 1. Определение ионов Mg2+
Мg2+ + Na2HPO4 + NH3 NH4Cl NH4МgPO4+ 2 Na+
Образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и уксусной кислоте
2. Определение ионов Аl3+:
При прокаливании с раствором кобальта нитрата образуется кобальта алюминат синего цвета - "тенарова" синь
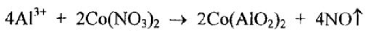
Количественное определение.
В мерную колбу емкостью 25 мл вносят навеску препарата 0,1 г, растворяют в разведеной соляной кислоте, объем доводят до метки.
10 мл полученного раствора переносят в колбу для титрования и нейтрализуют NаOH по индикатору метиловому красному.
Прибавляют индикатор эриохром черный Т и сумму препаратов титруют 0,05 М трилоном Б (А мл) до появления сине-фиолетового окрашивания.
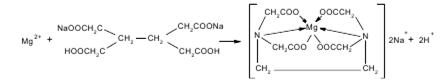
Т(трилонБ/Мg2+)=C(трилонБ)*М(MgCO3)/1000
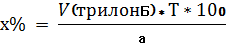
10 мл полученного раствора переносят в колбу для титрования и нейтрализуют NаOH. Добавляют избыток 0,05М трилона Б (Б мл) и титруют раствором нитрата свинца с гексаметилентетрамином рН=6. Индикатор - ксиленовый оранжевый.
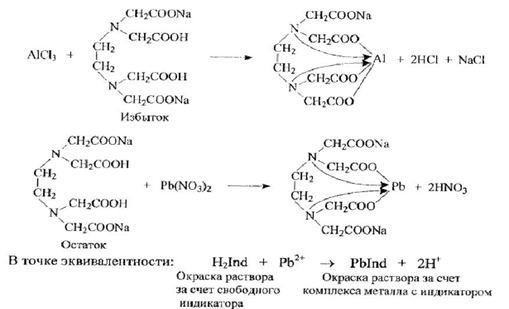
Количество 0,05 М раствора трилона Б, израсходованного на титрование алюминия Х, рассчитывают по разности Х=Б-А
Т(трилонБ/Мg2+)=C(трилонБ)*М(AlCl3)/1000
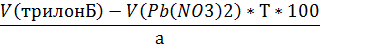
Похожие статьи
-
Опытный образец: Получают молекулярный кислород, добавляя кислород в носитель в количестве 0,2 до 1,0%. После чего газ, как правило, проходит через...
-
Методика: расворяют 50 мг анализируемого вещества в гексане R, затем разбавляют до 50,0 мл тем же растворителем. Эталонный раствор (А): растворяют 50 мг...
-
Время удерживания (абсолютное) - это отрезок времени, который проходит с момента ввода вещества в колонку до появления максимума пика вещества на...
-
Оценка качества лекарственных средств, Определение подлинности - Аскорбиновая кислота
Определение подлинности Химический аскорбиновый кислота При определении подлинности используют восстановительные и кислотные свойства аскорбиновой...
-
Это метод который нашел мировое применение для анализа лекарствнных средств. Он основан на свойстве галогенидов количественно осаждаться нитратом серебра...
-
Особенности анализа органических соединений
Особенности анализа органических соединений: - Реакции с органическими веществами протекают медленно с образованием промежуточных продуктов. -...
-
Фенолфталеин - один из наиболее широко используемых индикаторов, особенно при объемном определении слабых кислот. Он обладает рядом преимуществ: не...
-
ВЛИЯНИЕ ПРИРОДЫ НОСИТЕЛЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ В МАЗЯХ - Производство мазей
В некоторых работах, опубликованных в последние годы, все настойчивее проводится мысль, что основы для мазей по их способности обеспечивать наиболее...
-
Контроль качества лекарственного средства Стандарт качества лекарственных средств -- нормативный документ, содержащий перечень нормируемых показателей и...
-
Магнитные материалы, применяемые при изготовлении трансформаторов - Расчет трансформатора
Основным элементом конструкции трансформаторов и дросселей являются магнитопровод. Назначение магнитопровода заключается в том, чтобы создать замкнутый...
-
Практическое применение - Методы осаждения
Наиболее широкое применение в практике имеет метод Фоль-гарда (тиоцианатометрия), с помощью которого находят содержа-ние галогенидов в кислой среде....
-
Применение . При железодефицитной анемии различной этиологии (постгеморрагической, агастральной, анэнтеральной, хлорозе, анемии беременных и кормящих...
-
Практическое применение - Йодометрия
Йодометрия является весьма универсальным методом. Йодометрически можно определять восстановители, окислители, кис-лоты и вещества, не обладающие...
-
Соединение Магния., Неорганические соединения магния. - Химический элемент Магний
Для аналитической химии магния имеют значение его труднорастворимые и особенно внутрикомплексные (бесцветные, окрашенные или флуорисцирующие) соединения....
-
Что такое гравиметрический фактор F - Основы аналитической химии
Если мы знаем A - навеску анализируемой пробы, b - массу осадка и его состав, то мы можем вычислить содержание определяемого вещества X . X = a*F*100/b...
-
Приготовление растворов - Расчеты при приготовлении водных растворов
Концентрация растворов Масса раствора состоит из массы вещества и массы воды, т. е. Концентрация раствора Для дезинфекции чаще всего используются...
-
Химические препараты - Химия в быту
Человек чуть ли не с рождения сталкивается с химией, точнее с химическими препаратами, которые окружают нас везде. Возьмите элементарное мытье посуды,...
-
Парентеральные вмешательства - Расчеты при приготовлении водных растворов
Введение инсулина Инсулин - гормон поджелудочной железы, назначающийся пациентам, страдающим сахарным диабетом. Один миллилитр инсулина содержит сорок...
-
Дихлорангидрид изофталевой кислоты Бесцветные кристаллы с резким запахом; Тпл. = 42-44°С; Ткип. = 119-121 °С при 6 мм рт. ст. Дихлорангидрид терефталевой...
-
Количественный анализ - это совокупность, химических, физико-химических и физических методов определения количественного соотношения компонентов,...
-
Литература, Ключевые фразы к лекции - Характеристика осадительного титрования
1. Харитонов Ю. Я. "Аналитика. Аналитическая химия", - М., "В. Ш.", ч. II, 2003 г., - с. 245 - 270. 2. Пономарев В. Д. "Аналитическая химия". - М., "В....
-
Классификация, Кривые осадительного титрования - Характеристика осадительного титрования
Наиболее широкое применение нашли следующие виды осадительного титрования: 1. Аргентометрия. Титрант - нитрат серебра, используется для количественного...
-
Фторид - Свойства и формы содержания анионов металлов I аналитической группы
В разбавленном водном растворе HF проявляет кислотные свойства. В водном растворе устанавливаются следующие равновесия: Анион HF2- имеет линейную...
-
Магнийорганические соединения. - Химический элемент Магний
Соединения магния с органическими кислотами. Ацетат магния Mg(CH3COO)2 - хорошо растворимое в воде соединение. Оксалат магния MgC2O4 - труднорастворимое...
-
Исследование снегового покрова. Методика определения ионов Приготовление водной вытяжки Для определения ионов отбираются образцы снегового покрова. Снег...
-
В аргентометрии применяют различные способы установления точки эквивалентности как с помощью индикаторов, так и без них. Метод равного помутнения. Идея...
-
Химические свойства меди - Медь
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро - и теплопроводности медь уступает...
-
Актуальность темы. В современных условиях глобальной конкуренции на все более интегрирующихся мировых рынках, развитие химической промышленности...
-
Общая методика. В круглодонной трехгорлой колбе емкостью 100 мл растворяли 11,9 г бензотриазола (2-аминопиридина) в 20 мл толуола. Колбу соединяли с...
-
Методы анализа - Свойства флавоноидов
Качественное определение. Для обнаружения флавоноидов в ЛРС используют химические реакции и хроматографию. Химические реакции подразделяются на цветные и...
-
Sulfanilamidum * П-Аминобензолсульфамид C6H9N2O2S М. в. 172,21 Получение. 1. Получение ацитилированного хлоралгидрата сульфаниловой кислоты. 2. Получение...
-
Benzoicum - Ароматические соединения
С7Н6О2 М. в. 122,12 Бензойная кислота получила свое название от бензойной смолы, из которой она была впервые выделена в 1608г. Содержится в смоле до 80%....
-
ФИЗИЧЕСКИЕ СВОЙСТВА, ХИМИЧЕСКИЕ СВОЙСТВА - Никель глазами химика
Металлический никель имеет серебристый цвет с желтоватым оттенком, очень тверд, вязкий и ковкий, хорошо полируется, притягивается магнитом, проявляя...
-
Дозы и концентрации - Лекарственные средства
Действие лекарственных средств в большой степени определяется их дозой. В зависимости от дозы (концентрации) меняются скорость развития эффекта, его...
-
Методы, применяющиеся для синтеза мультиферроиков - Мультиферроики
Для синтеза мультиферроиков используются различные методы синтеза. К ним относятся: спекание, гидротермальный синтез, соосаждение, золь-гель метод,...
-
Вибір індикаторів при кислотно-основному титруванні - Теоретичні основи аналітичної хімії
Умовою правильного визначення точки еквівалентності є те, щоб різниця значень рТ індикатора і рН розчину в точці еквівалентності була якнайменша....
-
Основные опасности при перегонке связаны с использованием электрических нагревательных приборов (электроплитки, колбонагреватели). 1. Шнур (нельзя...
-
5.1 Основные опасности при работе с концентрированными кислотами 1. Сильные неорганические кислоты при попадании на кожу вызывают химические ожоги. При...
-
Выполнение реакции. Реактив - хлорцинкиод. В первой склянке растворяют 2 г хлорида цинка в 10 мл воды (раствор А). В другой склянке растворяют 2,1 г...
-
Получение тиосульфата натрия при мышьяково-содовой очистке газов - Тиосульфат натрия
В процессе очистки от сероводорода коксового и других промышленный газов мышьяково-содовым методом, помимо основной реакции: Протекают побочные реакции,...
Антациды - Лекарственные препараты, применяемые при заболеваниях желудочно-кишечного тракта