Особенности анализа органических соединений
Особенности анализа органических соединений:
- - Реакции с органическими веществами протекают медленно с образованием промежуточных продуктов. - Органические вещества термолабильны, при нагревании обугливаются.
В основе фармацевтического анализа органических лекарственных веществ лежат принципы функционального и элементного анализа.
Функциональный анализ - анализ по функциональным группам, т. е. атомам, группам атомов или реакционным центрам, которые определяют физические, химические или фармакологические свойства препаратов.
Элементный анализ используют для испытания подлинности органических лекарственных веществ, содержащих в молекуле атомы серы, азота, фосфора, галогенов, мышьяка, металлов. Атомы этих элементов находятся в элементоорганических лекарственных соединениях в неионизированном состоянии, необходимым условием испытания их подлинности является предварительная минерализация.
Галогенсодержащие соединения - это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на атомы галогенов - F, Br, Cl или I.
Это могут быть жидкие, твердые и газообразные вещества. Газообразные и жидкие соединения в основном обладают наркотическим действием. Эффект снижается от F - Cl - Br - I. Йодопроизводные в основном обладают антисептическим действием. Связь C-F; C-I; C-Br; C-Cl является ковалентной, поэтому для фармацевтического анализа ионные реакции используют после минерализации вещества.
Подлинность препаратов жидких галогенпроизводных углеводородов устанавливают по физическим константам (температура кипения, плотность, растворимость) и по наличию галогена. Наиболее объективным является способ установления подлинности по идентичности ИК-спектров препарата и стандартных образцов.
Для доказательства наличия галогенов в молекуле используют пробу Бейльштейна и различные методы минерализации.
Таблица 1. Свойства галогенсодержащих соединений
|
Хлорэтил Aethylii cloridum (МНН Ethylchloride) |
Phthorothanum Фторотан
|
Bromcamphora Бромкамфора 3-бром-1,7,7,триметилбицикло[2,2,1]-гептанон-2 |
|
CH3-CH2Cl Жидкость прозрачная, бесцветная, легко летучая, со своеобразным запахом, трудно растворима в воде, со спиртом и эфиром смешивается в любых соотношениях. | 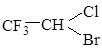
Жидкость без цвета, прозрачная, тяжелая, летучая, с характерным запахом, мало растворима в воде, смешивается со спиртом, эфиром, хлороформом. | 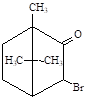
Белый кристаллический порошок или бесцветные кристаллы, запаха и вкуса, очень плохо растворим в воде, легко в спирте и хлороформе. |
|
Bilignostum pro injectionibus Билигност Бис-(2,4,6-трийод-3-карбоксианилид) адипиновой кислоты |
Bromisovalum Бромизовал 2-бромизовалерианил-мочевина | |
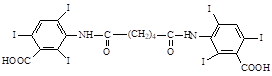
Белый кристаллический порошок, слабо горького вкуса, практически не растворим в воде, спирте, хлороформе. | 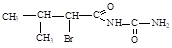
Белый кристаллический порошок или бесцветные кристаллы со слабым специфическим запахом, мало растворим в воде, растворим в спирте. |
Проба Бейльштейна
Наличие галогена доказывается путем прокаливания вещества в твердом состоянии на медной проволоке. В присутствии галогенов, образуются галогениды меди, окрашивающие пламя в зеленый или сине-зеленый цвет.
Галогены в органической молекуле связаны ковалентной связью, степень прочности которой зависит от химического строения галогенпроизводного, поэтому для отщепления галогена перевода его в ионизированное состояние необходимы различные условия. Образовавшиеся галогенид-ионы обнаруживают обычными аналитическими реакциями.
Хлорэтил
- Метод минерализации - кипячение со спиртовым раствором щелочи (учитывая низкую температуру кипения, определение ведут с обратным холодильником).
CH3CH2Cl+KOH c KCl +C2H5OH
Спирт
Образовавшийся хлорид-ион обнаруживают раствором серебра нитрата по образованию белого творожистого осадка.
Сl - + AgNO3 > AgCl + NO3-
Фторотан
- Метод минерализации - сплавление с металлическим натрием
F3C-CHClBr + 5Na + 4H2O> 3NaF + NaCl + 2NaBr + 2CO2
Образовавшиеся хлорид - и бромид - ионы обнаруживают раствором серебра нитрата по образованию белого творожистого и желтоватого осадков.
Фторид-ион доказывают реакциями:
- - реакция с раствором ализаринового красного и раствором нитрата циркония, в присутствии F - красное окрашивание переходит в светло-желтое; - взаимодействие с растворимыми солями кальция (выпадает белый осадок фторида кальция); - реакция обесцвечивания роданида железа (красный). - При добавлении к фторотану конц. H2SO4, препарат находится в нижнем слое.
Бромизовал
- Метод минерализации - кипячение со щелочью (щелочной гидролиз в водном растворе), появляется запах аммиака:
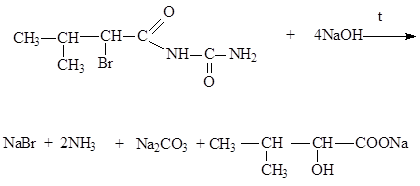
Бромид-ион определяют реакцией с хлорамином Б.
- Нагревание с конц. серной кислотой - запах изовалериановой кислоты
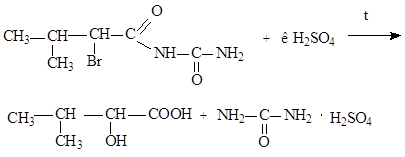
Бромкамфора
- Метод минерализации методом восстановительная минерализация (с металлическим цинком в щелочной среде)
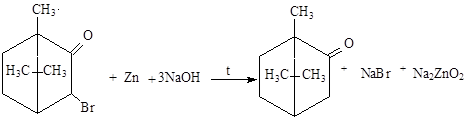
Бромид-ион определяют реакцией с хлорамином Б.
Билигност
- - Метод минерализации - нагревание с концентрированной серной кислотой: отмечается появление фиолетовых паров молекулярного йода. - ИК-спектроскопия - 0,001% раствор препарата в 0,1 н растворе натрия гидроксида в области от 220 до 300 нм имеет максимум поглощения при л=236 нм.
Йодоформ
- - Методы минерализации:
- 1) пиролиз в сухой пробирке, выделяются фиолетовые пары йода 4CHI3 + 5O2 > 6I2 + 4CO2 + 2H2O 2) нагревание с конц. серной кислотой 2CHI3 + H2SO4 > 3I2 + 2CO2 + 2H2O + SO3
Доброкачественность (чистота галогенсодержащих углеводородов).
Проверку доброкачественности хлорэтила и фторотана проводят, устанавливая кислотность или щелочность, отсутствие или допустимое содержание стабилизаторов (тимола во фторотане - 0,01%), посторонних органических примесей, примесей свободного хлора (брома во фторотане), хлоридов, бромидов, нелетучего остатка.
- 1) Хлорэтил: 1. Определяют t кипения и плотность, 2. Недопустимую примесь спирта этилового (реакция образования йодоформа) 2) Билигност: 1. Нагревание с кH2SO4 и образование фиолетовых паров I2 2. ИК-спектроскопия 3) Фторотан: 1. ИК-спектроскопия 2. t кипения; плотность; показатель преломления 3. не должно быть примесей Cl - и Br-
Количественное определение хлорэтила ГФ не предусматривает, но оно может быть выполнено методом аргентометрии или меркуриметрии.
Метод количественного определения - обратное аргентометрическое титрование по Фольгарду после минерализации (реакцию см. в определении подлинности).
1. Реакция перед титрованием:
Фармацевтический лекарственный хлорэтил титрование
NaBr + AgNO3 > AgBrv+ NaNO3
2. Реакция титрования:
AgNO3 + NH4SCN > AgSCN v + NH4NO3
- 3. В точке эквивалентности: 3NH4SCN + Fe(NH4)(SO4)2 > Fe (SCN)3v + 2 (NH4)2SO4
Fэкв=1,
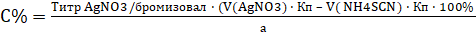
Метод количественного определения - аргентометрическое титрование по Кольтгоффа после минерализации (реакции см. в определении подлинности).
- 1. Реакция перед титрованием: 3NH4SCN + Fe(NH4)(SO4)2 > Fe (SCN)3 + 2 (NH4)2SO4
Точное количество буровато-красный
2. Реакция титрования:
NaBr + AgNO3 > AgBrv+ NaNO3
3. В точке эквивалентности:
AgNO3 + NH4SCN > AgSCNv + NH4NO3
Обесцвечивание
Fэкв=1,
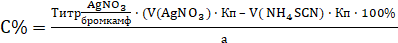
Билигност
Метод количественного определения - косвенная йодометрия после окислительного расщепления билигноста до йодата при нагревании с раствором перманганата калия в кислой среде, избыток перманганата калия удаляют с помощью нитрата натрия, а для удаления избытка азотистой кислоты к смеси прибавляют раствор мочевины.
Титрант - 0,1 моль/л раствор натрия титсульфата, индикатор - крахмал, в точке эквивалентности наблюдают исчезновение синей окраски крахмала.
Схема реакции:
T; KMnO4+H2SO4
RI6 > 12 IO3-
Реакция выделения заместителя:
КIO3 + 5KI + 3H2SO4 >3I2 + 3K2SO4 + 3H2O
Реакция титрования:
Крахмал
I2+2Na2S2O3 > 2NaI+Na2S4O6
Fэкв=1/36
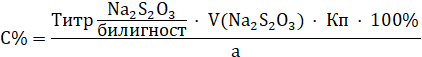
Йодоформ
Метод количественного определения - обратное аргентометрическое титрование по Фольгарду после минерализации.
Минерализация:
CHI3 + 3AgNO3 + H2O> 3AgI + 3HNO3 + CO2
Избыток
Реакция титрования:
AgNO3 + NH4SCN > AgSCN v + NH4NO3
В точке эквивалентности:
3NH4SCN + Fe(NH4)(SO4)2 > Fe (SCN)3v + 2 (NH4)2SO4
Fэкв=1/3,
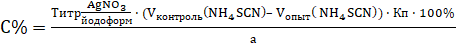
Хранение
Хлорэтил в ампулах в прохладном, защищенном от света месте, фторотан и билигност в склянках оранжевого стекла в сухом прохладном, защищенном от света месте. Бромкамфору хранят в склянках оранжевого стекла в сухом прохладном месте.
Хлорэтил используют для местной анестезии, фторотан для наркоза. Бромкамфору применяют в качестве седативного средства (иногда для остановки лактации). Бромизовал является снотворным средством, билигност применяют в качестве рентгеноконтрастного вещества в виде смеси солей в растворе.
Литература
- 1. Государственная фармакопея СССР / Министерство здравоохранения СССР. - Х изд. - М.: Медицина, 1968. - С. 78, 134, 141, 143, 186, 373,537 2. Государственная фармакопея СССР Вып. 1. Общие методы анализа. Лекарственное растительное сырье / Министерство здравоохранения СССР. - 11-е изд., доп. - М.: Медицина, 1989. - С. 165-180, 194-199 3. Лекционный материал. 4. Фармацевтическая химия. В 2 ч.: учебное пособие / В. Г. Беликов - 4-е изд., перераб. и доп. - М.: МЕДпресс-информ, 2007. - С. 178-179, 329-332 5. Руководство к лабораторным занятиям по фармацевтической химии. Под редакцией А. П. Арзамасцева, стр.152-156.
Приложение 1
Фармакопейные статьи
Bilignostum
Билигност
Adipiodonum *
Бис-(2,4,6-трийод-З-карбоксианилид) адипиновой кислоты
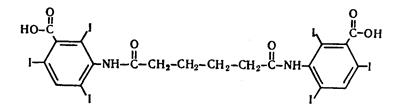
C 20H 14 I 6N 2 O 6 M. в. 1139,8
Описание. Белый или почти белый мелкокристаллический порошок слабо горького вкуса.
Растворимость. Практически нерастворим в воде, 95% спирте, эфире и хлороформе, легко растворим в растворах едких щелочей и аммиака.
Подлинность. 0,001% раствор препарата в 0,1 н. растворе едкого натра в области от 220 до 300 нм имеет максимум поглощения при длине волны около 236 нм.
При нагревании 0,1 г препарата с 1 мл концентрированной серной кислоты выделяются фиолетовые пары йода.
Цветность раствора. 2 г препарата растворяют в 4 мл 1 н. раствора едкого натра, фильтруют и промывают фильтр водой до получения 10 мл фильтрата. Окраска полученного раствора не должна быть интенсивнее эталона № 4б или № 4в.
Проба с перекисью водорода. К 1 мл полученного раствора прибавляют 1 мл перекиси водорода; в течение 10--15 минут не должна появляться муть.
Соединения с открытой аминогруппой. 1 г препарата взбалтывают с 10 мл ледяной уксусной кислоты и фильтруют. К 5 мл прозрачного фильтрата прибавляют 3 капли 0,1 мол раствора нитрита натрия. Через 5 минут появившаяся окраска не должна быть интенсивнее эталона №2ж.
Кислотность. 0,2 г препарата встряхивают в течение 1 минуты с кипящей водой (4 раза по 2 мл) и фильтруют до получения прозрачного фильтрата. Объединенные фильтраты титрую! 0,05 н. раствором едкого натра (индикатор--фенолфталеин). На титрование должно расходоваться не более 0,1 мл 0,05 н. раствора едкого натра.
Хлориды. 2 г препарата взбалтывают с 20 мл воды и фильтруют до получения прозрачного фильтрата. 5 мл фильтрата, доведенные водой до 10 мл, должны выдерживать испытание на хлориды (не более 0,004% в препарате).
Сульфаты. 10 мл того же фильтрата должны выдерживать испытание на сульфаты (не более 0,01% в препарате).
Фосфор. 1 г препарата помещают в тигель и озоляют до получения белого остатка. К остатку прибавляют 5 мл разведенной азотной кислоты и упаривают досуха, после чего остаток в тигле хорошо перемешивают с 2 мл горячей воды и фильтруют в пробирку через маленький фильтр. Тигель и фильтр промывают 1 мл горячей воды, собирая фильтрат в ту же пробирку, затем прибавляют 3 мл раствора молибдата аммония и оставляют на 15 минут в бане при температуре 38--40° Испытуемый раствор может иметь желтоватую окраску, но должен оставаться прозрачным (не более 0,0001% в препарате).
Иодмонохлорид. 0,2 г препарата взбалтывают с 20 мл воды и фильтруют до получения прозрачного фильтрата. К 10-мл фильтрата добавляют 0,5 г йодида калия, 2 мл соляной кислоты и 1 мл хлороформа. Хлороформный слой должен оставаться бесцветным.
Железо. 0,5 г препарата должны выдерживать испытание на железо (не более 0,02% в препарате). Сравнение проводят с эталоном, приготовленным из 3,5 мл эталонного раствора Б и 6,5 мл воды.
Сульфатная зола из 1 г препарата не должна превышать 0,1%.
Тяжелые металлы. Сульфатная зола из 0,5 г препарата должна выдерживать испытание на тяжелые металлы (не более 0,001% в препарате).
Мышьяк. 0,5 г препарата должны выдерживать испытание на мышьяк (не более 0,0001 % в препарате).
Количественное определение. Около 0,3 г препарата (точная навеска) помещают в мерную колбу емкостью 100 мл, растворяют в 5 мл раствора едкого натра, доливают водой до метки и перемешивают. 10 мл полученного раствора помещают в колбу емкостью 250 мл, прибавляют 5 мл 5% раствора перманганата калия и осторожно по стенкам колбы, при перемешивании, прибавляют 10 мл концентрированной серной кислоты по 0,5--1 мл и оставляют на 10 минут. Затем прибавляют медленно, по 1 капле через 2--3 секунды, при энергичном перемешивании. раствор нитрита натрия до обесцвечивания жидкости и растворения двуокиси марганца. После этого сразу прибавляют 10 мл 10% раствора мочевины и перемешивают до полного исчезновения пузырьков, смывая при этом со стенок колбы нитрит натрия. Затем к раствору прибавляют 100 мл воды, 10 мл свежеприготовленного раствора йодида калия и выделившийся йод титруют 0,1 н. раствором тиосульфата натрия (индикатор -- крахмал).
1 мл 0,1 н. раствора тиосульфата натрия соответствует 0,003166 г C20H14L6N206, которого в препарате должно быть не менее 99.0%.
Хранение. Список Б. В банках оранжевого стекла, в защищенном от света месте.
Рентгеноконтрастное средство.
Lodoformium
Йодоформ
Трийодметан
СНI3 М. в. 393,73
Описание. Мелкие пластинчатые блестящие кристаллы или мелкокристаллический порошок лимонно-желтого цвета, резкого характерного устойчивого запаха. Летуч уже при обыкновенной температуре, перегоняется с водяным паром. Растворы препарата быстро разлагаются от действия света и воздуха с выделением йода.
Растворимость. Практически нерастворим в воде, трудно растворим в спирте, растворим в эфире и хлороформе, мало растворим в глицерине. жирных и эфирных маслах.
Подлинность, 0,1 г препарата нагревают в пробирке на пламени горелки; выделяются фиолетовые пары йода.
Температура плавления 116--120° (с разложением).
Красящие вещества. 5 г препарата энергично взбалтывают в течение 1 минуты с 50 мл воды и фильтруют. Фильтрат должен быть бесцветным.
Кислотность или щелочность. К 10 мл фильтрата прибавляют 2 капли раствора бромтимолового синего. Появившееся желто-зеленое окрашивание должно перейти в синее от прибавления не более 0,1 мл 0,1 н. раствора едкого натра или в желтое от прибавления не более 0,05 мл 0,1 н. раствора соляной кислоты.
Галогены. 5 мл того же фильтрата, разведенные водой до 10 мл, должны выдерживать испытание на хлориды (не более 0,004% в препарате).
Сульфаты. 10 мл того же фильтрата должны выдерживать испытание на сульфаты (не более 0,01% в препарате).
Зола из 0,5 г препарата не должна превышать 0,1%.
Количественное определение. Около 0,2 г препарата (точная навеска) помещают в коническую колбу емкостью 250--300 мл, растворяют в 25 ли 95% спирта, прибавляют 25 мл 0,1 н. раствора нитрата серебра, 10 мл азотной кислоты и нагревают с обратным холодильником на водяной бане в течение 30 минут, защищая реакционную колбу от света. Холодильник промывают водой, в колбу прибавляют 100 мл воды и избыток нитрата серебра оттитровывают 0,1 н. раствором роданида аммония (индикатор -- железоаммониевые квасцы).
Параллельно проводят контрольный опыт.
1 мл 0,1 н. раствора нитрата серебра соответствует 0,01312 г СНI3, которого в препарате должно быть не менее 99,0%.
Хранение. В хорошо укупоренной таре, предохраняющей от действия света, в прохладном месте.
Похожие статьи
-
Количественный анализ - это совокупность, химических, физико-химических и физических методов определения количественного соотношения компонентов,...
-
Это метод который нашел мировое применение для анализа лекарствнных средств. Он основан на свойстве галогенидов количественно осаждаться нитратом серебра...
-
Принципы получения гибридных соединений на основе квантовых точек и органических хромофоров В литературе для получения соединений, обладающих...
-
АНАЛИТИКА Компиляция выдержек из различных источников - удельная б-активность U235 и U238 составляет соответственно 0,08 и 0,012 Бк/мкг (или 80 и 12...
-
Маслорастворимые молибденсодержащие органические соединения - Молибденсодержащие присадки
В последние годы особый интерес вызывают маслорастворимые молибденсодержащие органические соединения; они не только снижают износ при трении, но и...
-
Кислородсодержащие органические соединения
К числу кислородсодержащих органических соединений, состоящих из атомов С. Н, О, относятся спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, сложные...
-
Также сравнила методики анализа и выявила, что наиболее применяемым методом осаждения является аргентометрия вариантом Фаянса. Это наиболее доступный,...
-
Особенности обработки Погрешность данного метода вызвана: длительностью вспышки (0.5мкс), временем срабатывания анализатора (0.7мкс) и шириной канала...
-
Предмет органической химии. Изучая неорганическую химию, мы знакомились с веществами самого разнообразного состава и при этом ни разу не встречали, чтобы...
-
Метод Е. Грусц-Харди - изолирование смесью спирта и хлороформа Схематично метод можно представить из следующих этапов: * Настаивание измельченного с...
-
Методы анализа - Свойства флавоноидов
Качественное определение. Для обнаружения флавоноидов в ЛРС используют химические реакции и хроматографию. Химические реакции подразделяются на цветные и...
-
Рассмотрим теперь, какое влияние на свойства веществ оказывает порядок соединения атомов в молекуле. Обратимся сначала к историческим фактам. Изучая...
-
Задачи и методы качественного анализа - Основы аналитической химии
Обнаружение или, как иногда говорят, "открытие" отдельных элементов или ионов, входящих в состав веществ - это задачи качественного анализа. Качественный...
-
Выполнение реакции: Реактив - хлорид железа (III) (раствор, содержащий иодид калия). Для его приготовления к 3 мл 10%-го раствора хлорида железа (III)...
-
Этаминал-натрий дает фиолетовую окраску с солями кобальта и изопропиламином. Выполнение реакции. К 2 мл хлороформного раствора исследуемого вещества...
-
Органические кислоты в различных условиях могут разлагаться с образованием предельного углеводорода по общей схеме O R-C RH + CO2 Кислота OH Углеводород...
-
Раствор кислоты аскорбиновой 5% (концентрированный раствор) Определение подлинности 1. К 4-5 каплям р-ра прибавляют 2-3 капли р-ра нитрата серебра;...
-
Оборудования, используемые для определения ртути Класс опасности - 1, ПДК в населенных пунктах (среднесуточная) -- 0,0003 мг/мі ПДК в жилых помещениях...
-
Метод Кьельдаля - обработка серной кислотой так же называют - "мокрое сжигание". Определение количества азота с помощью метода Кьельдаля основано на...
-
По данным о прибыли хозяйств района Таблица 3.1 Исходные данные Наименование хозяйств Урожайность, ц/га Стоимость внесенных удобрений на 1 га ТОО Рассвет...
-
Разработав теорию и подтвердив правильность ее синтезом новых соединений, А. М. Вутлеров не считал теорию абсолютной и неизменной. Он утверждено, что она...
-
Задачи и методы количественного анализа - Основы аналитической химии
Количественный анализ - это совокупность химических, физико-химических и физических методов определения количественного соотношения компонентов, входящих...
-
Комплексные соединения - соед-я, обр-ся сочетанием нескольких, способных к существованию ионов, сост. из атома в опр. валентном сост-ии, связ. с одной...
-
Магнийорганические соединения. - Химический элемент Магний
Соединения магния с органическими кислотами. Ацетат магния Mg(CH3COO)2 - хорошо растворимое в воде соединение. Оксалат магния MgC2O4 - труднорастворимое...
-
Основы новой теории сформулировал 1861 г. профессор Казанского университета Александр Бутлеров. В химии к тому времени уже значительное распространение...
-
Основные опасности при перегонке связаны с использованием электрических нагревательных приборов (электроплитки, колбонагреватели). 1. Шнур (нельзя...
-
Отбор пробы воды следует рассматривать как стадию, в значительной степени определяющую правильность последующего анализа, причем ошибки, допущенные в...
-
В качестве предмета исследования в этом разделе выберем зависимость урожайности (У) от фактора (Х - внесение органических удобрений на 1 га). Таблица 4.1...
-
Химические свойства алюминия и его соединений - Алюминий и его свойства
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид). I. Взаимодействие с простыми...
-
Выполнение реакции. Реактив - хлорцинкиод. В первой склянке растворяют 2 г хлорида цинка в 10 мл воды (раствор А). В другой склянке растворяют 2,1 г...
-
Выполнение реакции. В делительную воронку вносят 0,1 мл раствора исследуемого вещества, прибавляют 0,2 мл 0,1%-го раствора родамина 6Ж и 1мл...
-
Анализ модели - Кинетические закономерности взрывного свечения азида серебра
Рассмотрим процесс развития реакции при произвольной степени разложения. Нас будет интересовать вид кинетических зависимостей концентрации носителей цепи...
-
Общая методика. В круглодонной трехгорлой колбе емкостью 100 мл растворяли 11,9 г бензотриазола (2-аминопиридина) в 20 мл толуола. Колбу соединяли с...
-
Органические кислоты применяются при разложении минерального сырья лишь в единичных случаях, главным образом в фазовом анализе. Наиболее часто для...
-
Обработка смесью серной и азотной кислот - метод Дениже. Данный метод часто используют в агрохимических и почвенных лабораториях. В настоящее время...
-
В сухую колбу Кьельдаля вносят 0,1 г исследуемого продукта, наливают 5 см3 концентрированной серной кислоты. Добавляют небольшое количество катализатора....
-
Использование предшественников при производстве аминокислот позволяет успешно обходить метаболический контроль, осуществляющийся по механизму обратной...
-
Определение галоида по методу Кариуса. Навеску вещества при нагревании окисляют дымящей азотной кислотой в присутствии нитрата серебра. При этом галоид...
-
Минеральные кислоты, используемые для переведения анализируемой пробы в раствор, разделяют на две основные группы. 1) Кислоты, не оказывающие...
-
Задача количественного химического анализа состоит в определении содержания тех или иных элементов в анализируемом материале; при этом главное требование...
Особенности анализа органических соединений