Металлокомплексный катализ
Большое значение координационные соединения приобрели в качестве катализаторов промышленно важных процессов. Запатентовано огромное число различных координационных соединений, катализирующих разнообразные реакции.
Координационные соединения способны активировать молекулы водорода, кислорода, оксида углерода (II), олефинов, ацетиленов и других соединений.
Перейдем к рассмотрению Особенностей металлокомплексного катализа:
- 1) Мягкие условия протекания процессов; 2) Высокая избирательность и стереоселективность; 3) Гомогенность процесса 4) Центральные атомы - переходные металлы и металлы платиновой группы;
Лиганды - молекулы, имеющие вакантные орбитали (СО, олефины, фосфины и т. д.), которые могут взаимодействовать с заполненными орбиталями металла, образуя р-дативные связи.
История открытия и внедрения в промышленность металлокомплексного катализа начинается в 1938 г., когда немецкий химик О. Роелен открыл реакцию, позволяющую превращать олефины в кислородсодержащие соединения. В качестве катализаторов использовались карбонильные соединения переходных металлов. В первую очередь была изучена реакция с этиленом и установлено, что она протекает по двум направлениям:
СН2= СН2 + СО + Н2 => СН3СН2СНО
2СН2= СН2 + СО + Н2 => СН3СН2С(О) СН2 СН3
В промышленности она получила название "оксо-реакции". Однако впоследствии было установлено, что кетоны образуются не из всех олефинов, и поэтому процесс чаще стали называть "Гидроформилированием". В общем виде его можно записать следующим образом:
RCH=CH2 + CO + H2 > RCH2CH2CHO
Наиболее распространенным катализатором данного процесса является HCo(CO)4 , но с успехом применяется и [Rh(PPh3)2(CO)Cl].
В начале 50-х годов в промышленном масштабе начал осуществляться процесс полимеризации этилена (а затем и пропилена) в мягких условиях на катализаторах, впервые предложенных Циглером. Они основаны на галогенидах и алкилгалогенидах металлов, например на TiCl3 и Al(C2H5)2Cl. Ранее в отсутствии этих катализаторов процесс осуществлялся при давлениях порядка 2000 атм (2 * 105 Па). Катализаторы циглеровского типа позволили снизить давление более чем в 100 раз. Не менее важно, что получающиеся при этих условиях полимеры имеют стереорегулярное строение, т. е. для них характерна значительно меньшая разветвленность макромолекул и высокая степень кристалличности. Стереорегулярность этих полимеров была установлена Натта. За основополагающие работы по каталитической полимеризации олефинов при низком давлении Циглер и Натта в 1963г. были удостоены Нобелевской премии.
Миллионы тонн уксусной кислоты в мире получают путем каталитического карбонилирования метанола по реакции:
СН3ОН + СО > СН3СООН
Катализатором процесса служит комплекс [Rh(PPh3)2(CO)Cl], а промотором CH3I. Последний можно получать взаимодействием метанола с йодистоводородной кислотой.
Практически одновременно Шмидт и Хафнер в ФРГ, а Сыркин и Моисеев в СССР разработали каталитический способ промышленного производства ацетальдегида из этилена. При пропускании этилена через водный раствор, содержащий хлорид палладия (II), идет реакция
C2H4 + PdCl2 + H2O > CH3COH + Pd(0) + 2HCl
При наличии в растворе хлорида меди (II) палладий регенерируется в соответствии с уравнением
Pd + 2CuCl2 => PdCl2 + 2CuCl
Окисление меди проводят кислородом воздуха.
Синтез ацетальдегида осуществляют в одну операцию, пропуская смесь этилена и кислорода в реактор, содержащий хлориды палладия (II) и меди (II). металлокомплексный катализ ферментативный промышленность
Помимо промышленных процессов металлокомплексный катализ встречается во многих природных процессах. Примеры таких процессов представлены в таблице.
Природные процессы:

Технологические процессы:
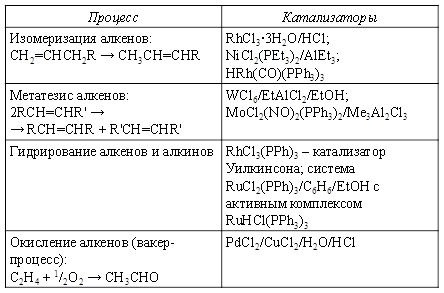


Металлокомплексный катализ можно разделить на следующие виды:
- 1) Гетерогенизированный катализ; 2) Гетерогенный катализ; 3) Гомогенный катализ; 4) Ферментативный катализ; 5) Мицеллярный катализ; 6) Фотокатализ; 7) Электрокатализ; 8) Биоэлектрокатализ; 9) Фотоэлектрокатализ; 10) Межфазный катализ.
Рассмотрим свойства комплексов металлов, определяющих каталитическую активность:
- А) Координационная ненасыщенность центрального атома; Б) Способность координировать различные молекулы; В) Активация лигандов.
Рис. Основные стадии, встречающиеся в металлокомплексном катализе
Применение металлокомплексного катализа:
- 1. Изучение строения природных металлоферментов и механизмов их каталитического действия, разработка искусственных синтетических моделей ферментов; 2. Дизайн металлокомплексных катализаторов для решения проблем экологии и синтеза (в т. ч. крупнотоннажного) необходимых материалов; 3. Новые подходы к изучению и проведению уже известных реакций.
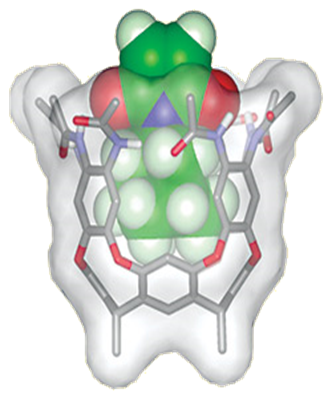
Моделирование ферментативного катализа
"Молекулярная ваза": Подражает работе фермента в том, что кавитанд обладает полостью, способной вместить лишь субстрат подходящего размера и формы. Функциональные группы, обеспечивающие водородное связывание по верхнему ободу кавитанда, активируют субстрат (ненасыщенный имид), оттягивая электронную плотность с кратных связей. Это обстоятельство увеличивает реакционную способность субстрата и увеличивает скорость участия его в реакции Дильса-Альдера с ароматическим спиртом. Размеры продукта не позволяют ему разместиться в полости, полость освобождается и может активировать очередную молекулу субстрата.
Как и любой метод, помимо неоценимых достоинств, металлокомплексный катализ имеет ряд недостатков
|
Достоинства |
Недостатки |
|
Высокая активность |
Необходимость отделения катализатора от продуктов реакции |
|
Селективность |
Регенерация металлокомплексных катализаторов сложно осуществима |
|
Способность осуществлять каталитический процесс в мягких условиях |
Высокая стоимость составляющих катализатора |
|
Необходимость отделения катализатора от продуктов реакции |
Список использованной литературы
- 1. Химическая кинетика : учебное пособие / В. В. Буданов, О. В. Лефедова ; Иван. гос. хим.-технол. ун-т. - Иваново : ИГХТУ, 2011. - 176 с. 2. Химическая кинетика : учебное пособие / В. В. Буданов, Т. Н. Ломова, В. В. Рыбкин. - Санкт-Петербург [и др.] : Лань, 2014. - 283 с. : ил. ; 21 см. 3. Координационная химия / В. В. Скопенко, А. Ю. Цивадзе, Л. И. Савранский, А. Д. Гарновский. - М. : Академкнига, 2007. - 487 с.
Похожие статьи
-
ВИДНЫЕ ДЕЯТЕЛИ ХИМИИ О КАТАЛИЗЕ - Процесс катализа
И. Берцелиус (1837): "Известные вещества оказывают при соприкосновении с другими веществами такое влияние на последние, что возникает химическое...
-
Гомогенный катализ - Гомогенный и гетерогенный катализ
Среди многочисленных каталитических реакций особое место занимает катализ в цепных реакциях. "Цепными реакциями, как известно, называются такие...
-
РОЛЬ КАТАЛИЗА В ЭКОЛОГИИ - Процесс катализа
Огромную роль призван сыграть катализ в решении актуальнейшей проблемы - охраны окружающей среды. По словам Кусто, земной шар напоминает "одиноко...
-
ГОМОГЕННЫЙ КАТАЛИЗ - Процесс катализа
Среди многочисленных каталитических реакций особое место занимает катализ в цепных реакциях. "Цепными реакциями, как известно, называются такие...
-
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Катализаторы - вещества,...
-
Носитель катализатора, иначе подложка (катализатора) (англ. carrier или support) -- инертный или малоактивный материал, служащий для стабилизации на его...
-
Ферментативный катализ - каталитические реакции, протекающие с участием ферментов - биологических катализаторов белковой природы. Ферментативный катализ...
-
ГЕТЕРОГЕННЫЙ КАТАЛИЗ - Процесс катализа
К сожалению, до сих пор, несмотря на достаточно большое число теорий и гипотез в области катализа, многие основополагающие открытия были сделаны случайно...
-
Введение, Гомогенный и гетерогенный катализ - Гомогенный и гетерогенный катализ
Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды, другие осуществляются за минуты,...
-
Высокая каталитическая эффективность. Отличительной особенностью любого фермента является его чрезвычайно высокая каталитическая эффективность. Так,...
-
Энергетический профиль каталитической реакции - Гомогенный и гетерогенный катализ
Энергетический профиль реакции - это кривая, которая показывает зависимость координаты реакции (насколько прошла реакция) от времени (при постоянном...
-
Гетерогенный катализ - Гомогенный и гетерогенный катализ
Механизм гетерогенного катализа включает пять стадий, причем все они обратимы. 1. Диффузия реагирующих веществ к поверхности твердого вещества. 2....
-
Гомогенный и гетерогенный катализ. Механизм действия катализатора - Основы химии
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газовая смесь или раствор). При гетерогенном катализе катализатор и...
-
КАТАЛИЗ В БИОХИМИИ - Процесс катализа
Ферментативный катализ неразрывно связан с жизнедеятельностью организмов растительного и животного мира. Многие жизненно важные химические реакции,...
-
НЕМНОГО О ПРОМЫШЛЕННОМ КАТАЛИЗЕ - Процесс катализа
На всю жизнь запомнилась мне проводившаяся по Энглеру разгонка полученного конденсата, в котором уже в начале опыта бензиновая фракция составляла 67%. Мы...
-
Активация молекул в катализе - Промотирование катализаторов
Активация молекул происходит в результате взаимодействия молекул с катализатором: с поверхностью - в гетерогенном, с молекулами, ионами, комплексами - в...
-
Гетерогенный катализ - каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами. Механизм...
-
1. Copyright © С. И. Левченков, 1996 - 2005. 2. Шмидт Ф. К. Физико-химические основы катализа -- И.: Фрактал -- 2004. -- С. 9 3. Ходаков Ю. В., Эпштейн...
-
"Катализ. Гомогенный и гетерогенный катализ" - Гомогенный и гетерогенный катализ
В 1835 году Берцелиус впервые использовал термин "катализатор" для обозначения "веществ, которые способны пробудить сродство, дремлющее при данной...
-
Гидрирование Большое число каталитических реакций связано с активацией атома водорода и какой-либо другой молекулы, приводящей к их химическому...
-
Гомогенный катализ - каталитические реакции, в которых реагенты и катализатор находятся в одной фазе. В случае гомогенно-каталитических процессов...
-
Активность и селективность катализатора - Гомогенный и гетерогенный катализ
Все процессы переработки углеводородного сырья сопровождаются фазообразованием (испарение, катализ, крекинг и др.). Одна из задач физико-химической...
-
Катализ - Концепции современного естествознания: химическая составляющая
Наиболее сильное влияние на скорость реакции оказывает присутствие в реагирующей системе Катализатора -- вещества, которое повышает (а иногда и уменьшает...
-
Гомогенный и гетерогенный катализ - Систематика химических элементов
Вещества, увеличивающие скорость химической реакции, называются Катализаторами. Явление возрастания скорости реакции под действием таких веществ,...
-
Катамлиз (греч. кбфЬлхуйт восходит к кбфблэейн -- разрушение) -- избирательное ускорение одного из возможных термодинамически разрешенных направлений...
-
ПРОХОЖДЕНИЕ ЧЕРЕЗ ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР - Процесс катализа
Закон Аррениуса - экспериментально установленный факт. Он утверждает, что скорость реакции возрастает с увеличением температуры для преобладающего...
-
Катализ, Разновидности катализа:, Принципы катализа: - Гомогенный и гетерогенный катализ
Явление катализа - Это изменение скорости реакции под действием некоторых веществ, которые к концу реакции остаются в химически неизменном виде....
-
Уравнение Михаэлиса-Ментен и его анализ - Гомогенный и гетерогенный катализ
Уравнемние Михаэмлиса -- Мемнтен -- основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от...
-
Кинетика и катализ, Теоретические основы термического пиролиза - Пиролиз углеводородного сырья
Теоретические основы термического пиролиза Термическое разложение углеводородов представляет собой сложный процесс, который можно представить как ряд...
-
ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР - Процесс катализа
Все каталитические реакции - самопроизвольный процесс, т. е. протекают в направлении убыли энергии Гиббса - убыли энергии системы. Давно уже было...
-
Фазовое равновесие. Правило фаз. Диаграмма состояния однокомпонентной системы Гетерогенные равновесия, связанные с переходом веществ из одной фазы в...
-
Катализ - Химическая кинетика, равновесия, термодинамика
К изложенному в учебнике необходимо несколько уточнений и добавлений. Во-первых, реакция в присутствии катализатора идет не в одну стадию, а минимум в...
-
Итак, катализ - это ускорение или возбуждение химических реакций в присутствии веществ - катализаторов, многократно вступающих в промежуточное химическое...
-
К-изменение скорости хим. р-ции, под действием особых ве-в-катализаторов, кот. участвуют в ходе р-ции, но к концу ее остаются в неизменном кол-ве. Виды:...
-
Литература - Гомогенный и гетерогенный катализ
1. Макрушина, Т. И. Химическая кинетика и равновесие: методические рекомендации к лабораторным работам по дисциплине "Химия" для студентов всех форм...
-
Теоретические основы каталитического пиролиза - Пиролиз углеводородного сырья
Теоретические основы процесса каталитического пиролиза в настоящее время изучены недостаточно. В качестве активных компонентов катализаторов для пиролиза...
-
Получение синтезированного газа - Анализ и технологическая оценка химического производства
Химические методы переработки нефти проводят при высоких температурах без катализатора (термический крекинг), при высоких температурах в присутствии...
-
ВВЕДЕНИЕ, СТРОЕНИЕ МОЛЕКУЛ И СВОЙСТВА ВОДЫ - Химические свойства и строение воды
Вода - ценнейший природный ресурс. Вода играет исключительную роль в процессах обмена веществ, составляющих основу жизни. Огромное значение вода имеет в...
-
Производство полимеров - Анализ и технологическая оценка химического производства
Высокомолекулярные соединения получают из мономеров полимеризацией, сополимеризацией, поликонденсацией и методами привитой полимеризации и...
-
Таблица 2 - Структура сырья в производстве метанола, %. Сырье В мире Беларусь и Россия Природный газ 73,8 70,7 Нефть и нефтепродукты 24,4 4,0 Отходы...
Металлокомплексный катализ