Уравнение Михаэлиса-Ментен и его анализ - Гомогенный и гетерогенный катализ
Уравнемние Михаэмлиса -- Мемнтен -- основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата.
Уравнение названо в честь физикохимиков Леонора Михаэлиса и Мод Леоноры Ментен, опубликовавших в в 1913 году статью, в которой они провели математический анализ ферментативной кинетики.
Уравнение имеет вид:
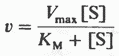
Vmax - максимальная скорость реакции
KM - константа Михаэлиса.
[S] - концентрация субстрата.
Наиболее прост для анализа тот случай, когда носитель не накладывает ограничения на диффузию субстрата и характер ингибирования целиком определяется распределением субстрата и ингибитора между матрицей и раствором. Если ингибитор и полимерный носитель одноименно заряжены, то степень ингибирования снижается (по сравнению с ситуацией в гомогенном растворе), а если они несут на себе заряды противоположного знака, то степень ингибирования возрастает. Если в последнем случае субстрат имеет одинаковый заряд с носителем, то степень ингибирования еще более увеличивается. В данном изложении не будут рассмотрены конкретные примеры случаи конкурентного и неконкурентного ингибирования, ингибирования продуктом реакции и т. п. Читатель может это проделать сам в качестве упражнения и вывести соответствующие математические выражения. Анализ этих систем показывает, что во всех случаях кинетика действия иммобилизованных ферментов, осложненная ингибированием, описывается уравнением Михаэлиса -- Ментен.?[c.113]
Теперь обратимся к константе Михаэлиса К. Она влияет прежде всего на диапазон линейности сигнала. В идеальном случае связь между выходным сигналом и концентрацией определяемого вещества должна быть линейной. В общем виде связь отражается в величине (или кажущейся К ) фермента. Анализ уравнения Михаэлиса-Ментен показывает, что линейность сохраняется вплоть до концентраций более. 0,2 К, хотя важное значение имеют другие факторы, такие как иммобилизация фермента или наличие мембраны. Отношение двух величин есть константа?[c.100]
В отдельных случаях кинетические исследования ферментативных реакций удобно проводить в условиях избытка фермента по сравнению с субстратом (например, при малой растворимости субстрата в воде, или при высоком молекулярном весе субстрата). Детальный кинетический анализ подобного рода систем проводится в главе 9. Здесь отметим только, что уравнение скорости ферментативной реакции, протекающей в режиме установившегося равновесия в условиях [Е]о > [SJo, является симметричным классическому уравнению Михаэлиса -- Ментен относительно концентраций реагентов. Так, при избытке фермента скорость реакции имеет первы. й порядок по концентрации субстрата, и смешанный -- по концентрации фермента
Похожие статьи
-
Высокая каталитическая эффективность. Отличительной особенностью любого фермента является его чрезвычайно высокая каталитическая эффективность. Так,...
-
Энергетический профиль каталитической реакции - Гомогенный и гетерогенный катализ
Энергетический профиль реакции - это кривая, которая показывает зависимость координаты реакции (насколько прошла реакция) от времени (при постоянном...
-
Гомогенный катализ - Гомогенный и гетерогенный катализ
Среди многочисленных каталитических реакций особое место занимает катализ в цепных реакциях. "Цепными реакциями, как известно, называются такие...
-
"Катализ. Гомогенный и гетерогенный катализ" - Гомогенный и гетерогенный катализ
В 1835 году Берцелиус впервые использовал термин "катализатор" для обозначения "веществ, которые способны пробудить сродство, дремлющее при данной...
-
Гетерогенный катализ - Гомогенный и гетерогенный катализ
Механизм гетерогенного катализа включает пять стадий, причем все они обратимы. 1. Диффузия реагирующих веществ к поверхности твердого вещества. 2....
-
Катализ, Разновидности катализа:, Принципы катализа: - Гомогенный и гетерогенный катализ
Явление катализа - Это изменение скорости реакции под действием некоторых веществ, которые к концу реакции остаются в химически неизменном виде....
-
Гомогенный и гетерогенный катализ. Механизм действия катализатора - Основы химии
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газовая смесь или раствор). При гетерогенном катализе катализатор и...
-
Анализ модели - Кинетические закономерности взрывного свечения азида серебра
Рассмотрим процесс развития реакции при произвольной степени разложения. Нас будет интересовать вид кинетических зависимостей концентрации носителей цепи...
-
Алгоритмы метода Монте-Карло для решения интегральных уравнений второго рода Пусть необходимо вычислить линейный функционал , Где, причем для...
-
ГОМОГЕННЫЙ КАТАЛИЗ - Процесс катализа
Среди многочисленных каталитических реакций особое место занимает катализ в цепных реакциях. "Цепными реакциями, как известно, называются такие...
-
КАТАЛИЗ В БИОХИМИИ - Процесс катализа
Ферментативный катализ неразрывно связан с жизнедеятельностью организмов растительного и животного мира. Многие жизненно важные химические реакции,...
-
Гомогенное и гетерогенное горение - Принципы горения и взрыва
Горением называется сложный физико-химический процесс взаимодействия горючего вещества и окислителя, характеризующийся самоускоряющимся превращением и...
-
Элементы матричного анализа - Методы решения системы линейных уравнений
Вектором, как на плоскости, так и в пространстве, называется направленный Отрезок , то есть такой Отрезок , один из концов которого выделен и называется...
-
Метод дихотомии требует менее всего итераций цикла для получения корней уравнения с заданной точностью. Если расчет ведется без помощи ЭВМ, то это...
-
ГЕТЕРОГЕННЫЙ КАТАЛИЗ - Процесс катализа
К сожалению, до сих пор, несмотря на достаточно большое число теорий и гипотез в области катализа, многие основополагающие открытия были сделаны случайно...
-
ПРОХОЖДЕНИЕ ЧЕРЕЗ ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР - Процесс катализа
Закон Аррениуса - экспериментально установленный факт. Он утверждает, что скорость реакции возрастает с увеличением температуры для преобладающего...
-
Составляется матрица численных значений базисных функций, соответствующая расширенной матрице спектра плана Вычисляется информационная матрица...
-
В большинстве случаев 0 и 1 неизвестны. Их определяют (оценивают), исходя из имеющихся выборочных наблюдений с помощью следующего уравнения: Где -...
-
Нелинейный регрессионный анализ, Множественный регрессионный анализ - Основы научных исследований
Линейные по параметрам регрессионные модели можно использовать для аппроксимации нелинейных зависимостей путем их линеаризации с помощью базисных...
-
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов,...
-
Гомоскедастичностью называется выполняемость предпосылки о постоянстве дисперсии отклонений. Гетероскедастичностью называется невыполняемость этой самой...
-
Катализ - Концепции современного естествознания: химическая составляющая
Наиболее сильное влияние на скорость реакции оказывает присутствие в реагирующей системе Катализатора -- вещества, которое повышает (а иногда и уменьшает...
-
Сущность и основные условия применения корреляционного анализа В соответствии с сущностью корреляционной связи ее изучение имеет две цели: 1) измерение...
-
Существует три основных типа окислительно-восстановительных реакций: 1. Если окислитель и восстановитель находятся в молекулах различных веществ, то...
-
Множественная регрессия - уравнение связи с несколькими независимыми переменными: где - зависимая переменная (результативный признак); - независимые...
-
Составление химических уравнений, Расчеты по химическим уравнениям - Основные понятия и законы химии
Включает три этапа: 1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками "+" и "®" : HgO ®...
-
АНАЛИТИКА Компиляция выдержек из различных источников - удельная б-активность U235 и U238 составляет соответственно 0,08 и 0,012 Бк/мкг (или 80 и 12...
-
Задачи и методы качественного анализа - Основы аналитической химии
Обнаружение или, как иногда говорят, "открытие" отдельных элементов или ионов, входящих в состав веществ - это задачи качественного анализа. Качественный...
-
Количественный анализ - это совокупность, химических, физико-химических и физических методов определения количественного соотношения компонентов,...
-
Линейный парный регрессионный анализ - Практические аспекты эконометрического анализа
Линейная парная регрессия характеризуется тем, что: 1) объясненная часть является условным математическим ожиданием MX (Y); 2) уравнение регрессии MX...
-
Парный регрессионный анализ - Практические аспекты эконометрического анализа
Парный регрессионный анализ рассматривает проблему для случая однофакторного признака. Пусть имеется набор значений двух переменных: yi и хi Между этими...
-
Показатели анализа ряда динамики - Методы анализа основной тендеции развития в рядах динамики
При изучении динамики общественных явлений возникает проблема описания интенсивности изменения и расчета средних показателей динамики. Анализ...
-
Качественные методы анализа - Разработка технологической схемы получения анизола и крезола
Рециркуляционных реакционно-ректификационных процессов. При анализе сложных ХТС, характеризующихся большим числом параметров и переменных необходимо...
-
Кинетика и катализ, Теоретические основы термического пиролиза - Пиролиз углеводородного сырья
Теоретические основы термического пиролиза Термическое разложение углеводородов представляет собой сложный процесс, который можно представить как ряд...
-
Задачи и методы количественного анализа - Основы аналитической химии
Количественный анализ - это совокупность химических, физико-химических и физических методов определения количественного соотношения компонентов, входящих...
-
УСЛОВИЯ, КОТОРЫЕ ДОПУСКАЮТ ИСПОЛЬЗОВАНИЕ РЕГРЕССИОННОГО АНАЛИЗА - Многомерный статистический анализ
Это статистический метод установления формы и изучения связей между метрической зависимой переменной и одной или несколькими независимыми переменными ....
-
Системы линейных уравнений - Методы решения системы линейных уравнений
Системой m линейных уравнений с n неизвестными называется система вида Где aIj и bI (i=1,...,m; b=1,...,n) - некоторые известные числа, а x1,...,xN -...
-
МЕТОДЫ СРАВНИТЕЛЬНОГО ШКАЛИРОВАНИЯ - Многомерный статистический анализ
Шкалирование методом попарного сравнения - Это метод сравнительного шкалирования, при котором респонденту дается два объекта для выбора по определенному...
-
Явления общественной жизни складываются под воздействием целого ряда факторов, то есть являются многофакторными. Между факторами существуют сложные...
-
Частным случаем недетерминированной связи является связь случайная - стохастическая (вероятностная). Реализация вероятностного подхода к описанию...
Уравнение Михаэлиса-Ментен и его анализ - Гомогенный и гетерогенный катализ