ОСНОВЫ ЭЛЕКТРОХИМИИ - Неограническая химия
Задание 6.1. В данной (табл. VI.1) окислительно-восстановительной реакции уравняйте стехиометрические коэффициенты ионно-электронным методом и рассчитайте термодинамическую вероятность протекания реакции.
Пример решения 6.1
Согласно своему варианту записываем уравнение химической реакции, например:
K2Cr2O7 + Ti2(SO4)3 + H2SO4 = Cr2(SO4)3 + Ti(SO4)2 + H2O + K2SO4.
Уравнивание стехиометрических коэффициентов ионно-электронным методом проводим по определенному алгоритму.
1) Проставим для всех элементов степени окисления:
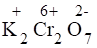
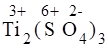
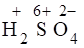
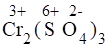
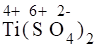
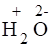
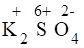
+ + = + + + .
2) Выясним элементы, меняющие степень окисления в результате реакции и определим, какое вещество выполняет роль окислителя (принимает электроны), а какое - роль восстановителя (отдает электроны).
В данной реакции изменяют степени окисления элементы Cr и Ti, при этом K2Cr2O7 выполняет роль окислителя, а Ti2(SO4)3 - роль восстановителя, H2SO4 играет роль среды.
- 3) Запишем реакцию в ионно-электронном виде и подчеркнем окислитель и восстановитель. Для этого учитываем диссоциацию молекул на ионы, а слабые электролиты (например, Н2О, оксиды и сульфиды металлов), если они встречаются в реакции оставляем в молекулярном виде. Получаем: 2K+ + (Cr2O7)2- + 2Ti3+ + 3(SO4)2- + 2H+ + (SO4)2- =
= 2Cr3+ + 3(SO4)2- + Ti4+ + 2(SO4)2- + H2O + 2K+ + (SO4)2-.
- 4) Записываем полуреакции окисления и восстановления. Рассматриваем только подчеркнутые частицы:
- (Cr2O7)2- > 2Cr3+;
Проводим в каждой строчке ионное уравнивание. Для этого сравниваем количество основных элементов Cr и Ti справа и слева и при необходимости вводим уравнивающие коэффициенты ( в данном случае ставим "2" перед Ti4+). Затем в верхней полуреакции справа необходимо добавить кислород, который вводится в виде 7Н2О, а так как вместе с кислородом ввели 14Н+, добавляем их в левую часть первой полуреакции. Для второй полуреакции других изменений нет. Получаем следующее:
- 14Н+ + (Cr2O7)2- = 2Cr3+ + 7H2O; 2Ti3+ = 2Ti4+. 5) Отметим в реакциях количество принятых и отданных электронов: 14Н+ + (Cr2O7)2- 2Cr3+ + 7H2O;
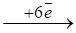
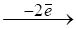
- 2Ti3+ 2Ti4+. 6) Проводим электронный баланс. Для этого справа ставим вертикальную черту и записываем цифры, при умножении на которые количество принятых и отданных электронов становится одинаковым: 7) Складываем левые и правые части, умножив на соответствующие коэффициенты: 14H+ + (Cr2O7)2- + 6Ti3+ = 2Cr3+ + 7H2O + 6Ti4+. 8) Теперь около знака равенства поставим короткую вертикальную черту и для элементов, стоящих слева, добавим связанные с ними частицы, которые раньше мы не учитывали. Как видно из 3): для (Cr2O7)2- это 2К+, для 2Ti3+ - это 3(SO4)2-, а для 2Н+ - это (SO4)2-. Конечно при этом будем учитывать введенные нами коэффициенты. После этого, автоматически те же самые частицы записываем справа от черты. Получаем следующее: 14H+ + (Cr2O7)2- + 6Ti3+ = 2Cr3+ + 7H2O + 6Ti4+; 7(SO4)2- + 2K+ + 9(SO4)2- | 7(SO4)2- + 2K+ + 9(SO4)2-. 9) В левой и правой частях уравнения сложим положительные и отрицательные частицы. Слева это получается сразу, а справа надо из имеющихся частиц подбирать необходимое их количество. Получаем полное уравнение со всеми стехиометрическими коэффициентами:
K2Cr2O7 +3Ti2(SO4)3 +7H2SO4 = Cr2(SO4)3 +6Ti(SO4)2 + 7H2O+K2SO4.
Теперь определим термодинамическую вероятность протекания данной окислительно-восстановительной реакции. Как показано в теме III для этого необходимо провести расчет убыли свободной энергии (ДG химической реакции).
Записываем из 6) полуреакции окисления и восстановления и, пользуясь данными Приложения 3 приводим для них справа значения электродных потенциалов (ц0):
14Н+ + (Cr2O7)2- 2Cr3+ + 7H2O; | ц0 окислителя = +1,33 В;
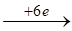
2Ti3+ 2Ti4+ | ц0 восстановителя = -0,04 В.
Рассчитываем ЭДС протекающего процесса (е0):
Е0 = ц0 окислителя - ц0 восстановителя = 1,33 - (-0,04) = 1,37 В.
Далее рассчитываем ДG химической реакции:
ДG = - zFе0, где z - число электронов, переданных от восстановителя к окислителю. С учетом электронного баланса z = 6;
F - число Фарадея, равное 96500 Кл/моль. Чтобы ответ получить в кДж, вводим множитель 10-3:
ДG = -6Ч96500Ч1,37Ч10-3 = -793,2 кДж.
Так как ДG < 0, то данная реакция термодинамически вероятна, т. е. она может протекать в прямом направлении.
Задание 6.2. Для двух металлов (табл. VI.2), находящихся в растворах своих солей с определенной концентрацией:
- 6.2.1. Составьте схему гальванического элемента. 6.2.2. Запишите реакции, протекающие на катоде и аноде.
6.2.3. Рассчитайте ЭДС (е0) гальванического элемента и ДG протекающей реакции.
Пример решения 6.2
6.2.1. Гальванический элемент состоит из двух электродов, представляющих систему "металл-электролит". При решении данного задания в качестве электролита можно взять растворы сульфатов, нитратов или хлоридов указанных металлов, например Al и Ni. Заданный гальванический элемент может быть представлен схемой:
Одинарной вертикальной чертой показана граница между металлом и электролитом, а двойной - граница между электродами.
Пользуясь данными Приложения 3, выписываем значения стандартных электродных потенциалов для каждого электрода:
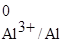
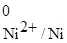
= -1,66 В; = -0,25 В.
Так как большее количество электронов находится на поверхности алюминиевого электрода, то на схеме гальванического элемента слева ставим знак (-), а никелевый электрод по сравнению с алюминиевым является более положительным, поэтому справа ставим знак (+). При замыкании цепи электроны начинают переходить от алюминиевого электрода к никелевому, что на схеме указывается в виде стрелки сверху.
- 6.2.2. Учитывая, что электроны по внешней цепи движутся от анода к катоду и процесс отдачи электронов приводит к окислению, а принятия электронов - к восстановлению, записываем реакции на электродах:
- (-) анод: Al0 - 3 > Al3+ (окисление); (+) катод: Ni2+ + 2 > Ni0 (восстановление).
Далее проводим расчет электродных потенциалов с учетом заданных концентраций растворов, например 0,001 М. Для этого используем уравнение Нернста для металлического электрода:
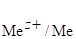
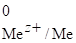
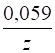
= + lg [Mez+],
Где - стандартный электродный потенциал, z - количество электронов, участвующих в элементарном акте окисления или восстановления; [Mez+] - концентрация ионов металлов в растворе.
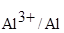
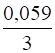
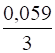
= -1,66 + lg (0,001) = -1,66 + (-3) = -1,72 В.
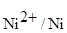
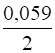
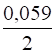
= -0,25 + lg (0,001) = -0,25 + (-3) = -0,34 В.
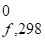
6.2.3. В заключение проводим расчет ЭДС (е) гальванического элемента и ДG протекающей в нем реакции, помня, что z берется с учетом электронного баланса:
Е = цк - ца = -0,34 - (-1,72) = 1,38 В.
ДG = - zFе = -6Ч96500Ч1,38Ч10-3 = -799 кДж.
Задание 6.3. Составьте схемы электролиза и рассчитайте массу металла, выделяющегося на катоде по приведенным данным (табл. VI.3) при 3-х разных условиях его проведения:
- 6.3.1. Из раствора соли металла, растворимый анод. 6.3.2. Из раствора соли металла, нерастворимый анод. 6.3.3. Из расплава соли металла, растворимый анод.
Пример решения 6.3
6.3.1. Пусть электролиз происходит в растворе Fe(NO3)2; I = 2 A; t = 40 мин; Bi = 35 %; растворимый анод Fe.
Чтобы определить наличие в растворе заряженных частиц, записываем уравнение диссоциации соли и уравнение реакции гидролиза:
Fe(NO3)2 Fe2+ + 2(NO3);
Fe(NO3)2 + 2H2O = Fe(OH)2 + 2HNO3;
Fe2+ + 2H2O = Fe(OH)2 + 2H+, pH < 7.
На катоде происходит восстановление, т. е. принятие электронов. Так как электроны это отрицательно заряженные частицы, то из записанных выше реакций принять электроны могут Fe2+ и Н+.
На аноде происходит окисление, т. е. отдача электронов. Отдавать электроны могут частицы (NO3), полярные молекулы Н2О, а также сам материал анода - Fe. Большей способностью к отдаче электронов обладает металл (Fe), так как он является безусловным восстановителем, и в кристаллической решетке металла содержится большое количество свободных электронов.
Исходя из рассмотренного, укажем элементы, которые могут разряжаться на аноде и катоде, и происходящие реакции. Следует при этом учитывать, что число принятых и отданных электронов должно быть одинаковым.
- (-) Катод (+) Анод < Fe2+ > H2O < H+ > (NO3) > Fe0
Fe2+ + 2 = Fe0
- 2H+ + 2 = H2 2Fe0 - 4 = 2Fe2+. 6.3.2. Водный раствор Fe(NO3)2 (нерастворимый анод, например Pt).
Проанализируем, какие изменения произошли в системе. В вышеприведенном перечне элементов для катода и анода теперь отсутствует Fe0, а Pt как нерастворимый электрод только пропускает через себя электроны. Следовательно, катодные реакции сохраняются прежними, а на аноде конкурируют Н2О и (NO3). Для простейшего объяснения следует иметь в виду, что частица (NO3) имеет более сложную структурную формулу, чем Н2О, поэтому на аноде электроны будет отдавать кислород воды. То же самое будет происходить, если в вашем варианте задания окажется не нитратная соль, а сульфат, например, FeSO4, то в этом случае тоже разрядке подвергается Н2О, а не (SO4)2-. Если в предложенном варианте используются хлориды, то учитывая, что Н2О по структуре сложнее, чем Cl, в анодной реакции отдавать электроны будут хлорид-ионы: 2Cl - 2 > Cl.
Записываем реакции на аноде и катоде для раствора Fe(NO3)2 с нерастворимым анодом:
- (-) Катод (+) Анод (нерастворимый) < Fe2+ > H2O < H+ > (NO3)
Fe2+ + 2 = Fe0
- 2H+ + 2 = H2 2H2O - 4 = O2 + 4H+. 6.3.3. Расплав Fe(NO3)2 (растворимый анод Fe0).
В расплаве происходит диссоциация:
Fe(NO3)2 Fe2+ + 2(NO3).
Ввиду отсутствия воды гидролиз не происходит и ионы Н+ не образуются.
- (-) Катод (+) Анод < Fe2+ > (NO3) > Fe0
Fe2+ + 2 > Fe0 Fe0 - 2 > Fe2+.
Расчет массы Fe (m), выделившегося на катоде, проводим по формуле, отражающей закон Фарадея:
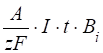
M (Fe) = ,
Где А - атомная масса железа; z - его валентность; F - число Фарадея (96500 Кл/моль); I - сила тока, t - время электролиза в с.; Bi - выход по току.
Bi = .
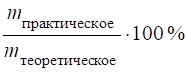
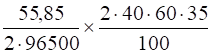
M (Fe) = = 0,486 г.
Таблица VI.1
|
Номер варианта |
Схемы окислительно-восстановительных реакций |
|
1 |
MnSO4 + Na2SO4 + H2O + Cl2 MnO2 + NaCl + H2SO4 |
|
2 |
HMnO4 + Pb(NO3)2 + H2O PbO2 + Mn(NO3)2 + HNO3 |
|
3 |
MnSO4+Br2+К2SO4+K2SO4 + H2O KMnO4 + КBr + H2SO4 |
|
4 |
K2SO4 + I2 + NO2 + H2O KI + HNO3 + H2SO4 |
|
5 |
K2SO4 + Cr2(SO4)3 + H2O K2Cr2O7 + H2SO4 + SO2 |
|
6 |
Al +K2Cr2O7 + H2SO4 Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O |
|
7 |
KClO3 + FeSO4 + H2SO4 KCl + Fe2(SO4)3 + H2O |
|
8 |
K2Cr2O7 + KI + H2SO4 Cr2(SO4)3 + I2 + K2SO4 + H2O |
|
9 |
KMnO4 + HCl KCl + Cl2 + MnCl2 + H2O |
|
10 |
K2Cr2O7 + H2S + H2SO4 Cr2(SO4)3 + S + K2SO4 + H2O |
|
11 |
FeCl2 + KMnO4 + HCl FeCl3 + MnCl2 + KCl + H2O |
|
12 |
K2Cr2O7 + H2SO4 + FeSO4K2SO4 + Cr2(SO4)3 + Fe2(SO4)3 + H2O |
|
13 |
Ti2(SO4)3+ KMnO4+ H2SO4 Ti(SO4)2 + MnSO4 + K2SO4 + H2O |
|
14 |
FeSO4 + HNO3 + H2SO4 Fe2(SO4)3 +NO+ H2O |
|
15 |
NaNO2 + NaI + H2SO4 NO + I2 + Na2SO4 + H2O |
|
16 |
KI + KNO2 + H2SO4 I2 + K2SO4 + NO + H2O |
|
17 |
Cu + HNO3 Cu(NO3)2 + NO + H2O |
|
18 |
K2Cr2O7 + HCl Cl2 + CrCl3 + KCl + H2O |
|
19 |
CuS + HNO3 S + NO + Cu(NO3)2 + H2O |
|
20 |
Mg + H2SO4 H2S + MgSO4 + H2O |
|
21 |
K2S + KMnO4 + H2SO4 S + MnSO4 + K2SO4 + H2O |
|
22 |
I2 + Cl2 + H2O HCl + HIO3 |
|
23 |
KBr + K2Cr2O7 + HCl Br2 + CrCl3 + KCl + H2O |
|
24 |
Zn + KMnO4 + H2SO4 ZnSO4 + MnSO4 + K2SO4 + H2O |
|
25 |
K2Cr2O7 + KI + H2SO4 Cr2(SO4)3 + I2 + K2SO4 + H2O |
|
26 |
MnO2 + HCl MnCl2 + Cl2 + 2H2O |
|
27 |
K2Cr2O7 + NaNO2 + H2SO4Cr2(SO4)3+NaNO3+H2O+K2SO4 |
|
28 |
Ag + HNO3 AgNO3 + H2O + NO2 |
|
29 |
PbS + HNO3 S + NO + Pb(NO3)2 + H2O |
|
30 |
NaNO2 + NaI + H2SO4 I2 + NO^ + H2O |
Таблица VI.2
|
Номер варианта |
Металлы |
Концентрация ионов металла, моль/л |
|
1 |
Cu, Ag |
0,01 |
|
2 |
Cu, Au |
0,1 |
|
3 |
Cu, Al |
0,001 |
|
4 |
Cu, Zn |
0,01 |
|
5 |
Cu, Ni |
0,1 |
|
6 |
Mg, Al |
0,001 |
|
7 |
Mg, Fe |
0,01 |
|
8 |
Mg, Zn |
0,1 |
|
9 |
Mg, Co |
0,001 |
|
10 |
Mg, Au |
0,01 |
|
11 |
Ni, Fe |
0,1 |
|
12 |
Ni, Co |
0,001 |
|
13 |
Ni, Al |
0,01 |
|
14 |
Ni, Sn |
0,1 |
|
15 |
Ni, Cd |
0,001 |
|
16 |
Fe, Co |
0,01 |
|
17 |
Fe, Al |
0,1 |
|
18 |
Fe, Pb |
0,001 |
|
19 |
Fe, Sn |
0,01 |
|
20 |
Fe, Au |
0,1 |
|
21 |
Co, Al |
0,001 |
|
22 |
Co, Au |
0,01 |
|
23 |
Al, Zn |
0,1 |
|
24 |
Sn, Mg |
0,001 |
|
25 |
Pb, Cu |
0,01 |
|
26 |
Mn, Al |
0,1 |
|
27 |
Mn, Cr |
0,001 |
|
28 |
Sb, Pd |
0,01 |
|
29 |
In, Sn |
0,1 |
|
30 |
In, Zn |
0,001 |
Таблица VI.3
|
Номер варианта |
Формула соли |
I, A |
T, мин |
Bi, % |
|
1 |
CuCl2 |
3 |
60 |
80 |
|
2 |
ZnSO4 |
2,5 |
60 |
60 |
|
3 |
SnCl2 |
2,8 |
60 |
70 |
|
4 |
Cr2(SO4)3 |
1,5 |
45 |
25 |
|
5 |
MnCl2 |
3,5 |
30 |
35 |
|
6 |
FeSO4 |
3,2 |
45 |
40 |
|
7 |
ZnCl2 |
4,1 |
30 |
55 |
|
8 |
CrCl3 |
3,6 |
30 |
20 |
|
9 |
MnSO4 |
1,9 |
45 |
25 |
|
10 |
NiSO4 |
4,2 |
30 |
65 |
|
11 |
NiCl2 |
3,3 |
45 |
70 |
|
12 |
CoCl2 |
1,4 |
45 |
60 |
|
13 |
CoSO4 |
1,7 |
45 |
60 |
|
14 |
Zn(NO3)2 |
1,9 |
45 |
65 |
|
15 |
Co(NO3)2 |
1,8 |
60 |
60 |
|
16 |
Fe(NO3)2 |
2,4 |
60 |
40 |
|
17 |
CuBr2 |
2,7 |
60 |
90 |
|
18 |
ZnI2 |
2,2 |
45 |
55 |
|
19 |
CrBr3 |
3,4 |
30 |
55 |
|
20 |
MnI2 |
4,0 |
60 |
60 |
|
21 |
AgNO3 |
5,1 |
45 |
95 |
|
22 |
FeI2 |
6,2 |
60 |
45 |
|
23 |
MnCl2 |
3,6 |
60 |
60 |
|
24 |
Cr(SO4)3 |
4,1 |
40 |
30 |
|
25 |
Cu(NO3)2 |
2,7 |
45 |
70 |
|
26 |
CdCl2 |
3,5 |
40 |
60 |
|
27 |
Pb(NO3)2 |
2,4 |
35 |
70 |
|
28 |
SbCl3 |
2,6 |
45 |
80 |
|
29 |
PdSO4 |
4,0 |
50 |
65 |
|
30 |
InCl3 |
1,8 |
60 |
55 |
Похожие статьи
-
Гальванический элемент. ЭДС гальванического элемента - Основы химии
Рассмотрим простейший гальванический элемент Даниэля - Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы...
-
Электролиз - физико-химический процесс, состоящий в выделении на Электродах составных частей растворенных веществ или других веществ, который возникает...
-
Задачи и методы количественного анализа - Основы аналитической химии
Количественный анализ - это совокупность химических, физико-химических и физических методов определения количественного соотношения компонентов, входящих...
-
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов,...
-
Рассмотрим простейший гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы сульфатов...
-
Способы получения и химические свойства кислот - Основы химии
Бескислородные кислоты получают: 1. Взаимодействием неметалла с водородом. Например H2 + Cl = 2HCl 2. Действием на соль более сильной или менее летучей...
-
Что такое гравиметрический фактор F - Основы аналитической химии
Если мы знаем A - навеску анализируемой пробы, b - массу осадка и его состав, то мы можем вычислить содержание определяемого вещества X . X = a*F*100/b...
-
Воздушная известь - одно из древнейших вяжущих, широко применяемых в строительстве и промышленности. Известь - продукт умеренного обжига кальциевых и...
-
Задачи и методы качественного анализа - Основы аналитической химии
Обнаружение или, как иногда говорят, "открытие" отдельных элементов или ионов, входящих в состав веществ - это задачи качественного анализа. Качественный...
-
ДИСПЕРСНЫЕ СИСТЕМЫ - Неограническая химия
Задание 5.1. В определенном объеме раствора V л содержится m г вещества. Плотность раствора с (табл. V.1). Рассчитайте: 5.1.1. Процентную концентрацию...
-
СТРОЕНИЕ АТОМА - Неограническая химия
Задание 1.1. Для приведенных в варианте (табл. I.1) 4-х химических элементов определить: 1.1.1. Группу и период, в которых находится данный элемент в...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Способы получения и химические свойства оксидов - Основы химии
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. Окисление кислородом простых...
-
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа : При повышении температуры на каждые 10о скорость большинства реакций...
-
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V=dC/dtV. Факторы, влияющие на скорость химических...
-
Алюминий - основной представитель металлов главной подгруппы III группы Периодической системы. Свойства его аналогов - галлия, индия и таллия -...
-
Положение металлов в ПС. Физические свойства металлов. Методы получения металлов - Основы химии
Металлы располагаются в основном в левой и нижней части ПС К физическим свойствам относятся плотность, плавление (температура плавления),...
-
Сушки (температура материала 100...200 °C - здесь происходит частичное испарение воды); подогрева (200...650 °C - выгорают органические примеси и...
-
Кремний - элемент главной подгруппы четвертой группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14....
-
Растворы - термодинамические устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это...
-
Химия в системе наук - Основы естественно-научных знаний
Химия - наука о веществах, их свойствах, строении и взаимных превращениях. Под веществом понимается любая совокупность атомов и молекул. Традиционная...
-
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ - Неограническая химия
Задание 4.1: 4.1.1. Проанализируйте данную Вам реакцию (табл. IV.1) и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите...
-
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - Неограническая химия
Задание 3.1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте...
-
ХИМИЧЕСКАЯ СВЯЗЬ - Неограническая химия
Задание 2.1. Для двух, указанных по варианту (табл. II.2), молекул с позиций метода валентных связей показать образование молекул и ответить на следующие...
-
Легирование стали повышает ее антикоррозионные свойства. Например, совершенную стойкость к атмосферной коррозии показывают нержавеющие легированные...
-
Реагирует с неметаллами: 4Al + 3O2 > 2Al2O3 ; 2Al + 3Br2 > 2AlBr3 c оксидами металлов:2Al + Fe2O3 > Al2O3 + 2Fe (алюмотермия)c водой (если...
-
В термодинамике понятие "энтропия" было введено Р. Клаузиусом (1865), который показал, что процесс превращения теплоты в работу следует общей физической...
-
С кислородом большинство металлов образует оксиды - амфотерные и основные: 4Li + O2 = 2Li2O, 4Al + 3O2 = 2Al2O3. Щелочные металлы, за исключением лития,...
-
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. 1....
-
Дисперсной называется система, состоящая из двух или более веществ, причем одно из них в виде очень маленьких частиц равномерно распределено в объеме...
-
Диссоциация воды. Водородный показатель. Гидролиз солей - Основы химии
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды...
-
Коррозия - это самопроизвольный процесс разрушения металлов и сплавов в результате окислительно-восстановительного (химического, электрохимического и...
-
Способы получения и химические свойства солей - Основы химии
1. С использованием металлов Металл+неметалл Mg+Cl2=MgCl2 Металл+кислота Zn+2HCl=ZnCI2+H2 Металл+соль Fe+CuSO4=FeSO4+Cu 2. С использованием оксидов...
-
Растворы электролитов. Диссоциация кислот, солей и оснований - Основы химии
Электролиты - вещества, которые при растворении подвергаются диссоциации на ионы. В результате раствор приобретает способность проводить электрический...
-
Методы защиты бетона от коррозии - Основы химии
Для защиты бетона и повышения его долговечности вам следует применять первичную и вторичную защиту. К методам первичной защиты относится введение...
-
Если на равновесную с-му не оказ-ся вноешнего воздействия (не изм. темп, давл.), то равновесие м/существовать неизменным долго. Любое внешнее возд-ие...
-
К числу физических факторов, вызывающих коррозию цементного камня и бетона, относят их попеременное увлажнение и высыхание, которое сопровождается...
-
Периодический закон химических элементов: свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической...
-
Особые механические свойства эластичность - способность к высоким обратимым деформациям при относительно небольшой нагрузке (каучуки); малая хрупкость...
-
Получение и применение стекла. Ситаллы. Стеклопластика - Основы химии
Обычное стекло можно получить сплавлением кварцевого песка (SiO2), технической соды (Na2CO3) и мела (CaCO3). При нагревании сода и мел разлагаются с...
ОСНОВЫ ЭЛЕКТРОХИМИИ - Неограническая химия