Влияние рН на активность ферментов. - Влияние значений рН и температуры на активность ферментов
Влияние концентрации водородных ионов на каталитическую активность
Ферментов состоит в воздействии ее на активный центр. При разных значениях рН в реакционной среде активный центр может быть слабее или сильнее ионизирован, больше или меньше экранирован соседними с ним фрагментами полипептидной цепи белковой части фермента и т. п. Кроме того, рН среды влияет на степень ионизации субстрата, фермент-субстратного комплекса и продуктов реакции, оказывает большое влияние на состояние фермента, определяя соотношение в нем катионных и анионных центров, что сказывается на третичной структуре белковой молекулы. Последнее обстоятельство заслуживает особого внимания, так как определенная третичная структура белка-фермента необходима для образования фермент-субстратного комплекса.
Ферменты, вообще говоря, активны только в определенном интервале рН, и в большинстве случаев для действия каждого фермента имеется определенный оптимум рН.
Наличие такого оптимума может иметь несколько причин:
- 1. истинное обратимое влияние рН на скорость реакции V(в условиях, когда фермент насыщен субстратом) 2. влияние рН на сродство фермента к субстрату (в этом случае падение активности по обе стороны оптимума рН будет следствием понижения насыщения фермента субстратом в силу понижения сродства) 3. влияние рН на стабильность фермента, который может необратимо инактивироваться при рН по одну или по обе стороны от оптимума.
Перечисленные факторы могут действовать и в комбинации друг с другом, например, падение активности по одну сторону от оптимума рН может быть результатом уменьшения сродства фермента к субстрату, а по другую - результатом инактивации фермента. Поскольку в клетке содержатся сотни ферментов и для каждого из них существуют свои пределы опт рН, то изменение рН это один из важных факторов регуляции ферментативной активности. Так, в результате одной химической реакции при участии определенного фермента рН, оптимум которого лежит в пределах 7.0 - 7.2, образуется продукт, который является кислотой. При этом значение рН смещается в область 5,5 - 6.0. Активность фермента резко снижается, скорость образования продукта замедляется, но при этом активизируется другой фермент, для которого эти значения рН оптимальны и продукт первой реакции подвергается дальнейшему химическому превращению. (Еще пример про пепсин и трипсин).
Действие рассматриваемых факторов можно легко различить экспериментальным путем. Наличие необратимой инактивации устанавливают, сначала инкубируя фермент в растворах с различными значениями рН, а затем определяя его активность по возвращении рН к определенному значению.
На рис.1 приведены результаты опытов такого рода для моноаминоксидазы, из которых видно, что падение активности в щелочной области (по отношению к оптимуму рН) вызвано инактивацией фермента. Так как степень инактивации фермента со временем увеличивается, то и форма кривой, и положение кажущегося оптимума рН зависят от времени, в течение которого проводятся наблюдения; если бы можно было определить истинные начальные скорости сразу же после приведения раствора фермента к определенному значению рН, то тогда фактор инактивации был бы полностью исключен. Наблюдаемый оптимум рН аналогичен ложному " температурному оптимуму", который мы рассмотрим ниже.
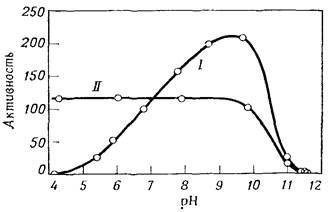
Рис.1. Влияние рН на активность моноаминоксидазы (флавинсодержащей)
І-активность при рН, указанных на оси абсцисс,
ІІ-активность при рН=7,3 после инкубации в течение 5 мин при рН, указанных на оси абсцисс
Влияние рН на сродство фермента к субстрату можно исключить, если работать с такими концентрациями субстрата, которые достаточно высоки, чтобы насытить фермент при всех изучаемых значениях рН. Так как величина Км может значительно изменять при сдвиге рН, то мы отнюдь не вправе считать, что концентрация субстрата, достаточная для насыщения при одном из значений рН, будет достаточной для его насыщения и при других значениях рН. Чтобы определить влияние изменений собственно рН на активность фермента, необходимо получить достаточное количество данных по зависимости скорости реакции от концентрации субстрата при каждом значении рН, а затем с помощью одного из графических методов, показанных на рис.2 найти значения Км и V. Большинство приводимых в литературе кривых, характеризующих влияние рН на активность фермента, представляет собой сложные кривые, форма которых зависит частично от изменений V, а частично от изменений Км. Кривые, иллюстрирующие влияние изменения рН на Км и V приведены ниже.
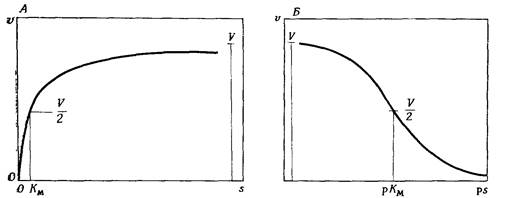


Рис.2. Шесть способов графического определения величин Км и V по влиянию концентрации субстрата на скорость реакции.
А-изменение величин, обратным рН-функциям, для системы с двумя ионизирующимися группами, рК которых равны 5 и 10
Б - изменение величин, обратным рН-функциям, для симметричной системы с рК 7 и 8.
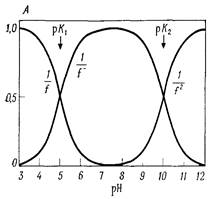

Рис.3.Характер изменения рН функций про изменении рН:
Влияние рН на активность ферментов, подобно всем другим видам влияния рН, осуществляется путем изменения в состоянии ионизации отдельных компонентов системы при изменении рН. Такие изменения могут происходить в свободном ферменте, в фермент-субстратном комплексе или субстрате. Поскольку ферменты представляют собой белки, молекулы которых содержат большое число ионизирующихся групп, то они могут находится в виде целого ряда различных ионных форм, причем распределение всего количества фермента между этими ионными формами зависит от рН и от констант ионизации различных групп. Поскольку, однако, каталитическая активность наблюдается обычно в относительно небольшом интервале значений рН, можно думать, что только одна из ионных форм фермента (или, точнее, его активного центра) каталитически активна, как это и предполагали Михаелис и Девидсон еще в 1911г. Имеется ряд соображений в пользу того, что ионизация тех групп в ферменте, которые удалены от активного центра, либо оказывает незначительное влияние, либо совсем не оказывает влияния на каталитическую активность; в то же время состояние ионизации групп, расположенных в самом центре или около него, очень существенно.
Если фермент активен только в одном состоянии ионизации, то и этого следует, что активность его будет в значительной мере определятся его ионизацией двух особых групп в активном центре или вблизи него, а именно тех групп, которые в первую очередь ионизируются(или, наоборот, деионизируются) при сдвиге рН в кислую или щелочную сторону от оптимума. Эти группы иногда называют кислой и основной группами фермента. Мы не будем рассматривать другие процессы ионизации, которые могут протекать при сдвиге рН до значений, еще более удаленных от оптимума, так как эти процессы влияют на состояние уже неактивных форм фермента. Правда, молекула фермента может содержать несколько одинаковых групп, которые будут ионизироваться одновременно, но присутствие в активном центре более одной такой группы маловероятно. В силу рассмотренных выше обстоятельств влияние рН на скорость ферментативных реакций обсуждают часто с учетом только двух ионизирующихся групп, используя при этом уравнения, применимые к двухосновным кислотам или к простым амфолитам, хотя без сомнения, такой подход является слишком упрощенным.
Похожие статьи
-
Активность ферментов - способность в разной степени ускорять скорость реакции. Активность выражают в: 1)Международных единицах активности - (МЕ)...
-
Спектрофотометрические методы. - Влияние значений рН и температуры на активность ферментов
Спектрофотометрические методы основаны на поглощении света в определенных участках спектра многими соединениями, являющимися активными группами...
-
Предлагаемый микрометод определения активности протеолитических ферментов основан на измерении содержания аргинина в пептидах, освобождающихся при...
-
Метод основан на том, что содержащие - аминогруппу аминокислоты дают с нингидридом окрашенную производную - дикетогидриндилидендикетогидриндамин, а также...
-
Для целей определения ферментов могут быть использованы не только измерение поглощения света, но также измерения флюоресценции - спектрофлюорометрические...
-
Подвижность воздуха возникает вследствие разницы температур на различных участках поверхности Земли. В гигиенической практике движение воздуха...
-
Пепсин и папаин относятся к одной из наиболее многочисленных групп ферментов - протеолитические ферменты (протеазы). Они принадлежат к классу гидролаз, к...
-
Манометрические методы., Другие методы. - Влияние значений рН и температуры на активность ферментов
Эти методы используются при определении активности фермента в тех случаях, когда в исследуемых реакциях один из компонентов находится в газообразном...
-
Пассивная устойчивость - Влияние температуры на жизненные процессы
Рассмотренные закономерности охватывают диапазон изменений температуры, в пределах которого сохраняется активная жизнедеятельность. За границами этого...
-
Введение. - Влияние значений рН и температуры на активность ферментов
Ферменты, (от лат. fermentum - брожение, закваска) или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый...
-
К 0.5 мл субстрата в соответствующем буферном растворе добавляют 0.5 мл пробы, содержащей фермент (экстракт, биологическую жидкость), инкубируют...
-
Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке,...
-
Эффект, оказываемый N-ADA на восстановление рефлекторной деятельности в постгипоксическом периоде оценивалась по уровню поведенческой активности животных...
-
К 0.5 мл того же ТХУ-центрифуганта добавляют 0.5 мл 2.5 мМ раствора CuSO4 , 4 мл 0.5 н. раствора NaOH и 1.5 мл разбавленного в три раза реактива Фолина....
-
Данный метод основан на следующих принципах. Гемоглобин подвергают воздействию пепсина, оставшийся гемоглобин осаждают трихлоруксусной кислотой....
-
Механизмы терморегуляции - Влияние температуры на жизненные процессы
Физиологические механизмы, обеспечивающие тепловой гомеостаз организма (его "ядра"), подразделяются на две функциональные группы: механизмы химической и...
-
Человеческий организм - это большие часы. Каждый процесс в которых должен регултроваться и не выходить из под контроля. Незаменимой шестеренкой в этих...
-
Влияние температуры на организм - Влияние температуры на организм
Температура -- важнейший из ограничивающих (лимитирующих) факторов. Пределами толерантности для любого вида являются максимальная и минимальная летальные...
-
Ферменты используют различные вещества для создания нашего организма. Но они могут не только созидать, но и разрушать уже построенное. Ферменты --...
-
Основные представления об адаптациях организмов - Влияние температуры на организм
Адаптация (лат. "приспособление") -- приспособление организмов к среде. Этот процесс охватывает строение и функции организмов (особей, видов, популяций)...
-
Понятие о среде обитания и экологических факторах - Влияние температуры на организм
Среда обитания организма -- это совокупность абиотических и биотических условий его жизни. Свойства среды постоянно меняются, и любое существо, чтобы...
-
Роль витаминов в построении ферментов
Витамины - это низкомолекулярные органические вещества самого разнообразного строения, которые не синтезируются в организме, но являются жизненно...
-
На 21-й день in vitro в клетках гиппокампа наблюдалась синхронизованная спонтанная кальциевая активность. Частота возникновения кальциевых осцилляций в...
-
Влияние среды - Значение и изучение генов
Главный фактор, детерминирующий любой фенотипический признак, - это генотип. Генотип организма определяется в момент оплодотворения, но степень...
-
Время лета и его продолжительность весьма разнообразны и ограничены теплым временем года в умеренных широтах. Наиболее ранними формами на юге средней...
-
Энзимодиагностика - Использование ферментов в медицинской практике в качестве лекарственных средств
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях...
-
В зависимости от химической природы ферменты делятся на простые и сложные [11]: Простые ферменты состоят только из аминокислот - например, пепсин,...
-
Водоросли. Их строение, морфологические признаки, их значение и воздействие на окружающую среду
Водоросли. Их строение, морфологические признаки, их значение и воздействие на окружающую среду. Водоросли -- группа организмов различного происхождения,...
-
Физиологическая роль белка, Структурная функция белка - Строение, функции и значение белков
Структурная функция белка Белки сложные органические соединения, построенные из аминокислот. В состав белковых молекул входят азот, углерод, водород и...
-
Витамины представляют собой группу веществ, которые необходимы для нормальной функции клеток, их роста и развития. Существует 13 основных витаминов,...
-
Введение - Регуляция активности генов, обусловленная химической модификацией (метилированием) ДНК
Регуляция активности генов, обусловленная химической модификацией (метилированием) ДНК (ГВОЗДЕВ В. А., 1999), БИОЛОГИЯ Рассмотрена роль метилирования ДНК...
-
Процесс митоза обеспечивает строго равномерное распределение хромосом между двумя дочерними ядрами, так что в многоклеточном организме все клетки имеют...
-
Температура и развитие - Влияние температуры на жизненные процессы
В наиболее генерализованной форме влияние температуры на обменные процессы прослеживается при изучении онтогенетического развития пойкилотермных...
-
Значение голубя сизого в антропогенном ландшафте - Голубеобразные Тамбовской области
Почему мониторинг состояния популяций сизого голубя в населенных пунктах представляет определенный теоретический и практический интерес? Прежде чем...
-
В каждом организме (животном, растительном или микробной клетке) все время происходят сложные процессы превращения веществ. Велика роль в этих процессах...
-
Значение симметрии в познании природы - Симметрия в природе
Идея симметрии часто являлась отправным пунктом в гипотезах и теориях ученых прошлого. Вносимая симметрией упорядоченность проявляется, прежде всего, в...
-
По первой в истории изучения ферментов классификации их делили на две группы: Гидролазы , ускоряющие гидролитические реакции, и Десмолазы , ускоряющие...
-
Способи вираження активності ферментів - Будова і властивості ферментів
У біологічних об'єктах ферменти знаходяться в дуже мізерних концентраціях, тому для оцінки ферментативних процесів визначають не вміст ферментів, що...
-
РОФ - функционально разнородная группа белков, способных быстро изменять свою концентрацию при различных нарушениях гомеостаза независимо от природы и...
-
Реализация функциональной активности фагоцитирующих клеток находится, в том числе, под контролем различных отделов нервной системы и регуляторных...
Влияние рН на активность ферментов. - Влияние значений рН и температуры на активность ферментов