Регуляция работы ферментов. Основные способы регуляции активности ферментов - Витамины, ферменты и гормоны и их роль в организме. Нарушения при их недостатке и избытке
Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра. Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Активность может увеличиться - это активация фермента, или уменьшиться - это ингибирование.
"Сообщение" о присоединении аллостерического активатора передается посредством конфирмационных изменений каталитической субъединице, которая становится комплементарной субстрату, и фермент "включается". При удалении активатора фермент вновь переходит в неактивную форму и "выключается". Аллостерическая регуляция является основным способом регуляции метаболических путей[14].
Регуляция активности ферментов путем фосфорилирования-дефосфорилирования. Фермент изменяет активность в результате ковалентной модификации (рисунок 2).
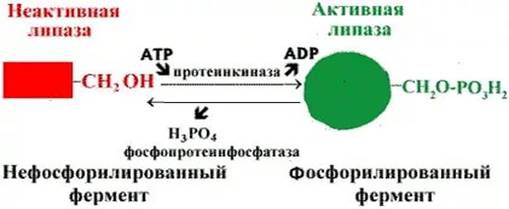
Рисунок 2 - Регуляция активности липазы
В этом случае фосфатная группа - ОРО32- присоединяется к гидроксильным группам в остатках серина, треонина или тирозина. В зависимости от природы фермента фосфорилирование может его активировать или, наоборот, инактивировать. Реакция присоединения фосфатной группы и ее отщепление катализируют специальные ферменты - протеинкиназы и протеинфосфатазы [14].
Регуляция путем ассоциации-диссоциации субъединиц в олигомерном ферменте. Этот процесс иногда начинается с ковалентной или нековалентной модификации одной из субъединиц. Например, фермент протеинкиназа в неактивной форме построена как тетрамер R2C2 (R и С - разные субъединицы). Активная протеинкиназа представляет собой субъединицу С, для освобождения которой необходима диссоциация комплекса. Активация фермента происходит при участии cAMP (циклоаденозинмонофосфорная кислота), которая способна присоединиться к субъединице R, после чего изменяется конформация, комплементарность субъединиц R и С и происходит диссоциация комплекса: R2C2 + 2cАМР 2С + 2(R - сАМР) Циклический АМР является продуктом АТР, превращение которой катализирует фермент аденилатциклаза: АТРс АМР + Н4Р2О7 [14].
Аденилатциклазная система. Аденилатциклаза и протеинкиназа катализируют взаимосвязанные реакции, которые составляют единую регуляторную систему (рисунок 3).
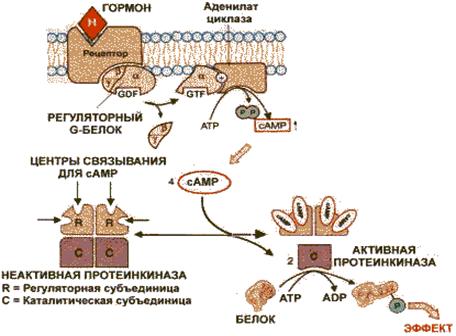
Рисунок 3 - Аденилатциклазная система
С помощью этой системы в клетку передаются сигналы из внеклеточной среды, и в нужном направлении изменяется метаболизм клетки. Внеклеточным вестником сигнала могут быть разные молекулы, в том числе и гормоны. Эти молекулы не проникают внутрь клетки, но "узнаются" мембранными рецепторами. При активации аденилатциклазы происходят следующие этапы:
Изменение конформации рецептора после присоединения к нему сигнальной молекулы и увеличение его сродства к регуляторному G-белку. В результате образуется комплекс рецептора и протомеров G-белка;
Образование этого комплекса приводит к изменению конформации a - протомера G-белка, который теряет сродство к GDP и происходит замена GDP на GTP. В результате комплекс протомеров G-белка распадается;
A - протомер взаимодействует с аденилатциклазой, что ведет к изменению ее конформации и как следствие этого - активации;
После этого аденилатциклаза катализирует синтез cAMP, который в свою очередь активирует cAMP-зависимую протеинкиназу. Активация последней связана с диссоциацией комплекса входящих в нее протомеров после присоединения cAMP. Протеинкиназафосфорилирует соответствующие ферменты, изменяет их активность и, следовательно, скорость метаболизма в клетке [14].
Активация ферментов путем частичного протеолиза. Некоторые ферменты синтезируются первоначально неактивными и лишь после секреции из клетки переходят в активную форму. Неактивный предшественник называется проферментом. Активация профермента включает модификацию первичной структуры с одновременным изменением конформации. Например, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента с N-конца: энтеропептидазатрипсиногентрипсин + Val-(Acn) - Lys
Расщепление определенных пептидных связей "запускает" новые взаимодействия R-групп по всей молекуле, приводя к новой конформации, в которой R-группы активного центра занимают оптимальное положение для катализа. Нарушения структуры какого-либо фермента, ведущие к снижению его активности, приводят к нарушению метаболических путей, в которых участвует этот фермент. Такие нарушения почти всегда проявляются как болезни. Повреждения ферментов бывают двух типов: наследственные дефекты строения фермента и повреждения, вызванные попадающими в организм токсическими веществами, ингибирующими фермент [14].
Похожие статьи
-
В зависимости от химической природы ферменты делятся на простые и сложные [11]: Простые ферменты состоят только из аминокислот - например, пепсин,...
-
Витамины представляют собой группу веществ, которые необходимы для нормальной функции клеток, их роста и развития. Существует 13 основных витаминов,...
-
Ферменты, или энзимы (от лат. fermentum, греч. жэмз, ?нжхмпн -- закваска) -- обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы,...
-
Ферменты участвуют в процессе пищеварения, помогая организму перерабатывать пищу. Они нормализуют обмен веществ, способствуя снижению веса. Укрепляют...
-
Введение - Витамины, ферменты и гормоны и их роль в организме. Нарушения при их недостатке и избытке
Пожалуй, каждому известна пословица: " Человек есть то, что он ест". Ведь одним из важнейших факторов влияющих на здоровье является питание. В составе...
-
Под руководством д-ра Фрэнсиса Поттергера (Francis Potterger) в течение 10 лет проводились независимые исследования по воздействию обработанной пищи на...
-
Ферменты используют различные вещества для создания нашего организма. Но они могут не только созидать, но и разрушать уже построенное. Ферменты --...
-
Витамины (от лат. vita -- "жизнь" и амин) -- группа низкомолекулярных органических соединений относительно простого строения и разнообразной химической...
-
Механизм действия гормонов. Роль циклазной системы в механизме действия гормонов - Понятие гормонов
По механизму действия гормоны делят на два основные типа. Первый - это белковые и пептидные гормоны, катехоламины и гормоноиды. Их молекула, подойдя к...
-
Дефицит витаминов чаще всего встречается у людей в холодное время года, когда свежие полезные продукты не всегда доступны. Существует два вида недостатка...
-
Дефицит того или иного витамина сказывается на взрослом человеке легче, нежели на ребенке, однако острый авитаминоз также может привести к тяжелым...
-
Гипервитаминоз -- острое расстройство в результате интоксикации сверхвысокой дозой одного или нескольких витаминов (содержащихся в пище или...
-
Выделяют три основные функции гормонов: - Гуморальная регуляция организма в онтогенезе
Обеспечение развития организма; Обеспечение приспособительных изменений в деятельности клеток, тканей, органов и организма в целом в зависимости от...
-
Реализация функциональной активности фагоцитирующих клеток находится, в том числе, под контролем различных отделов нервной системы и регуляторных...
-
Регуляция секреции гормонов - Гуморальная регуляция физиологических функций организма
Регуляция функций желез внутренней секреции осуществляется несколькими взаимосвязанными механизмами: внутриклеточным, гуморальным и нервным....
-
Железы смешанной секреции, Вывод - Гуморальная регуляция организма в онтогенезе
Яички и яичники - это половые органы, которые также относят к эндокринной системе, так как они вырабатывают гормоны, регулирующие половые функции. В...
-
В настоящее время большое значение в аутоаллергизации организма придается не только тонзилогенным очагам, но и хроническим одонтогенным очагам...
-
Гормоны вырабатываются: * железами внутренней секреции (эндокринными железами); * одиночными гормонпродуцирующими клетками; * хромаффинными клетками. Их...
-
Наряду с заболеваниями слизистой оболочки наиболее распространенными видами патологии полости рта являются болезни зубов (кариес, периодонтит,...
-
Название этого вида регуляции происходит от латинского hymor - жидкость. Этот вид регуляции осуществляется с помощью химических веществ, обладающих очень...
-
Роль витаминов в построении ферментов
Витамины - это низкомолекулярные органические вещества самого разнообразного строения, которые не синтезируются в организме, но являются жизненно...
-
Механизмы действия гормонов на клетки - Гуморальная регуляция физиологических функций организма
Существуют 2 основных механизма действия гормонов на уровне клетки: реализация эффекта с наружной поверхности клеточной мембраны ("быстрые" эффекты) и...
-
Гормональная регуляция, Функции гормонов - Гуморальная регуляция физиологических функций организма
Гормоны (греч. hormaino -- приводить в движение, побуждать) -- химические вещества, образуемые и выделяемые специальными эндокринными клетками, тканями...
-
Основные пути регуляции экспрессии генов - Экспрессия генов
Конечным результатом экспрессии любого известного гена на молекулярном уровне является образование молекул РНК или белка, информация о первичной...
-
Организм человека представляет собой систему высокодифференцированных клеток, тканей, органов, согласованная работа которых является непременным условием...
-
Начало разработки современной концепции рецепторов и их значения в регуляции функциональной активности клеток и нервных окончаний связано с именем JN...
-
Нарушение основных функции почек - Особенности функционирования почек человека
Нарушение клубочковой фильтрации. Сущность процесса фильтрации состоит с переходе части воды со всеми растворенными в ней неорганическими и органическими...
-
Вода и растворенные в ней вещества, числе минеральные соли, создают внутреннюю среду организма, свойства к-й сохраняются постоянными или изменяются...
-
Регуляция синтеза гема, Нарушения синтеза гема - Порфирии - Первичная структура белков
Регуляторными ферментами являются АЛК (аминолевулинатсинтетаза) и Аминолевулинатдегидрогеназа. АЛК - синтаза является главным регуляторным ферментом,...
-
Понятие гуморальной регуляции - Гуморальная регуляция физиологических функций организма
Гуморальная регуляция - это регуляция процессов жизнедеятельности с помощью веществ, поступающих во внутреннюю среду организма (кровь, лимфу, ликвор и...
-
В каждом организме (животном, растительном или микробной клетке) все время происходят сложные процессы превращения веществ. Велика роль в этих процессах...
-
Причины утомления: 1. В организме - 2. В мышце - в мышце во время сокращения накапливаются продукты обмена веществ (фосфорная кислота, молочная), которые...
-
РОФ - функционально разнородная группа белков, способных быстро изменять свою концентрацию при различных нарушениях гомеостаза независимо от природы и...
-
Различные эндокринные расстройства (дисфункции желез внутренней секреции) имеют существенное значение в формировании патологии зубочелюстного аппарата....
-
Механизм модификационной изменчивости - Формы изменчивости живых организмов
Модификационная изменчивость -- это результат не изменений генотипа, а его реакции на условия окружающей среды. При модификационной изменчивости...
-
Биологическая роль инсулина - Биохимия поджелудочной железы
I. Влияние на обмен углеводов: 1. Обеспечивает поступление глюкозы в клетки, так как: А) образует "канальцы" с белками - рецепторами, по которым глюкоза...
-
Наиболее важной буферной системой плазмы является бикарбонатный буфер, состоящий из слабой угольной кислоты (рК1 6,1) и ее кислого аниона бикарбоната....
-
Тема влияния наследственности и окружающей среды на развитие организма актуальна, так как представить современный и будущий мир без изучения этой науки...
-
Адгезивную способность лейкоцитов изучали по их способности прилипать к эндотелию сосудистой стенки по разработанной оригинальной методике. У крысы под...
-
Функции серы в растительном организме - Роль основных соединений серы в жизни растении
Одна из основных функций серы в белках и полипептидах - участие SH-групп в образовании ковалентных и водородных связей, поддерживающих трехмерную...
Регуляция работы ферментов. Основные способы регуляции активности ферментов - Витамины, ферменты и гормоны и их роль в организме. Нарушения при их недостатке и избытке