Регуляция функциональной активности фагоцитирующих клеток - Патофизиологическая роль церулоплазмина при лейкоцитозах и лейкопениях
Реализация функциональной активности фагоцитирующих клеток находится, в том числе, под контролем различных отделов нервной системы и регуляторных нейрогенных пептидов.
Исторический интерес представляют работы исследователей (221, 222, 419), которые после перерезки спинного мозга в шейном отделе наблюдали подавление фагоцитарной активности лейкоцитов.
Одной из функций лимбической системы мозга является обеспечение сохранения гомеостаза и осуществление защитно - приспособительных реакций организма. По концепции Г. Н. Крыжановского, возникновение пароксизмов эпилептиформной активности и манифестация генератора патологически усиленного возбуждения (ГПУВ) в структурах лимбико - диэнцефальной системы является типовым механизмом нарушения регуляции функций иммунной системы (84, 85). В частности, это проявляется нарушением неспецифических факторов противоинфекционной резистентности (фагоцитоз, бактерицидность) и повышением восприимчивости к инфекциям (53, 90).
На различных экспериментальных моделях продемонстрирована роль нейромедиаторов в модуляции функций фагоцитирующих клеток. Кроме того, при эмоциональных реакциях и психопатологии, когда, как известно, наблюдаются изменения содержания нейромедиаторов и активности нейромедиаторных систем мозга, отмечены сдвиги в неспецифических реакциях иммунитета.
Тормозной медиатор ЦНС г - аминомасляная кислота (ГАМК) в повышенных дозах до 200 мг/кг оказывает стимулирующее действие на неспецифические реакции иммунитета (179).
Со времен работ С. Метальникова (344) накоплен обширный материал о влиянии нейромедиаторов вегетативной нервной системы на активность фагоцитирующих клеток. Данные, полученные радиолигандным методом, свидетельствуют о наличии адрено - и холинорецпторов на различных популяциях фагоцитирующих клеток (200, 268, 389). Однако применительно к фагоцитирующим клеткам метод меченных лигандов для выявления нейромедиаторных рецепторов имеет относительную ценность в виду способности этих клеток захватывать различные аминосодержащие соединения (256).
Доказательством функциональной роли рецепторов к нейромедиаторам на фагоцитирующих клетках являются данные о влиянии адрено - и холинотропных препаратов на функции этих клеток. Подробный нейрофармокологический анализ роли этих рецепторов в регуляции фагоцитоза у нейтрофильных фагоцитов крови человека проведен в работе (296). Показано, что адреналин и изопротеренол (0,01 - 1 мкмоль/л) угнетают фагоцитоз частиц опсонизированного зимозана и высвобождение фагоцитами в - глюкуронидазы. Эффекты адреналина предупреждаются добавлением в - адреноблокатора пропранолола (1 мкмоль/л), б - адреноблокатор фентоламин не отменял действия адреналина. В противоположность адреномиметикам ацетилхолин и пилокарпин (0,01 - 1 мкмоль/л) существенно усиливают фагоцитарную активность нейтрофильных гранулоцитов. Их влияние предупреждается атропином, но не Н - холинолитическими веществами (тубокурарин). Аналогичные данные получены для мононуклеарных фагоцитов (57, 312).
Таким образом, влияние адрен - и холинергических регуляторных факторов на функции фагоцитов имеет реципрокный характер: ацетилхолин и его агонисты оказывают стимулирующее действие, а катехоламины - ингибирующее действие на эти клетки.
Некоторые гормоны обладают способностью существенно изменять функциональную активность фагоцитирующих клеток. Так, гормоны щитовидной железы Т3 и Т4 оказывают стимулирующее влияние на фагоцитарную активность нейтрофилов крови как в витральных условиях, так и при введении в организм (63). Аналогичными свойствами обладает инсулин при длительном введении препарата (69).
Один из пептидов тимуса - тимопентин усиливает фагоцитарную активность нейтрофилов и макрофагов у иммуносупрессированных морских свинок. In vitro в диапазоне концентраций 1 мг/мл - 10 пг/мл он ингибирует, а в концентрации ниже 10 пг/мл не влияет на фагоцитарный процесс (428).
Среди множества агентов гормональной природы, способных модулировать функции фагоцитов, особое внимание привлекают глюкокортикоидные гормоны (ГК). По - видимому, полиморфноядерные лейкоциты менее чувствительны к ГК, чем моноциты/макрофаги и лимфоциты. Установлено, что ГК дозозависимо угнетают фагоцитарные функции нейтрофилов, изменяют их бактерицидную активность, секрецию нейтральных протеаз (302). ГК ингибируют синтез фагоцитами цитокинов: ИЛ - 1, ИЛ - 2, ИЛ - 12, ТНФб, ИФНг, а также простагландинов, лейкотриенов, брадикинина, гистамина, фосфолипаз, нитроксидных радикалов, адгезивных молекул и кроме того, снижают экспрессию рецепторов для цитокинов на мембране фагоцитов (88, 161).
Показано, что рецепторы для ГК находятся в клетках в виде комплекса с белком теплового шока HSР90. Связывание ГК с рецептором приводит к диссоциации комплекса с HSР90. Влияние ГК на процессы экспрессии определенных генов, транскрипцию мРНК опосредовано транскрипционным фактором NFкB.
Оказывая влияние на миграционную и адгезивую способность фагоцитов, ГК способны резко ограничивать приток нейтрофилов и моноцитов в очаг воспаления, что одновременно является причиной снижения противоинфекционной защиты организма. Кроме того, ГК уменьшают количество клеток - предшественников гранулоцитов и моноцитов в костном мозге, снижают выход зрелых клеток из костного мозга, что ведет к быстрому снижению количества циркулирующих фагоцитов (153).
Таким образом, ГК обладают способностью оказывать влияние не только на функциональную активность лейкоцитов, но и на их количественный состав в периферической крови.
Кроме описанных выше нейрогуморальных факторов регуляции количественного состава и функциональной активности фагоцитирующих клеток особое место занимают регуляторные эффекты, опосредованные цитокинами. Действие цитокинов позволяет продемонстрировать значение фагоцитов в противоинфекционной и противоопухолевой защите организма, их положение на стыке иммунитета и неспецифической резистентности, а также их роль в формообразовательных и регенераторных процессах.
При остром воспалительном процессе в ответ на инфекционные агенты происходит индукция синтеза ИЛ - 1 , ИЛ - 2, ИЛ - 6, ИЛ - 8, ТНФ, ИФНг и других цитокинов (66, 67, 144, 163, 164, 196).
Ключевые провоспалительные цитокины ИЛ - 1 и ТНФ, выступающие обычно как синергисты, стимулируют экспрессию на поверхности эндотелиальных клеток и нейтрофилов адгезивных молекул, обеспечивая трансэндотелиальную миграцию лейкоцитов в очаге воспаления. ИЛ - 1 обусловливает двухфазную лейкемоидную реакцию, первый этап которой характеризуется временной лейкопенией в результате сосудистой адгезии нейтрофилов, а второй - нейтрофильным лейкоцитозом, связанным с выходом клеток из костномозгового депо. ИЛ - 1 индуцирует экзоцитоз специфических и азурофильных гранул. На уровне регуляции внутриклеточных процессов ИЛ - 1 способствует мобилизации внутриклеточного и связанного с мембраной кальция и активации биосинтеза лейкотриенов. Вместе с тем ИЛ - 1 не оказывает хемотаксического действия на нейтрофилы и не стимулирует в них дыхательный взрыв, продукция АФК увеличивается лишь в случае сочетанного воздействия на нейтрофилы ИЛ - 1 и активатора протеинкиназы С форбол-12-меристат-13-ацетата (113, 163, 195, 308, 421).
ТНФ оказывает разностороннее активирующее влияние на нейтрофилы (274, 346). Количество высокоаффинных рецепторов к ТНФ на поверхности 1 нейтрофила непостоянно и зависит от температуры: от 2200 до 6000 при 4о С и около 600 при 37о С. Возможно, регистрируемое снижение числа рецепторов при 37о С обусловлено усилением их интернализации и деградации (297, 321).
Обработка нейтрофилов ТНФ приводит к усилению фосфорилирования специфических белков с мол. массой 64 кД и как следствие к изменениям физико - химических свойств плазматической мембраны, проявляющихся в модуляции рецепторного аппарата нейтрофилов, активации ферментов НАДФН - оксидазного комплекса и метаболизма арахидоновой кислоты (358).
Освобождение арахидоновой кислоты принадлежит к числу ранних реакций нейтрофилов на ТНФ. Биосинтез лейкотриенов играет важную роль для дальнейшего развития каскада реакций, так как именно ингибиторы липоксигеназы, а не циклоксигеназы, угнетают активацию нейтрофилов ТНФ (219).
Влияние ТНФ на продукцию АФК фагоцитами характеризуется тем, что сильная активация нейтрофилов происходит только после их адгезии к подложке или при обработке стимуляторами, например, зимозаном. Напротив, кинетика продукции АФК суспендированными нейтрофилами, обработанными ТНФ, слабая, имеет кратковременный (5 - 10 мин) лаг - период и выход на плато через 30 - 60 мин. Стимулирующая активность ТНФ в отношении высвобождения АФК адгезированными нейтрофилами феноменальна: оптимальная концентрация этого цитокина на 3 - 5 порядков ниже, а высвобождение АФК в 10 - 100 раз выше, чем при воздействии других естественных стимуляторов (С5а, лейкотриен В4, арахидоновая кислота, ФАТ) (194).
ИЛ - 8, нейтрофилактивирующий фактор (NAF, NAP-1) синтезируется в том числе, и нейтрофилами. Интересно, что они продуцируют ИЛ-8 в течение первых 5-6 часов после стимуляции ЛПС в сочетании с ИЛ -1rа, ТНФ, ИЛ - 1. Причем, последние два цитокина действуют на специфические рецепторы на нейтрофилах и обеспечивают вторую фазу продукции ИЛ-8 примерно через 20 часов после стимуляции клеток. ИЛ-10 не влияет на ЛПС - индуцированную продукцию ИЛ - 8, но блокирует продукцию ТНФ и ИЛ - 1, полностью отменяя вторую фазу продукции ИЛ-8 нейтрофилами. ИФНг, наоборот, временно отменяет синтез ИЛ-8 на первом этапе, но увеличивает его в позднюю фазу за счет усиления продукции ТНФ и ИЛ - 1в (231).
В опытах in vitro при внутрибрюшинном введении кроликам ИЛ - 8 в концентрации 10-11 - 10-9 М было показано, что в месте инъекции происходит накопление только нейтрофильных лейкоцитов, но не моноцитов и базофильных лейкоцитов. Этот эффект не блокировался полимиксином В и актиномицином Д. Гистологический анализ выявил внутрисосудистое накопление нейтрофилов и формирование агрегатов (238).
В очаге воспаления ИЛ - 8 является потенциальным хемоаттрактантом для нейтрофилов и может влиять на трансмиграцию лейкоцитов в случае синтеза его эндотелиальными клетками. ИЛ - 8 активирует нейтрофилы, связываясь со специфическим рецептором, принадлежащим к семейству G-белков, в результате чего повышается плотность в2 - интегринов, усиливается адгезия нейтрофилов к покоящимся эндотелиальным клеткам и субэндотелиальному экстрацеллюлярному матриксу, но уменьшается адгезия к цитокинактивированному эндотелию, экспресирующему Е - селектин (230, 374). Полагают, что последнее может быть связано со слущиванием L - селектина на активированных ИЛ-8 нейтрофилах (300, 351, 383).
Коэкспрессия Е - селектина и ИЛ - 8 регулирует авидность связывания нейтрофилов с цитокинактивированным эндотелием. ИЛ-8 может изменять активность Е - селектинового контрецептора и совместно с ФАТ обеспечивать процесс миграции нейтрофилов из сосудистого русла.
Спектр действия КСФ (ГМ - КСФ и Г - КСФ) на фагоциты еще более широк. Они стимулируют рост и дифференцировку ранних и поздних гранулоцитарных и макрофагальных предшественников, формирование колоний этих клеток в культуре костного мозга, способствуют мобилизации зрелых клеток из костного мозга, увеличивая пул циркулирующих фагоцитов. В этом плане КСФ опосредуют действие других цитокинов, например, ИЛ - 1 (193, 223, 239, 251, 278, 281, 283, 306, 360).
Кроме того, ГМ - КСФ и Г - КСФ модулируют функции зрелых нейтрофилов, усиливая экспрессию адгезивных молекул, стимулируя хемотаксис, фагоцитоз, продукцию АФК, фагоцитарную активность в отношении различных микроорганизмов. Таким образом, эти цитокины оказывают влияние не только на количество, но и на функциональную активность зрелых циркулирующих нейтрофилов (87). Можно предположить, что быстрые изменения содержания КСФ в крови при различных ситуациях отражаются скорее на функциональном состоянии нейтрофилов и формировании экстренной нейтрофильной противоинфекционной защиты, чем на интенсивности гранулопоэза. Последнее имеет место только на 5 день после воздействия КСФ.
ИЛ - 6, проявляя как провоспалительный цитокин сходную с ИЛ - 1 и ТНФ активность в отношении нейтрофилов, имеет, однако, ряд функциональных особенностей. В отличие от ИЛ - 1 и ТНФ он усиливает не поглотительную, а киллерную активность нейтрофилов (120). Действуя преимущественно в поствакцинальном периоде, он может индуцировать апоптоз нейтрофилов и обладать противовоспалительными свойствами, ингибируя продукцию ИЛ - 1 и ТНФ за счет индукции синтеза их антагонистов и ингибиторов. К последним, например, относится ИЛ - 1ra - эндогенный антагонист рецептора ИЛ - 1, который блокирует синтез ИЛ - 8, ИЛ - 1 и ТНФ, снижает адгезию нейтрофилов. Таким образом, ИЛ - 6 является негативным цитокином в регуляции активности нейтрофилов и формирует фенотип фагоцитов, функционирующих в затухающем очаге воспаления (199, 206, 422, 423).
Похожим действием на функции нейтрофилов обладают ИЛ - 10 и трансформирующий фактор роста (ТФРв), препятствующие адгезии нейтрофилов к эндотелию, продукции АФК и секреции провоспалительных цитокинов (381). Последние при определенных условиях также могут оказывать негативную регуляцию функций нейтрофилов: ИЛ - 1 может угнетать адгезию нейтрофилов, а ТНФ - снижать экспрессию на их поверхности рецепторов, ингибировать хемотаксис и ускорять апоптоз.
Интересно, что сами нейтрофилы могут регулировать степень своей активности. Это может происходить в результате снижения экспрессии рецепторов к цитокинам путем их шеддинга и интернализации внутрь клетки. Нейтрофилы могут выступать в роли продуцентов уже известных цитокинов - ИЛ - 1, ИЛ - 6, ИЛ - 8, ТНФ, ТФРв, КСФ и др., которые участвуют в регуляции их функции, действуя как паракринно, так и аутокринно (рисунок 2) (174, 220, 231, 327).
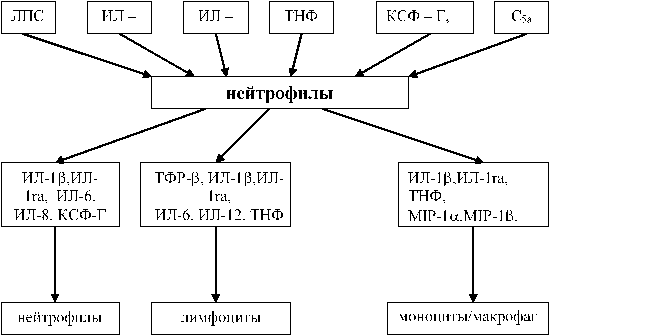
Рисунок 2. Продукция нейтрофилами иммунорегуляторных цитокинов и клетки - мишени для них (182)
Мононуклеарные фагоциты обеспечивают неспецифическую антибактериальную защиту организма не только за счет фагоцитарной функции. Секреция макрофагами провоспалительных, а затем противовоспалительных цитокинов обеспечивает контроль первой линии обороны организма от инфекций благодаря рекрутированию и активации самих макрофагов и других защитных клеток (гранулоцитов, естественных киллеров) (рисунок 3).
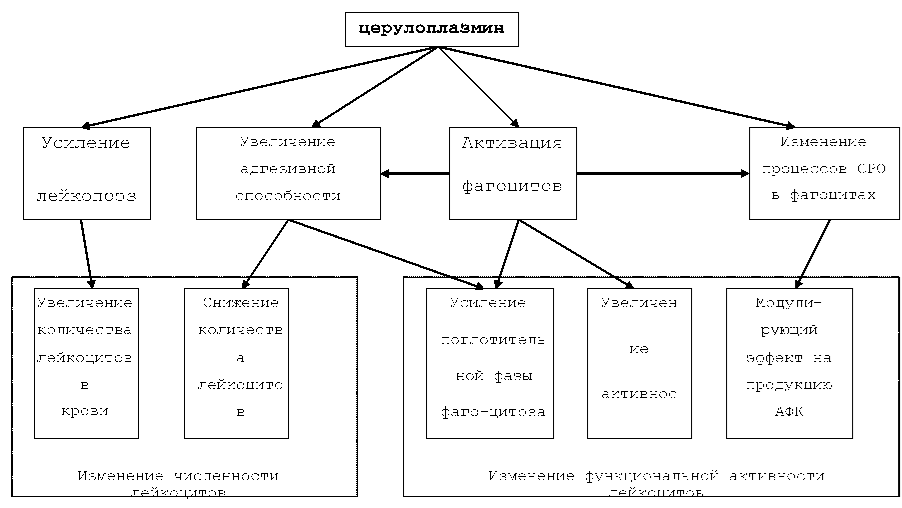
Рисунок 3. Продукция цитокинов моноцитами/макрофагами
Отечественными исследователями под руководством И. И. Долгушина показано, что нейтрофилы выделяют продукты пептидной природы - нейтрофилокины с мол. массой 15 - 68 кД. Причем, нейтрофилокины интактных клеток обладают иммунодепрессивными свойствами, а активированных - иммуностимулирующими. Первые снижают хемотаксис, образование АФК, фагоцитарную, лизосомную активность нейтрофилов. Вторые, наоборот, стимулируют эти функции (25, 46 - 48).
Возвращаясь к цитокинзависимой регуляции неспецифической защиты организма, необходимо отметить индукцию провоспалительными цитокинами синтеза РОФ - эмпирически сформированную группу биологически активных веществ, концентрация которых изменяется при воспалительной реакции. Некоторые из них обладают способностью регулировать неспецифические защитные и иммунные реакции организма.
Похожие статьи
-
Введение - Патофизиологическая роль церулоплазмина при лейкоцитозах и лейкопениях
Актуальность исследования. Регуляция количественного состава и функциональной активности фагоцитирующих клеток является актуальной проблемой современной...
-
Фагоциты как центральное звено неспецифической защиты организма На современном этапе развития медицинской науки иммунофагоцитарная система...
-
Одним из представителей РОФ третьего эшелона является Цп - исключительно активный гликопротеин 2 - глобулиновой фракции сыворотки крови человека и высших...
-
РОФ - функционально разнородная группа белков, способных быстро изменять свою концентрацию при различных нарушениях гомеостаза независимо от природы и...
-
Влияние церулоплазмина на количественный состав лейкоцитов при "невоспалительных" лейкоцитозах На предыдущем этапе работы было показано, что Цп способен...
-
Лейкоцитозы и лейкопении - Патофизиологическая роль церулоплазмина при лейкоцитозах и лейкопениях
Реализация неспецифической защиты организма зависит не только от функциональной активности фагоцитирующих клеток, но и от их количественного...
-
На следующем этапе исследования у нас возник вопрос о возможности влияния Цп на изменение функциональной активности лейкоцитов при воспалении на...
-
При лейкоцитозе в ответ на введение пирогенала нами отмечено изменение функциональной активности лейкоцитов. В контрольной группе, по данным ХЛ -...
-
Для изучения влияния Цп на процессы генерации АФК фагоцитами в условиях in vitro использовали цельную кровь здоровых людей - доноров крови, так как...
-
Влияние церулоплазмина на количественный состав и фагоцитарную функцию лейкоцитов при асептическом воспалении Воспалительные процессы различной этиологии...
-
Первой группе интактных животных Цп вводили внутрибрюшинно однократно в дозе 30 мг/кг. 30 мг/кг - доза, составляющая 75% от физиологической концентрации...
-
На первом этапе эксперимента к цельной крови добавляли растворы Цп различных концентраций (мкг/мл): 100,0; 200,0; 300,0; 400,0; 600,0; что...
-
Выражаю благодарность научному руководителю доктору медицинских наук, профессору Людмиле Владимировне Кривохижиной за помощь в планировании и организации...
-
Определение активности церулоплазмина. Активность Цп определяли по методу Тэна Э. В. (175). В пробирку вносили 0,1 мл сыворотки крови, 1 мл 0,4М...
-
Адгезивную способность лейкоцитов изучали по их способности прилипать к эндотелию сосудистой стенки по разработанной оригинальной методике. У крысы под...
-
Эксперименты выполнены на 350 белых беспородных крысах и крови 100 здоровых людей - доноров областной станции переливания крови. Все исследования на...
-
Клетка - единая система сопряженных функциональных единиц - Клеточная теория
В начале нашего изложения в согласии с клеточной теорией мы обсуждали первый ее постулат: клетка - наименьшая единица живого. Однако мы знаем о сложности...
-
Экспериментальные данные за последнее время, как отечественных, так и зарубежных исследователей свидетельствуют о высокой биологической активности...
-
Введение - Регуляция активности генов, обусловленная химической модификацией (метилированием) ДНК
Регуляция активности генов, обусловленная химической модификацией (метилированием) ДНК (ГВОЗДЕВ В. А., 1999), БИОЛОГИЯ Рассмотрена роль метилирования ДНК...
-
1.1 не нарушена (норма) 1.2 нарушена (дисфункция) по типу: 1.2.1 синусовой брадикардии (ЧСС днем 1.2.2 синдрома Шорта (тахикардии-брадикардии) 1.2.3...
-
Гормоны аденогипофиза (тропные гормоны) имеют пептидную природу, поступают в общий кровоток и достигают определенных тканей-мишеней. В зависимости от...
-
Гормональная регуляция углеводного, липидного, белкового и водно-солевого обмена - Понятие гормонов
Основные энергетические ресурсы живого организма -- углеводы и жиры обладают высоким запасом потенциальной энергии, легко извлекаемой из них в клетках с...
-
Метод микрофигурии - Методы изучения клетки
С помощью микроманипулятора отдельные части клетки можно удалять, добавлять или каким-то образом видоизменять. Крупную клетку амебы удается разделить на...
-
Молекулярная основа устойчивости клеток к вирусам. - Строгие постулаты Коха
Хотя устойчивость, индуциорованная интерфероном, защищает клетки от самых различных ДНК РНК-вирусов, степень защиты от разных вирусов неодинакова. Кроме...
-
ОБУЧЕНИЕ. ПАМЯТЬ. ПОВЕДЕНИЕ - Регуляция физиологических процессов
Множество исследований обращено к проблеме контроля нейропептидами и нейротрофическими ростовыми факторами сложных форм нейрогенной активности, таких как...
-
Роль ферментов в жизнедеятельности животных, растений и микроорганизмов колоссальна. Благодаря каталитической функции разнообразные ферменты обеспечивают...
-
Люди впервые получили инсулин в 1921 году из поджелудочной железы собак Бантинг и Бест приготовили экстракт. В кристаллическом виде в 1926 году Sanger...
-
Гормональная регуляция экспрессии генов - Экспрессия генов
Регуляция с помощью гормонов - это частный случай регуляции на уровне транскрипции. Таким путем организм заставляет клетку "включить" определенные гены в...
-
Железы смешанной секреции, Вывод - Гуморальная регуляция организма в онтогенезе
Яички и яичники - это половые органы, которые также относят к эндокринной системе, так как они вырабатывают гормоны, регулирующие половые функции. В...
-
Выделяют три основные функции гормонов: - Гуморальная регуляция организма в онтогенезе
Обеспечение развития организма; Обеспечение приспособительных изменений в деятельности клеток, тканей, органов и организма в целом в зависимости от...
-
В настоящее время проблема адаптации спортсмена к физическим нагрузкам является одной из актуальных проблем. Проблематика заключается в раскрытии...
-
Основой противовирусного иммунитета является клеточный иммунитет. Клетки-мишени, инфицированные вирусом, уничтожаются цитотоксическими лимфоцитами, а...
-
Размеры бактериальной клетки обычно составляют от 1 до 15 мкм. Форма клеток очень разнообразна: палочковидные (бациллы), сферические (кокки),...
-
Этиология и патогенез В настоящее время установлено, что микроорганизм Helicobacter pylori (HP) является важным участником формирования таких...
-
Заключение - Регуляция активности генов, обусловленная химической модификацией (метилированием) ДНК
Последние годы ознаменовались заметными успехами молекулярно-биологических исследований механизмов эпигенеза - наследуемых в клеточных поколениях, но...
-
Начало разработки современной концепции рецепторов и их значения в регуляции функциональной активности клеток и нервных окончаний связано с именем JN...
-
Роль трансформации при литической инфекции - Строгие постулаты Коха
Согласно общепринятым взглядам, способность вируса вызывать заболевание - это всего лишь побочный эффект работы механизмов, лежащих в основе размножения...
-
Литература - Регуляция активности генов, обусловленная химической модификацией (метилированием) ДНК
1. Корочкин Л. И. Как гены контролируют развитие клеток // Соросовский Образовательный Журнал. 1996. № 1. С. 17-22. 2. Жимулев И. Ф. Действие генов в...
-
Молекулярные механизмы регуляции клеточной смерти - Биологические механизмы жизненного цикла клетки
Апоптоз - многоэтапный процесс. Первый этап - прием сигнала, предвестника гибели в виде информации, поступающей к клетке извне или возникающей в недрах...
-
ЭНДОКРИННАЯ СИСТЕМА - Анатомия, конспект лекций
Характеристику системы начать с того, что регулирующее влияние на организм человека оказывает не только нервная, но и эндокринная система, образованная...
Регуляция функциональной активности фагоцитирующих клеток - Патофизиологическая роль церулоплазмина при лейкоцитозах и лейкопениях