Літературний огляд, Будова ферментів - Будова і властивості ферментів
Будова ферментів
За хімічною природою ферменти - це білки, що проявляють каталітичні властивості, тобто вони прискорюють перебіг різних хімічних процесів, які відбуваються в живому організмі. Ферментам притаманні всі фізико-хімічні властивості білків: висока молекулярна маса, розщеплення до амінокислот під час гідролізу, утворення колоїдоподібних розчинів; вони не стійкі до впливу високих температур та солей важких металів, проявляють антигенні властивості, піддаються фракціонуванню. Як і білки, ферменти поділяються на прості й складні. Прості, або однокомпонентні, ферменти містять у своєму складі тільки амінокислоти. Наприклад, пепсин, уреаза, РНКаза та інші. Більшість ферментів є двокомпонентними, тобто складаються з білкової і небілкової (простетичної) частин. Їх називають ще голоферментами, а їх складові, відповідно, апоферментами (білкова частина) і простетичною групою, або коферментом (небілкова частина ферменту) (рис. 1):
Голофермент апофермент + кофермент, або простетична группа

Структурно-функціональні особливості ферментів
Більшість ферментів має чотири рівні структурної організації (первинну, вторинну, третинну і четвертинну), тобто є олігомерними білками, що складаються із протомерів. Кожна із субодиниць або окремі їх частини відіграють певну роль у процесі функціонування ферменту. Прості (однокомпонентні) ферменти здійснюють ферментативне перетворення субстрату з участю власне білкової молекули. Безпосередню участь у реакції бере не весь поліпептидний ланцюг ферменту, а тільки незначна його частина, що близько прилягає до субстрату. У ферментативну реакцію включається тільки декілька залишків амінокислот. Ці залишки можуть розташовуватися в поліпептидному ланцюзі як поруч, так і далеко один від одного, але просторово вони повинні бути досить зближені.
Наприклад, фермент рибонуклеаза, що розщеплює РНК, має структуру, яка скріплюється чотирма дисульфідними зв'язками (на рисунку заштриховано). В каталітичному центрі ферменту у 12 і 119 положенні поліпептидного ланцюга знаходяться два залишки гістидину, але вони просторово зближені й можуть викликати розрив молекули РНК. На близькій відстані від залишків гістидину знаходиться ще 5 залишків основних амінокислот, які, очевидно, можуть фіксувати РНК під час реакції (рис).

Схема структури рибонуклеази - ферменту, що гідролізує РНК (за Ж. Крю).
Та частина молекули ферменту, яка з'єднується із субстратом, називається активним центром ферменту. Активний центр відповідає за специфічну спорідненість ферменту із субстратом, утворення ферментосубстратного комплексу і каталітичне перетворення субстрату. В активному центрі ферменту умовно розрізняють так звану каталітичну ділянку, де відбувається каталітичне перетворення субстрату, і контактну, або якірну ділянку, що зв'язує фермент із субстратом. Схема розташування складових компонентів активного центру показана на рис. 5.
За утворення активного центру ферменту, як і за його каталітичну дію, відповідає третинна структура білкової молекули. Отже, при порушенні третинної структури (денатурація) роз'єднуються просторово поєднані амінокислотні залишки і, як наслідок, фермент втрачає активність. У складі активного центру простого ферменту знаходиться приблизно 15 залишків амінокислот. Активний центр утворюють залишки таких амінокислот, як серин, цистеїн, гістидин, тирозин, лізин та деякі інші, що надають ферменту як просторової, так і електричної спорідненості із субстратом. В утворенні тимчасового комплексу між ферментом і субстратом важлива роль належить дисульфідним, іонним, а також слабким зв'язкам (водневі зв'язки, гідрофобна взаємодія).
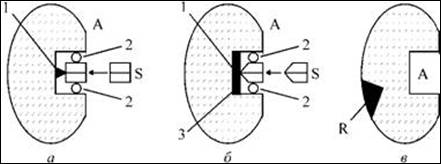
Рис. 3. Схема функціональної організації молекули ферменту:
А - простий фермент; б - двокомпонентний фермент; в - алостеричний фермент; А - активний центр; S - субстрат; R - регуляторний, або алостеричний, центр;1 - каталітична ділянка; 2 - контактна ділянка; 3 - кофактор.
Активний центр складних (двокомпонентних) ферментів містить у своєму складі як кофермент, так і ту частину апоферменту, що просторово прилягає до нього. Кофермент при цьому може відповідати за утворення зв'язку із субстратом, формування третинної або четвертинної структури апоферменту і каталітичне перетворення субстрату. Ферменти можуть мати 1, 2, 3 і більше активних центрів, що залежить від кількості протомерів (субодиниць), які входять у його структуру.
Крім активних центрів, у ферментах можуть бути ще так звані алостеричні центри (від грец. алос - інший, другий; стереос - просторовий, структурний). Алостеричні центри служать місцем впливу на фермент різних регуляторних чинників, тому їх ще називають регуляторними центрами, а речовини, що взаємодіють з алостеричним центром, отримали назву ефекторів. Приєднання до алостеричного центру ефектора призводить до певних структурних змін в активному центрі та, як наслідок, пригнічення або підвищення активності ферменту. Ефекторами можуть служити продукти ферментативних реакцій, гормони, медіатори нервової системи, метали. Алостеричних центрів (як і активних) фермент може мати декілька, відповідно до кількості протомерів. Важливо зазначити, що алостеричні й активні центри у ферментах просторово відокремлені, тобто знаходяться один від одного на певній відстані.
Похожие статьи
-
Вступ - Будова і властивості ферментів
Обмін речовин в організмі живої істоти можна визначити як сукупність всіх хімічних перетворень, яким піддаються сполуки, що надходять ззовні. Ці...
-
В зависимости от химической природы ферменты делятся на простые и сложные [11]: Простые ферменты состоят только из аминокислот - например, пепсин,...
-
ОГЛЯД ЛІТЕРАТУРИ, Будова та життєвий цикл ВІЛ - ВІЛ-інфекція у дітей
Будова та життєвий цикл ВІЛ ВІЛ(Вірус Імунодефіциту Людини) - це специфічний вірус, який відноситься до родини ретровірусів. Особливістю ретровірусів є...
-
Спинний мозок, топографія, форма, будова Спинний мозок, medulla spinalis - розміщується в хребетному каналі. Являє собою трохи сплюснутий попереду назад,...
-
Вплив важких металів на рослинний організм Важкий метал рослина гваякол пероксидаза В природі рослини піддані впливу різноманітних стресових чинників...
-
Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке,...
-
Ферменты участвуют в процессе пищеварения, помогая организму перерабатывать пищу. Они нормализуют обмен веществ, способствуя снижению веса. Укрепляют...
-
Ферменты рестриктазы - Великие открытия в генетике ХХ века
Прорыва, приведшего ко всем предыдущим открытиям, могло и не случиться, если бы не бактериальный вирус, следующее открытие было также сделано благодаря...
-
Фермент витамин гормон здоровье Нормальное существование человеческого организма и здоровья в целом зависит от многих фактором, немаловажным из которых...
-
Роль витаминов в построении ферментов
Витамины - это низкомолекулярные органические вещества самого разнообразного строения, которые не синтезируются в организме, но являются жизненно...
-
Ферменты (от латинского слова fermentum - закваска) - белки, которые обладают каталитической активностью и характеризуются очень высокой специфичностью и...
-
Властивості води, Чудесні зцілення водою - Водойми рідного краю. Їх стан та охорона
Володимир Леліков вважає, що вода, яку ми споживаємо, впливає на емоційний стан людини та здатність її організму до цілісного, ефективного...
-
Ферменты, или энзимы (от лат. fermentum, греч. жэмз, ?нжхмпн -- закваска) -- обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы,...
-
Свойства ферментов - Питательные вещества
Важнейшим свойством ферментов является преимущественное одной из нескольких теоретически возможных реакций. В зависимости от условий ферменты способны...
-
В каждом организме (животном, растительном или микробной клетке) все время происходят сложные процессы превращения веществ. Велика роль в этих процессах...
-
Будова, функції головного мозку. - Розлади вимови
У головному мозку людини розрізняють три частини, відмінні щодо еволюційного минулого та функціонального значення: найдавнішу - стовбур головного мозку...
-
Действие ферментов пищеварительного тракта на углеводы - Обмен углеводов в организме животных
В ротовой полости распад крахмала катализируют содержащиеся в слюне ферменты б-амилаза и мальтоза. Они гидролизуют б - гликозидные связи. Под действием...
-
Переносимость и побочные эффекты - Ферменты в гастроэнтерологии
Побочные эффекты при применении ферментных препаратов встречаются крайне редко (менее 1%) и носят чаще всего дозазависимый характер. В моче больных,...
-
Клинические особенности применения - Ферменты в гастроэнтерологии
Одним из важных факторов, определяющих успех лечения, является правильный выбор ферментного препарата, его дозы и продолжительности лечения. При выборе...
-
Походження, географічне розповсюдження та культивування Батьківщина хризантеми точно не відома. Рослина походить з Далекого Сходу, але на даний час...
-
Гомеостаз тканин і органів порожнини рота забезпечує фізиологічне функціонування і опір до впливу негативних факторів навколишнього середовища....
-
Форма тіла пінгвінів обтічна, що ідеально для пересування у воді. Мускулатура і пристрій кісток дозволяють їм під водою працювати крилами майже як...
-
Краткая фармакологическая характеристика - Ферменты в гастроэнтерологии
Ацидин-пепсин - препарат, содержащий протеолитический фермент. Получают из слизистой оболочки желудка свиней. Таблетки по 0,5 и 0,25 г содержат 1 часть...
-
Состав ферментных препаратов - Ферменты в гастроэнтерологии
При нарушении пищеварения применяются различные лекарственные средства, содержащие ферменты. В зависимости от состава ферментные препараты можно...
-
ФЕРМЕНТНЫЕ ПРЕПАРАТЫ В ГАСТРОЭНТЕРОЛОГИИ - Ферменты в гастроэнтерологии
Ферментные препараты - это группа фармакологических средств, способствующих улучшению процесса пищеварения. Нарушения процесса пищеварения различной...
-
Властивості ТА - Рефлексотерапія
ТА це певні морфологічні (проте без специфічним морфологічних структур) утворення в шкірі та нижче розташованих тканинах, вони мають однакову анатомічну...
-
Висновок - Спинномозкові нерви: будова, функції
При складанні контрольної роботи до уваги взята специфіка існуючої програми вивчення нервової системи людини, як один з найскладніших розділів анатомії....
-
Одной из групп заболеваний, доставляющих человеку большие неприятности, являются нарушения в гормональной сфере. Подобные патологии наиболее свойственны...
-
Человеческий организм - это большие часы. Каждый процесс в которых должен регултроваться и не выходить из под контроля. Незаменимой шестеренкой в этих...
-
Гормоны (др.-греч. ?смЬщ -- возбуждаю, побуждаю) -- биологически активные вещества органической природы, вырабатывающиеся в специализированных...
-
1. Самыми распространенными ферментативными препаратами являются комплексы ферментов желудочно-кишечного тракта (Фестал, Панзинорм форте, Мезим форте,...
-
Под руководством д-ра Фрэнсиса Поттергера (Francis Potterger) в течение 10 лет проводились независимые исследования по воздействию обработанной пищи на...
-
Энзимотерапия - Использование ферментов в медицинской практике в качестве лекарственных средств
Энзимотерапия - это использование ферментов в качестве лекарственных средств. Использование ферментов в качестве терапевтических средств имеет много...
-
Ферменты используют различные вещества для создания нашего организма. Но они могут не только созидать, но и разрушать уже построенное. Ферменты --...
-
Энзимодиагностика - Использование ферментов в медицинской практике в качестве лекарственных средств
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях...
-
Глутатіон редуктаза (GR, NADPH-залежна глутатіон оксидоредуктаза; ЕС 1.6.4.2.) - фермент, який відновлює глутатіон за рахунок окиснення NADPH. GSSG + 2...
-
Аспекты проблемы Термин "ферменты вирусов" может употребляться в узком и широком смысле слова. В первом случае имеется в виду ферментативная активность,...
-
Дефицит того или иного витамина сказывается на взрослом человеке легче, нежели на ребенке, однако острый авитаминоз также может привести к тяжелым...
-
Литература - Ферменты в гастроэнтерологии
1. Гребенев А. Л., Мягкова Л. П. Болезни кишечника. М., 1994.- 397с. 2. Григорьев П. Я., Яковенко А. В. Справочное руководство по гастроэнтерологии. М.,...
-
Гормоны могут влиять на поведение, воздействуя на сенсорно-перцептивные механизмы, на активность нервной системы и на эффекторные механизмы, необходимые...
Літературний огляд, Будова ферментів - Будова і властивості ферментів