Морфологические особенности конидиогенеза Venturia inaequalis (Cooke) Winter в лабораторных условиях
Морфологические особенности конидиогенеза Venturia inaequalis (Cooke) Winter в лабораторных условиях
Возбудитель парши яблони микромицет Venturia inaequalis (Cooke) Winter наносит существенный ущерб при промышленном производстве плодов, снижая урожайность и качество продукции. Сложность контроля фитопатогена обусловлена двухстадийностью жизненного цикла, сочетающего увеличение генетических вариант во время полового процесса и значительной мультипликации инокулюма гриба при бесполом размножении. Половой процесс протекает в тканях листового опада, начинаясь с формирования плодовых тел - псевдотециев и заканчиваясь образованием и разлетом аскоспор. Бесполое развитие происходит на вегетирующем растении. Аскоспора попав на листовую пластинку при достаточной влажности прорастает, проникает через кутикулярный слой и в пространстве между кутикулой и стенками эпидермальных клеток формирует строму [1, 2]. Образование конидиеносцев вызывает разрыв кутикулы листа растения-хозяина и появление характерных темно-оливковых пятен парши. На конидиеносцах (конидиофорах, аннелидах) формируются конидиоспоры. Конидиеносцы в основном прямые, неветвящиеся, гладкие, окрашенные (от светло - до темно-оливково-коричневого цвета), расположенные одиночно или пучками, длинна до 90 мкм, толщина - 5-6 мкм, у основания расширенные [3].
Ультраструктурные исследования конидиогенеза Venturia inaequalis позволили определить его к бластическому типу образования бесполых спор, происходящему по механизму почкования, при котором конидия формируется до образования двухслойной септы. После возникновения септы конидия отделяется с дистальной ее частью, другой слой септы остается на аннелиде. На месте отделения конидии остается кольцеобразный рубец. Следующая конидия образуется через рубец, его вершина удлиняется возникает конидиогенный локус, после чего процесс завершается формированием септы. С продукцией каждой новой конидии конидиеносец становится более длинным и узким, на нем остаются следы рубцов после каждой аннеляции [4, 5].
Культура V. inaequalis была получена Адерхольдом в 1896 году на различных питательных средах естественного состава, содержащих отвары из листьев и побегов различных садовых культур, а также свежий сок огурца и желатин. Немецким ученым было показано, что культуральные характеристики гриба были одинаковыми вне зависимости от того из какой споры, полового или бесполого этапа развития, они были получены [6]. Моноспоровая культура гриба широко используется в генетических, биохимических и популяционных исследованиях парши яблони [7-14].
Систематических исследований по конидиогенезу V. inaequalis в чистой культуре не проводилось. Обычно в культуральных исследованиях оценивали наличия и интенсивность споруляции культуры путем смыва конидий с ее поверхности [7, 10-12]. Не встречается информация о наличии или отсутствии споруляции в субстратном мицелии при культивировании на твердых питательных средах. Wallace (1913) показал наличие на мицелии, растущем в говяжьем и яблочном бульоне, образование одиночных конидий на конидиофоре [15].
Способность лабораторной культуры V. inaequalis к спороношению, является важным диагностическим признаком при морфолого-культуральном анализе, в тесте на чувствительность к фунгицидам, при создании сборного инокулюма для искусственного инфекционного фона и т. п. Опосредованно степень спороношения изолята может говорить о таких характеристиках патогена, как его агрессивность [7]. Зачастую в задачах исследования, например, по определению вирулентности биотипов парши к различным сортам яблони важно получение чистой культуры с хорошим уровнем споруляции, так как заражение осуществляется суспензией спор.
Для эффективной оценки споруляции или отбора высокоспорулирующих биотипов, важно иметь четкое представление о характере процесса конидиогенеза в чистой культуре патогена, в том числе о расположение спорообразующих структур.
Материалы и методы
Исследования проводились в лаборатории генетики и микробиологии ФГБНУ Северокавказского федерального научного центра садоводства, виноградарства и виноделия. Объектами исследований служили лабораторные культуры V. inaequalis, выделенные в 2017 году из образцов опавшей листвы яблони, собранных в промышленном насаждении ОАО "Агроном" (п. Агроном, Динской р-он). Отбор половой стадии патогена производили, основываясь на рекомендациях [16].
Чистая культура V. inaequalis была получена из аскоспоровой стадии развития гриба по методике, предложенной Насоновым и др. [17]. Моноаскоспоровые изоляты патогена выделяли, растили и определяли особенности конидиогенеза с использование картофельно-глюкозного агара: 100 г картофеля (отвар), 20 г глюкозы, 20 г микробиологического агара на 1 л воды [7], Выделение и выращивание лабораторных изолятов проводили в темноте при температуре 20ОС. При получении моноаскоспорового изолята, дальнейшие пересевы культуры на свежую питательную среду осуществляли кусочком агара с грибным мицелием. Для исследования использовали культуры месячного возраста.
Оценку особенностей спороношения проводили визуально и с применением световой микроскопии: стереомикроскоп МС-1, биологический тринокулярный микроскоп "Olympus BX41", с дополнительной насадкой видеоокуляра "DCM-130". Осуществляли микроскопию препаратов раздавленного или целого агарового блока с субстратным мицелием. Для оценки конидиогенных структур воздушного мицелия, использовали три подхода приготовления препарата для микроскопирования: 1) воздушный мицелий соскабливали препаровальной иглой с поверхности культуры, переносили в каплю воды на предметное стекло и накрывали покровным стеклом; 2) чистую культуру патогена заливали расплавленным агар-агаром непосредственно поверх питательного агара, после застывания агаризованной среды, вырезали блок агара с воздушным мицелием и готовили раздавленный препарат; 3) к поверхности чистой культуры прикладывали без нажима клейкой стороной отрез скотча размером 2 х 2 см, затем скотч с прилипшим воздушным мицелием помещали в каплю воды на предметное стекло.
Под стереомикроскопом спороношение изучали нативно без приготовления препарата, непосредственно на чашке Петри.
Результаты и обсуждение
Визуальное обследование спороносящих изолятов V. inaequalis показало наличие зернистости субстратного мицелия у некоторых образцов (рис. 1А, 1Б). Самые молодые краевые субстратные гифы обычно не имели зерен. Зерна отмечались на более старом мицелии, и количество их увеличивалось в направлении от края колонии к ее центру. В ряде случаев только отдельные гифы на всем протяжении имели зернистость, такие гифы выглядели как тяжи большого размера.
Микроскопирование при небольшом увеличении (40Х и 100Х) позволило увидеть, что зерна представляют собой компактные скопления конидий на субстратных гифах (рис. 1В, 1Г). Скопления спор имели вид мутовок, и каждая отдельная конидия характеризовалась четко ориентированным расположением: широким основанием к гифе, а острой частью от него.
Более тонкое микроскопирование (800Х) позволило увидеть строение конидиогенной гифы, которая представляла собой относительно короткий отросток на субстратной гифе - конидиеносец (рис. 2А, 2Б). Самые короткие конидиеносцы были прямыми, перпендикулярно отходящими от гиф, более длинные были изогнутыми в направлении гифы или даже перекрещивающимися с ней (рис. 2А).
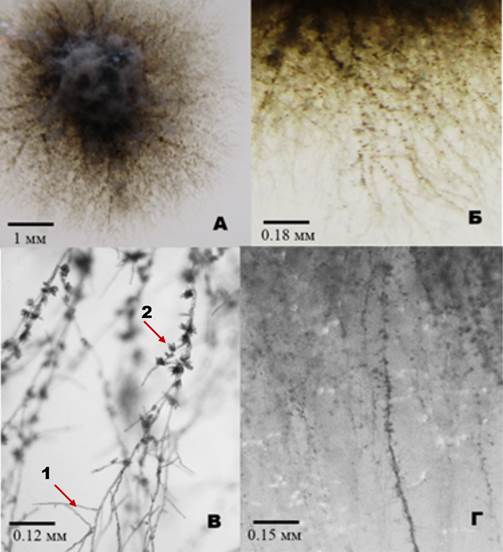
Рисунок 1. Морфологические особенности конидиогенеза субстратного мицелия чистой культуры Venturia inaequalis на твердой искусственной среде. А - чистая культура V. inaequalis в проходящем свете; Б - фрагмент культуры (масштабирование), зернистая структура мицелия; В - гифа с группами конидий, микроскопирование нативной культуры (100 Х); Г - зернистая структура гиф, микроскопирование нативной культуры (40 Х). 1 - гифа; 2 - группа конидий
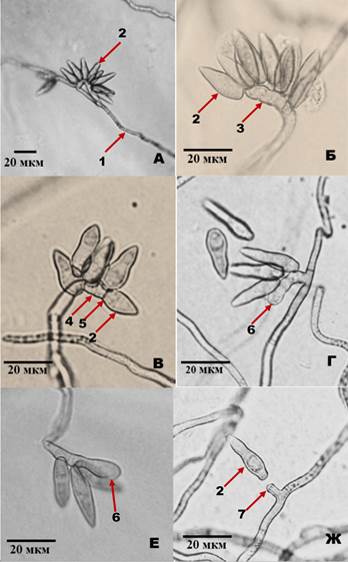
Рисунок 2. Морфологические особенности органов конидиогенеза субстратного мицелия чистой культуры Venturia inaequalis на твердой искусственной среде (микроскопирование препаратов). А - гифа с пучком конидий (200 Х); Б - конидиеносец с отделившимися конидиями (800 Х); В - конидиеносец с не отделившейся конидией, между конидиеносцем и конидией сформировалась септа, на конидиеносце просматриваются зоны аннеляций (800 Х); Г, Е - конидиеносец с конидиогенным локусом (800 Х); Ж - конидиеносец с единичной отделившейся конидией, на конидиеносце остался рубец. 1 - гифа; 2 - конидий, 3 - конидиеносец, 4 - зона аннеляций, 5 - септа, 6 - конидиогенный локус, 7 - рубец (воротничок)
Если на конидееносце было несколько конидий, то они располагались вдоль него, иногда от самого его основания, на внешней стороне изгиба, при этом широкое основание конидии было обращено к конидиеносцу. Нередко конидии располагались веером в одной плоскости. Однако связанной с конидиеносцем была всегда только одна конидия, которая находилась на его вершине. Между не отделившейся конидией и конидиеносцем имелась септа. Таким образом, можно говорить о бластическом типе конидиогенеза. В некоторых случаях на вершине конидееносца встречалось вздутие, так называемый конидиогенный локус из которого в дальнейшем развивалась новая спора (рис. 2Г, 2Е). На конидиеносце наблюдались следы рубцов от отделившихся конидий. На вершине конидееносца с только что отделившейся спорой видна кольцеобразная форма рубца (рис. 2Ж).
На воздушном мицелии подобной зернистости отмечено не было. Микроскопия нативной культуры при малых увеличениях показала наличие конидиогенных гиф, несущих одну конидию (рис. 3Б, 3Г). Встречались прилипшие к гифам конидии (рис. 3А). Подготовка препарата с целыми конидиогенными структурами для микроскопии с большим увеличением имела трудности. Так, отбор воздушного мицелия с помощью препаровальной иглы и подготовка препарата "раздавленная капля" приводили к осыпанию конидий с конидиеносцев, а также беспорядочному переплетению гиф (рис. 3В). Не дал успеха подход и с заливкой культуры расплавленным агар-агаром. Однако применение скотча (третий подход) позволило получить положительный результат. Так, на рисунках 3Д и 3Ж видно, что на воздушном мицелии имеются прямые конидиеносцы, несущие одну конидию. На конидиогенной гифе также можно видеть характерные кольцевые утолщения, рубцы от отделившихся зрелых конидий.
Ультраструктурные исследования конидиогенных структур V. inaequalis из поражений листьев яблони, проведенные Hammill и Corlett с соавторами, позволило определить тип конидиогенеза как бластическо-аннелидный [4, 5, 18]. При этом типе продукции спор каждая новая конидия образуется из кольцеобразного рубца, оставшегося от предыдущей споры. Согласно классификации, такой конидиеносец называется аннелидом (т. е. кольчатый). После каждого цикла спорообразования новый рубец располагается выше предыдущего, просматривающегося на аннелиде как кольцевое утолщение, пространство между ними определяют, как зону аннеляции. Аннелид V. inaequalis прямой, ровный, на каждом цикле аннеляции на нем располагается только одна конидия.
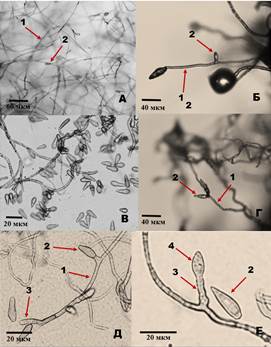
Рисунок 3. Морфологические особенности конидиогенеза воздушного мицелия чистой культуры Venturia inaequalis на твердой искусственной среде. А - воздушный мицелий, микроскопирование нативной культуры; Б - гифа с единичной конидией, микроскопирование нативной культуры (200 Х); В - препарат воздушного мицелия с осыпавшимися конидиями (400 Х); Г - гифа с конидиеносцем и несколькими конидиями, микроскопирование нативной культуры (200 Х); Д - гифа с несколькими конидиеносцами и не отделившимися конидиями, препарат субстратного мицелия (800 Х); Е - гифа с конидиеносцем и конидиогенным локусом, препарат субстратного мицелия (800 Х). 1 - гифа; 2 - группа конидий
В наших исследованиях было подтверждено, что на искусственной среде у парши яблони конидиогенез протекает так же, как и в естественных условиях при поражении листьев яблони: по бластическо-аннелидному типу. Нами было показано, что в условиях твердой питательной среды спороношение протекает как в воздушном, так и субстратном мицелии. Субстратное спороношение в чистой культуре на агаровых средах описано для некоторых фитопатогенных грибов, однако для V. inaequalis таких сообщений не отмечено [19, 20]. Нами были найдены морфологические отличия в конидиогенных структурах воздушного и субстратного мицелия. Так, если описание спороношения воздушного мицелия совпадает с классическим, то субстратное - имеет несколько отличных характеристик: расположение у конидиеносца (аннелида) множества упорядоченно ориентированных конидий и изогнутая форма аннелида. Эти отличия обусловлены физическими особенностями среды, в которой происходит процесс образования спор. При субстратном спороношении в твердой среде после каждого цикла спорообразования конидия не опадает, остается на месте, поддерживаемая плотной структурой агара. Новая образующаяся конидия встречает препятствие на своем пути в виде предыдущей споры, которая сформировалась и прекратила свой рост, поэтому ее движение внутри агара невозможно. Формирующийся конидиогенный локус проникая через агар отклоняется в сторону от предыдущей споры, что приводит к искривлению аннелида.
В настоящих исследованиях было показано субстратное спороношение лабораторной культуры V. inaequalis на твердой питательной среде. Конидиогенные структуры субстратного спороношения можно было наблюдать невооруженным глазом. У воздушного и субстратного спороношения имелись морфологические различия, выражавшиеся в форме конидиеносца и количестве конидий, располагающихся на нем. Был подтвержден бластическо-аннелидный тип конидиогенеза V. inaequalis в чистой культуре.
Литература
Парша яблоня патоген инокулюм
- 1. Насонов, А. И. Парша яблони: особенности возбудителя и патогенеза / А. И. Насонов, И. И. Супрун // Микология и фитопатология. - 2015. - Т. 49. - Вып. 5. - С. 275-285. 2. Якуба, Г. В. Экологизированная защита яблони от парши в условиях климатических изменений: монография / Г. В. Якуба. - Краснодар: ГНУ СКЗНИИСиВ, 2013. - 213 с. 3. Пидопличко, Н. М. Грибы-паразиты культурных растений. Определитель в 3-х томах / Н. М. Пидопличко. - Киев: Наукова Думка, 1977. - Т. 2 - 299 с. 4. Hammill, T. M. Fine structure of annellophores: IV. Spilocaea pomi / T. M. Hammill // Transactions of the British Mycological Society. - 1973. - Т. 60. - №. 1. - С. 65-68. 5. Corlett, M. The ultrastructure of the Spilocaea state of Venturia inaequalis in vivo / M. Corlett, J. Chong, E. G. Kokko // Canadian journal of microbiology. - 1976. - Т. 22. - №. 8. - С. 1144-1152. 6. Aderhold, R. Die Fusicladien unserer obstbaume / R. Aderhold // Landw. jahrb. - 1986. - V. 25. - P. 875-914. 7. Жданов, В. В. Селекция яблони на устойчивость к парше / В. В. Жданов, Е. Н. Седов. - Тула: Приок. кн. изд-во, 1991. - 208 с. 8. Keitt, G. W. Heterothallism and variability in Venturia Inaequalis / G. W. Keitt, D. H. Palmiter // American Journal of Botany. - 1938. - Vol. 25. - №. 5. - P. 338-345. 9. Keitt, G. W. Venturia Inaequalis (Cke.) Wint. I. A groundwork for genetic studies / G. W. Keitt, M. H. Langford // American Journal of Botany. - 1941. - Vol. 28. - № 9. - Р. 805-820. 10. Козловская, З. А. Внутривидовая неоднородность Ventruia inaequalis - возбудителя парши яблони / З. А. Козловская, Т. А. Гашенко // Вестник Белорусской государственной сельскохозяйственной академии. - 2009. - № 4. - С. 97-100. 11. Kirkham, D. S. Relationships between cultural characters and pathogenicity in Venturia inaequalis and Venturia pirina / D. S. Kirkham // Microbiology. - 1957. - V. 16. - № 2. - Р. 360 - 373. 12. Барсукова, О. Н. Парша яблони в европейской части СССР / О. Н. Барсукова // Микология и фитопатология. - 1983. - Т. 17. - Вып. 5. - С. 395-403. 13. Насонов, А. И. Оценка морфолого-культуральных особенностей аскоспоровых изолятов возбудителя парши яблони / А. И. Насонов // Научные труды Государственного научного учреждения Северо-Кавказского зонального научно-исследовательского института садоводства и виноградарства Российской академии наук. - Краснодар. ФГБНУ СКЗНИИСиВ, 2016. - Т. 9. - С. 187-192. 14. Насонов, А. И. Особенности генетического разнообразия Venturia inaequalis в садовых насаждениях Краснодарского края и республики Адыгея / А. И. Насонов, Г. В. Якуба // Научные труды Государственного научного учреждения Северо-Кавказского зонального научно-исследовательского института садоводства и виноградарства Российской академии наук. - Краснодар. ФГБНУ СКЗНИИСиВ, 2016. - Т. 9. - С. 180-186. 15. Wallace, E. Scab disease of apples / E. Wallace // Agr. Expt. Sta. Bull. N. Y. (Cornell University). - 1913. - Т. 335. - P. 545-642. 16. Насонов, А. И. Использование моноаскоспоровых изолятов в популяционных исследованиях Venturia inaequalis / А. И. Насонов, И. И. Супрун // Современные решения в развитии сельскохозяйственной науки и производства: Международный саммит молодых ученых: материалы конф. Краснодар, 26-30 июля 2016 г. - С. 124-128. 17. Насонов, А. И. Получение аскоспоровой культуры гриба Venturia inaequalis в лабораторных условиях / А. И. Насонов, Г. В. Якуба, И. И. Супрун // Микология и фитопатология. - 2016. - Т. 50. - № 2. - С. 131-132. 18. Kendrick B. The fifth kingdom / B. Kendrik. - Hackett Publishing, 2017, 502 р. 19. Куркина, Ю. Н. Проявление альтернариоза на кормовых бобах и белом люпине / Куркина Ю. Н. // Защита и карантин растений. - 2012. - № 6. - С. 43-45. 20. Ганнибал Ф. Б. Мелкоспоровые виды рода Alternaria на злаках / Ф. Б. Ганнибал // Микология и фитопатология. - 2004. - Т 38. - № 3. - С. 19-28.
Похожие статьи
-
Лен-долгунец - Linum usitatissimum (elongata) - однолетнее растение. Продуктивной его частью служит тонкий, прямой, светло-зеленый гладкий стебель,...
-
Специальное исследование, Результаты лабораторных исследований - Особенности биопсии печени
Исследование сердечно-сосудистой системы. Сердечный толчок боковой - толчкообразные сотрясения грудной клетки с обеих сторон. Изменений колебания грудной...
-
Ботаническая характеристика Чечевица (Ervum lens L. (Lens esculenta Moench) -- однолетнее, сравнительно низкорослое растение. Стебель тонкий,...
-
Систематическое положение возбудителя, морфологические признаки, специализация, степень паразитизма Царство Fungi, Отдел Ascomycota, Класс Ascomycetes,...
-
Пункт искусственного. о. делится на 2 отделения: лабораторию и манеж. Лабораторию устраивают в теплой, сухой, светлой и чистой комнате размером в 8-12...
-
Особенности взятия и пересылки патологического материала Материалом для прижизненной диагностики служат кровь и моча, для посмертной - трупы мелких...
-
Введение Внедрение экологически безопасных, адаптивных технологий, в том числе культивирование смешанных посевов различных культур и сортов, является...
-
По данным таблицы можно сказать что наивысший балл бонитета у дерново-бурых среднесуглинистых почв так как в ней больше всего содержится ЕКО, более...
-
Биологические особенности картофеля Картофель (Solanum tuberosum) - это однолетнее травянистое растение. вырастающее до 100 сантиметров в высоту и...
-
7. Химический состав и питательная ценность чечевицы Используемые части растения Содержание, % В 1 кг корма Вода протеин Жир Клетчатка БЭВ Зола К. ед...
-
Физиология адаптации и гомеостаз коров в условиях резко-континентального климата
Аннотация Анализ работы молочных комплексов Тюменской области, проведенный кафедрой акушерства и незаразных болезней сельскохозяйственных животных,...
-
Введение Нарушение круговорота питательных веществ в почве в результате сокращения внесения органических и минеральных удобрений, эрозионных процессов,...
-
Особенности посева (посадки) чечевицы на зерно в Радищевском районе Ульяновской области Сроки посева Способы посева, ширина междурядий, см Норма высева...
-
Лабораторная диагностика - Диагностика и лечение болезни Ауески у поросят
Основная схема лабораторной диагностики вирусных болезней включает: I .Вирусологический метод 1. Обнаружение вируса 1)микроскопией мазков (лучше...
-
Природные условия Аулиекольского района Скот коневодство овцеводство животноводство Аулиекольский (Семиозерный) район расположен в Юго-восточной части...
-
В Республике Беларусь возделываются две формы зерновых культур - озимые и яровые. Все они растения, высеваемые ежегодно, однолетники, со сплошным...
-
Экономика Зейского района представлена следующими отраслями материального производства: - транспорт (железнодорожный, авиационный, автомобильный); -...
-
Для характеристики морфологического строения дерново-слабоподзолистых почв, сформировавшихся на глубоких песках, приведены описания разрезов. Разрез № 30...
-
Природно-экономические условия области Вологодская область входит в состав Северо-Западного федерального округа. Область образована 23 сентября 1937 года...
-
Природопользование лесостепной земледельческий Тема о староосвоенных районах. Что это такое? Как ни странно в географических работах и работах по...
-
В настоящее время нужно осознать, что если раньше считалось, что мерилом экономики страны является сокращение средств производства вовлекаемых в эту...
-
Бабочки являются одними из самых красивых насекомых, отряд Lepidoptera включает в себя более 140 (по некоторым данным 150) тысяч видов. Тем не менее,...
-
Апшеронский район относится к шестой климатической провинции, которая охватывает все предгорные районы Краснодарского края. По температурному режиму...
-
У овец и коз кровь лимфоцитарная. Но у коз может быть нейтрофильной. Чрезвычайно большая сегментированность сегментоядерных клеток - 8-12 сегментов....
-
Место расположения лесничества. Лесорастительные условия Таблица 1. № Наименование участковых лесничеств Общая площадь, га 1. Лево-Убинсоке 98835 2....
-
Морфологическая характеристика культуры Горох принадлежит к однолетним растениям. Стебель травянистый, полый, полегающий. Высота его по сортам варьирует...
-
Прижизненная диагностика: Исследование проводят по методам последовательных промываний, методу Фюллеборна, культивирования личинок до инвазионной стадии...
-
Существует три технологии выращивания ремонтного молодняка мясных кур: на подстилке, на комбинированных полах (сочетание глубокой подстилки и сетчатого...
-
- эймериоз (катаральное воспаление, фибринозно - геморрагический энтероколит, язвы и узелки серо - белого цвета диаметром 1 - 2 мм) [4]. - мониезиоз...
-
Рубки ухода в молодняках (осветление и прочистка) назначены в соответствии приказом МПР. Р. Ф. №185 от 16 июня 2007г. "Об утверждении правил ухода за...
-
Для получения полноценных и дружных всходов нужно высевать семена с высокой всхожестью и энергией прорастания. Дружные всходы - гарантия качественного и...
-
Чтобы получить запланированный урожай дозы минеральных удобрений необходимо систематически совершенствовать и корректировать в зависимости от изменения...
-
Лен-долгунец относится к группе культур, достаточно требовательных к предшественникам. Требовательность льна заключается в необходимости проведения...
-
Программирование урожая с.-х. культур - разработка комплекса технологических приемов, обеспечивающего оптимизацию регулируемых факторов среды для...
-
Особенности пищеварительной системы самцов-производителей разных видов Пищеварительная система быков. Для физиологического обоснования рационального...
-
Молоко представляет идеальную питательную среду для микробов. При благоприятных условиях микробы в молоке быстро размножаются, вызывая его порчу. Очень...
-
Контакт Собаки, как и люди, обладают в разной степени контактностью и привязанностью. Эти качества вырабатываются в процессе воспитания, обучения и...
-
Требования к почвам и особенности севооборота - Кукуруза и ее возделывание
Под кукурузу отводят очень разные почвы: от тяжелых до легких, от бедных до богатых, от кислых (рН 5) до щелочных (рН 8). Однако наиболее высокие урожаи...
-
По исследованиям лечения бронхопневмонии телят антибиотиками фторхинолонового ряда Калюжным И. И. [15] были получены результаты о выздоровлении животных...
-
Клинические признаки Рисунок 2 - Показатели температуры телят контрольной группы. Рисунок 3 - Показатели температуры телят опытной группы. Температура...
Морфологические особенности конидиогенеза Venturia inaequalis (Cooke) Winter в лабораторных условиях