Механизм действия токсинов - Характеристика пестицидных белков Bacillus thuringiensis и их генетических детерминант
Клетками-мишенями для белков Cry-семейства (т. н. д-эндотоксинов) являются эпителиальные клетки средней кишки насекомых, а также некоторых других беспозвоночных. Белки Cyt-семейства, в отличие от Cry-токсинов, способны вызывать лизис многих типов клеток, что обусловлено их структурой, т. к. у них не найден специфический домен, ответственный за связывание со строго определенным типом рецепторов, а механизм их действия отличен от такового у Cry-токсинов (Schnepf et al., 1998). Кроме этого, в последние годы вызывают пристальное внимание ученых особые белки, относящиеся к Cyt-семейству, которые были названы параспоринами (параспорин-1 и параспорин-2). Для параспоринов характерно то, что они не являются инсектицидными белками, но обладают активностью в отношении клеток позвоночных животных, в частности, млекопитающих (Katayama et al., 2007), а также специфически распознают и уничтожают клетки раковых опухолей печени и толстой кишки человека и определенные типы нормальных клеток человека (Kitada et al., 2006).
Следует отметить, что термин "токсины" по отношению к пестицидным белкам, продуцируемым ВТ, употребляется в широком смысле, в т. ч. и для обозначения внутриклеточных параспоральных кристаллических включений. Это не совсем корректно, поскольку белки в составе кристаллических включений представляют собой протоксины, т. е. неактивную форму, из которой в кишечнике беспозвоночных путем ограниченного протеолиза образуется активный токсин.
В общем виде процесс действия д-эндотоксинов Cry-семейства на клетки кишечного эпителия насекомых, в соответствии с наиболее распространенной моделью, можно представить как последовательность следующих этапов (Schnepf et al., 1998; Pigott, Ellar, 2007; Soberon, Bravo, 2008):
- 1) Растворение кристаллических включений, содержащих молекулы протоксина, в кишечнике насекомых за счет особых условий в нем (определенный рН, присутствие кишечных ферментов). 2) Активация токсина: процесс превращения протоксина (неактивной формы) в токсин (активная форма) путем частичного протеолиза под воздействием протеаз кишечного сока насекомых. При этом отщепление полипептидных фрагментов, не входящих в состав зрелого токсина, может происходить для различных токсинов либо с N-, либо с С-конца молекулы протоксина (Лосева и др., 1996). 3) Связывание активного токсина с первым специфическим рецептором на мембране щеточной каемки кишечного эпителия (самый распространенный класс рецепторов - кадгериновые рецепторы). 4) Дальнейшее конформационное изменение молекулы токсина, индуцированное контактом с первым специфическим рецептором, приводит к отщеплению небольшого фрагмента с N-конца молекулы - б-спирали 1.Это отщепление делает открытыми гидрофобные области домена I, которые ранее были обращены вовнутрь и, таким образом, закрыты, а также инициирует формирование из четырех таких молекул токсина единой тетрамерной структуры. 5) Олигомерная структура (тетрамер), обладая повышенным сродством ко второму специфическому рецептору, аминопептидазе N (APN), эффективно связывается с ним. Аминопептидаза N способствует встраиванию олигомерной структуры в мембрану клетки, в результате чего формируется пора. 6) На последнем этапе протекают процессы, приводящие к гибели клетки: осмотический шок и лизис клеток вследствие свободного прохождения воды и растворенных веществ через поры, а также, в соответствии с другими моделями (Pigott, Ellar, 2007), в результате предшествующей инициации серии определенных внутриклеточных сигналов, приводящих к запуску процесса гибели клетки.
Описанная выше модель действия Cry-токсинов на клетки кишечного эпителия насекомых получила название модели Bravo (Pigott, Ellar, 2007), по фамилии ученого, ее предложившего и обосновавшего. Схема взаимодействия д-эндотоксина с клеткой-мишенью на примере белка Cry1A (Soberon, Bravo, 2008) в соответствии с этой моделью показана на рис.5.
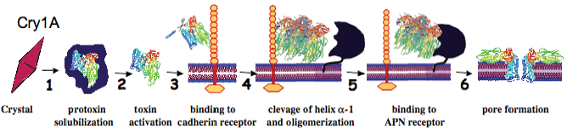
Рис.5. Схема действия д-эндотоксина на клетку-мишень на примере Cry1А токсина по модели Bravo (По Soberon, Bravo, 2008)
В соответствии с моделью Bravo при формировании в мембране одной клетки двухсот или даже менее таких литических пор, имеющих радиус 0,5-1нм, происходит очень быстрое изменение мембранного потенциала клетки, выравнивание концентрации ионов по обе стороны мембраны, приток воды в клетку, ее разбухание и, в итоге, лизис (Pigott, Ellar, 2007). Таким образом, собственно механизм цитоцидного действия д-эндотоксинов - осмотический лизис.
Интересно отметить, что на активность инсектицидных токсинов BT могут оказывать действие протеазы кишечника насекомых. При этом для различных токсинов их действие может быть различным, усиливающим или ингибирующим. В частности, для токсина Cry1Ab показано, что протеолитическое отщепление фрагментов мембранными протеазами снижает уровень его активности (Fortier et al., 2007). Еще один факт, заслуживающий внимания - это двухэтапный механизм взаимодействия молекул д-эндотоксинов в составе олигомера со вторичным рецептором - APN. Было установлено (Cooper et al., 1998), что первая стадия взаимодействия является быстрой и обратимой, может ингибироваться определенными сахарами и реагентами, используемыми для разрыва белок-белковых взаимодействий. Вторая стадия - медленная и необратимая, не ингибируется указанными веществами. В случае использования мутантного штамма BT, продуцирующего измененный Cry1Ac токсин, способный связываться с APN на первой, но не на второй стадии, было показано снижение его уровня активности по отношению к личинкам Manduca Sexta (Cooper et al., 1998). Это может дать представление об одном из возможных путей возникновения устойчивости насекомых к д-эндотоксинам.
Всего существуют три модели механизма цитоцидного действия д-эндотоксинов на клетки кишечного эпителия насекомых, которые являются не взаимоисключающими, а взаимодополняющими. Помимо вышеупомянутой модели Bravo существуют модели Zhang и Jurat-Fuentes (Pigott, Ellar, 2007).
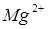
Согласно модели Zhang, токсичность Cry-протеинов определяется не только способностью вызывать осмотический лизис клетки. В этом случае мономерный Cry-токсин, связываясь с первичным рецептором, инициирует - зависимый каскадный сигнальный путь, который влечет за собой стимуляцию белка G, аденилатциклазы, повышает уровень цАМФ и активирует протеинкиназу А, что приводит к дестабилизации цитоскелета и ионных каналов и влечет за собой гибель клетки (Zhang et al., 2006).
Модель Jurat-Fuentes, по сути дела, объединяет в себе две вышеупомянутые модели, подразумевая, что цитотоксичность д-эндотоксинов зависит как от эффекта осмотического лизиса, так и от инициации специального внутриклеточного сигнального пути. Разница заключается лишь в том, что, в отличие от модели Zhang, автор полагает, что сигнальный путь регулируется фосфатазами, а также взаимодействием токсина с актином, входящим в состав цитоскелета и взаимодействующим с молекулой кадгерина. В отличие от модели Bravo, олигомерный токсин взаимодействует не только с APN, но и с другими определенными классами рецепторов (Pigott, Ellar, 2007).
Помимо рассмотренных механизмов действия д-эндотоксинов, заслуживают внимания данные о том, что д-эндотоксины BT способны в 2-5 раз снижать сопротивление искусственных фосфолипидных мембран, причем эта способность прямо пропорциональна концентрации токсина, а методами ИК - и ЯМР-спектроскопии обнаружено, что эндотоксин является потенциальным природным разобщителем-протонофором из-за наличия большого количества лабильных протонов (Каменек и др., 2008). Представляют также интерес сведения о системном эффекте д-эндотоксинов в гемоцеле насекомых: ряд Cry-токсинов способен при введении их в гемоцель вызывать быстрый паралич и смерть личинок насекомых, при более низких концентрациях приводит к различным нарушениям при окукливании, а при воздействии на культуру нервных клеток насекомых, полученную из клеток надглоточного ганглия, вызывать лизис и гибель нейронов (Cerstiaens et al., 2001). биопестицид трансгенный патоген токсин
Токсины семейств Vip и Cyt также разрушают клетки по механизму осмотического лизиса, формируя в мембране поры, хотя для некоторых Cyt-токсинов не доказано формирование пор в мембране при их взаимодействии с клеткой. Но сами способы связывания с мембраной и образования в ней каналов, приводящих к осмотическому лизису, отличаются от таковых для Cry-токсинов (Schnepf et al., 1998; Lee et al., 2003).
Уже упоминавшиеся параспорины, специфически воздействующие на раковые клетки и ряд типов нормальных клеток человека, обладают отличным от д-эндотоксинов механизмом действия. Так, действие на клетку
Параспорина-1 приводит к быстрому возрастанию внутриклеточной концентрации, что ведет к активации сигнального пути апоптоза, при этом была обнаружена активация G-белка и каспазы, специфического фермента апоптоза (Katayama et al., 2007). Параспорин-2 действует как цитолизин, обуславливая морфологические изменения всей клетки в целом и ее цитоскелета, фрагментацию митохондрий и эндоплазматического ретикулума, а также увеличение проницаемости клеточной мембраны с последующим выходом из клетки большинства цитоплазматических белков (Kitada et al., 2006).
Похожие статьи
-
Общая характеристика и структура токсинов Токсины, продуцируемые BT, представляют собой белки с молекулярной массой от 130 до 140 кДа либо около 70 кДа...
-
Bacillus thuringiensis (BТ) относится к грамположительным аэробным спорообразующим эубактериям палочковидной формы и принадлежит к сем. Bacillaceae . Это...
-
Введение - Характеристика пестицидных белков Bacillus thuringiensis и их генетических детерминант
Объектом данной курсовой работы является Bacillus thuringiensis , а предметом - использование данного вида эубактерий как продуцента хозяйственно...
-
Механизмы апоптоза - Радиационный апоптоз и некроз клеток облученного организма
Развитие и функционирование многоклеточных организмов подразумевает равновесие между синтезом и распадом молекул, их окислением и восстановлением,...
-
К чистым факторам переноса относят, например, факторы F и F-подобные (pAP22-4, pAP38, pAP39, pAP41) и pTRA1, фактор T, идентифицированный в E. coli,...
-
Острые и хронические повреждения нервной системы, в том числе, травмы, ишемические или воспалительные заболевания, остаются серьезной проблемой...
-
Органы-мишени и механизм действия инсулина - Биохимия поджелудочной железы
1. В крови инсулин может быть в двух формах: свободной и связной. Органы - мишени свободного инсулина: печень, скелетная мускулатура, кишечник; связного...
-
Благодаря постоянному и беспорядочному броуновскому движению молекул воды [4] две идентичные по всем параметрам биомолекулы (БМ) способны не только...
-
Химическая структура, Механизм действия - Местные анестетики
Местные анестетики состоят из липофильной (часто ароматическое кольцо) и гидрофильной частей (обычно вторичный или третичный амин), соединенных эфирной...
-
Механизмы действия гормонов на клетки - Гуморальная регуляция физиологических функций организма
Существуют 2 основных механизма действия гормонов на уровне клетки: реализация эффекта с наружной поверхности клеточной мембраны ("быстрые" эффекты) и...
-
Механизм действия гормонов. Роль циклазной системы в механизме действия гормонов - Понятие гормонов
По механизму действия гормоны делят на два основные типа. Первый - это белковые и пептидные гормоны, катехоламины и гормоноиды. Их молекула, подойдя к...
-
Молекулярные механизмы регуляции клеточной смерти - Биологические механизмы жизненного цикла клетки
Апоптоз - многоэтапный процесс. Первый этап - прием сигнала, предвестника гибели в виде информации, поступающей к клетке извне или возникающей в недрах...
-
Вода и растворенные в ней вещества, числе минеральные соли, создают внутреннюю среду организма, свойства к-й сохраняются постоянными или изменяются...
-
Этот оперон содержит гены, детерминирующие устойчивость к антибиотикам, а также в его состав может входить транспозон или его часть -...
-
Поражаемая система, Механизм действия - Токсикология мышьяка
Различают следующие типы отравлений мышьяком, которые могут явиться причиной летальных исходов: Паралитический, возникающий при огромных дозах мышьяка;...
-
Апоптоз - Характеристика основ иммунологии
Пролиферация клеток Количество клеток в ткани регулируется двумя процессами-- Пролиферацией Клеток и " Программированной, или физиологической, гибелью...
-
Механизмы повреждения клеток - Функциональная морфология клетки
Молекулярные механизмы повреждения клеток, приводящие к их смерти, очень сложны. Существуют четыре наиболее чувствительные внутриклеточные системы:...
-
Согласно одному из распостраненных определений, гестоз представляет собой синдром полиорганной недостаточности, возникающей при беременности, в основе...
-
Характеристика пептидной связи - Первичная структура белков
Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна....
-
Механизмы генетической инактивации - Эффект положения гена
Почему при перенесении гена в окружение гетерохроматина происходит компактизация участка хромосомы и как следствие инактивация гена? Наиболее разумными...
-
Плазматическая мембрана., Функции плазмалеммы. - Строение клетки. Биологические мембраны
Плазматическая мембрана занимает особое положение, так как ограничивает клетку снаружи и непосредственно связана с внеклеточной средой. Она имеет толщину...
-
Непременным компонентом вирусной частицы является какая-либо одна из двух нуклеиновых кислот, белок и зольные элементы. Эти три компонента являются...
-
Механизм дробления - Дробление, его характеристика у разных животных. Типы бластул
Клеточный цикл соматических клеток делится на четыре стадии (фазы). За митозом (М) следует пресинтетический период (G1), после которого происходит синтез...
-
В большинстве других случаев клеточной пролиферации в период между митозами происходит рост клеток. Клетка увеличивается в объеме почти вдвое и затем...
-
Свойство белков - Основы генетики
Белки - высокомолекулярные соединения, построенные из аминокислот и являются одними из наиболее сложных по строению и составу среди всех органических...
-
Антибиотики - вещества, избирательно угнетающие жизнедеятельность микроорганизмов, т. е. АБ активны только против микробов при сохранении...
-
Именно броуновское движение органических молекул в водной среде является причиной не только самоорганизации БС, но и их самовосстановления....
-
Характеристика и виды биологических мембран
Биологические мембраны - это поверхностные структуры клеток, состоящие из двух молекулярных слоев, разграничивающих наружную и внутреннюю (цитоплазма)...
-
Нейроглиальные взаимоотношения, Активность нейронов и глия - Нейроглия и нервная деятельность
Активность нейронов и глия В центральной нервной системе соотношение нейронов и глиальных клеток составляет 1 к 10, т. е. нейроны весьма плотно окружены...
-
Связь между строением вириона и началом инфекции - Строгие постулаты Коха
Длинные нити (фибриллы) отростка служат для специфического узнавания фагом определенных участков на поверхности клетки-хозяина, к которым он...
-
Введение - Характеристика, свойства, механизмы и возрастные особенности гомеостаза
Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Именно эта способность живых систем...
-
Чем занимаются немедленные ранние гены в клетке? - Технологии изучения клеточных механизмов памяти
Некоторые из них кодируют транскрипционные факторы для структурных генов, другими словами, регулируют уровни их экспрессии [3]. Это очень важная функция,...
-
Обмен белков - Питательные вещества
После расщепления белков в пищеварительном тракте образовавшиеся аминокислоты всасываются в кровь. В кровь всасывается также незначительное количество...
-
Ионизирующее излучение объединяет в себе радиоактивные излучения ( б, в, г - лучи), жесткое рентгеновское излучение, а также поток протонов и нейтронов....
-
Значение белков в питании - Белок в жизни живых организмов
Белок - необходимая составная часть продуктов питания. Проблема пищевого белка стоит очень остро. По данным Международной организации по продовольствию и...
-
Наиболее важной буферной системой плазмы является бикарбонатный буфер, состоящий из слабой угольной кислоты (рК1 6,1) и ее кислого аниона бикарбоната....
-
Сразу же отметим, что изменить положение своей БД для ответа на изменение внешней среды в водах с замедленным течением и тем более - в стоячих водах...
-
IS-последовательности включают в себя только гены транспозиции, в отличие от транспозонов не могут находиться в автономно состоянии. Механизмы фаговой...
-
Первичная структура - понятие, обозначающее последовательность аминокислотных остатков в белке Пептидная связь - основной вид связи, определяющий...
-
Настоящая работа посвящена изучению антигипоксического и нейропротекторного эффекта эндоканнабиноида N-арахидоноилдофамина при моделировании острой...
Механизм действия токсинов - Характеристика пестицидных белков Bacillus thuringiensis и их генетических детерминант