Механизмы апоптоза - Радиационный апоптоз и некроз клеток облученного организма
Развитие и функционирование многоклеточных организмов подразумевает равновесие между синтезом и распадом молекул, их окислением и восстановлением, пролиферацией и гибелью клеток (Д. М. Спитковский, 2002). Этот баланс может устанавливаться на различном уровне в зависимости от стадии развития организма, времени года и т. д. Поэтому апоптоз является частью природного механизма, обеспечивающего этот баланс, физиологическим процессом. Однако в том случае, когда этот процесс активируется под действием повреждающих факторов, апоптоз становится частью патологического процесса.
Индукция апоптоза характерна не только для действия ионизирующих излучений, но и для многих других патологических явлений в организме, включая канцерогенез. Как полагают, при этом происходит значительное нарушение баланса между скоростью деления и гибели клеток. В организме или культуре клеток стратегия апоптоза используется для элиминации клеток, несущих нерепарируруемые повреждения биологических мембран (например, путем супероксид-зависимого апоптоза), ДНК и, возможно, других макромолекул клетки.
С активацией процессов апоптоза связывают элиминацию апоптоз-чувствительных субпопуляций клеток в феномене повышения радиорезистентности клеточных популяций к действию ионизирующих излучений в высоких дозах. Так, у ракообразных, облученных в широком диапазоне доз, уровень апоптотической гибели клеток в популяции резко возрастал лишь в интервале от 0 до 0,5 Гр. При этом частота обнаружения клеток, гибнущих по этому механизму, после облучения в дозах от 0,5 до 5 Гр претерпевала лишь незначительные изменения. Такая гиперчувствительность части клеток при действии излучения в малых дозах рассматривается как защитная реакция для популяции клеток в целом, поскольку по механизму апоптоза элиминируются клетки, имеющие генетические повреждения. Хотя эти повреждения не всегда летальны для клетки, однако при делении последних мутации и другие геномные аномалии могут передаваться потомкам, нарушая постоянство генома, и поэтому "нежелательны".
Следует отметить интригующее воззрение о так называемом незавершенном апоптозе, т. е о том, что начальные стадии в ряде случаев обратимы, а образующиеся при этом клетки с дефектами в геноме могут быть родоначальниками новых клонов, в том числе трансформированных.
Генетически запрограммированный механизм апоптоза, удивительным образом сходный по большинству реакций у животных разных видов, реализуется в 3 стадии: индукции - инициирования (сигнальная), активации механизмов осуществления (контроля и исполнения) и деградации (структурных изменений).
Генетически обусловленный характер апоптоза проявляется не только в определенной последовательности его реакций, но в первую очередь в обязательности активации в клетке тех генов, которые контролируют синтез белков, необходимых для реализации апоптотической гибели. Впервые это было установлено в опытах на нематоде Caenorhabditis elegans американцем Хартвеллом с соавт., удостоенным в 2002 г. Нобелевской премии по физиологии и медицине за выдающийся вклад в изучение механизмов апоптоза. У данного червя программа включает активацию генов клеточной смерти (сell death) сed - 3, сed-4 и сеd-9, играющих центральную роль в механизме явления, что приводит к образованию белков СЕР-З и СЕР-4, необходимых для реализации эффекта, а также СЕР-9, защищающего клетки от гибели путем ингибирования СЕР-4, активирующего исполнительную функцию белка СЕР-З. У млекопитающих гомологом СЕD-З является каспаза 1 -- белок из семейства 11 цистеиновых протеиназ с аспартатной специфичностью. Термин каспаза составлен из букв названия протеаз -- Cysteine with Aspartate Specificity РгoteASEs, ранее называвшегося семейством ICE (interleukin-1в-converting еnzyme). Кандидатом на гомологию СЕD-4 у млекопитающих является белок семейства Араf-1 -- активирующего фактора 1 апоптотических протеаз. Белок bcl-2 (и члены образуемого им семейства антиапоптотических белков) является аналогом белка СЕD-9 в качестве негативного регулятора (ингибитора) каспазы-1.
Каспазы находятся в цитоплазме клетки в неактивном состоянии. После каскада активирующих модификаций под влиянием генных продуктов они переходят в ядро и атакуют в общей сложности около двух десятков структурных и функциональных белков, включая белки проведения сигналов и цитоскелетные. При этом в каждом белке расщепляется та химическая связь, которая находится сразу за аспартатом в специфичной для каждой каспазы аспартатсодержащей последовательности аминокислот. Большинство субстратов расщепляется каспазами-3 и -7, ламин избирательно каспазой-6. Чтобы произошла характерная для апоптоза межнуклеосомная фрагментация ДНК, необходима активация апоптоз-специфической эндонуклеазы. Она происходит путем расщепления каспазой цитоплазматического ингибитора этой эндонуклеазы (ингибитора каспазо-активируемой ДНКазы, фактора фрагментации ДНК).
Только после этого ДНКаза переходит в клеточное ядро и производит деградацию геномной ДНК. Активация каспаз осуществляется путем восприятия соответствующих сигналов, приходящих из внешней среды или из самой клетки. В результате, как уже отмечалось, возникает экспрессия определенных генов с образованием белковых продуктов с сигнальной функцией. Команды на апоптоз реализуются двумя путями -- внешним и внутренним: через так называемые поверхностные рецепторы смерти в клеточной мембране (death receptors, DR) или через митохондрии внутри клетки.
Первый путь начинается с рецепторов смерти, которых в настоящее время насчитывают пять: DR1 (Fas, или Аро1), DR2 (TNFR1 -- tumor necrosis factor гесеptог-1, или р55, или CD120a), DR3 (Аро3, или WSL-1, или ТRАМР, или LARD), DR4 и DR5(Аро2, или TRAIL-R2, или ТRICK 2, или KILLER). Среди них главными считаются Fas и TNFR1.
Рецептор клеточных мембран - это встроенная в мембраны белковая молекула, обычно состоящая из трех частей. Наружная, неклеточная часть молекулы способна узнавать (подобно узнаванию замком своего ключа) сигнальные молекулы, которые могут либо свободно плавать во внеклеточной жидкости, либо быть фиксированными на поверхности других клеток (например, лейкоцитов). При взаимодействии сигнальных молекул с наружной частью белка-рецептора, происходит изменение конформации рецептора - структурные изменения расположения одних атомов относительно других в макромолекуле рецептора, причем как в наружной его части, так и в средней (погруженной в мембрану) и внутриклеточной его частях. Внутриклеточная часть рецептора передает сигналы клеточным ферментам.
Таким образом, взаимодействуя с соответствующим генным продуктом -- своим специфическим лигандом, рецептор формирует последующий сигнал, активирующий каспазы. В итоге индуцируется каскад реакций апоптоза. Митохондриальный путь активации этого процесса осуществляется каспазой-3. Для своей реализации он требует, помимо АТФ или дАТФ, участия трех белков: зрелой гемсодержащей формы цитохрома с, Араf-1 (аналога СЕDЗ) и каспазы-9 (аналога СЕD4).
В норме цитохром содержится в митохондриальном межмембранном пространстве. Выход его в цитоплазму происходит вследствие повреждения митохондрий, приводит к активации каспазы-3 и запуску апоптоза.
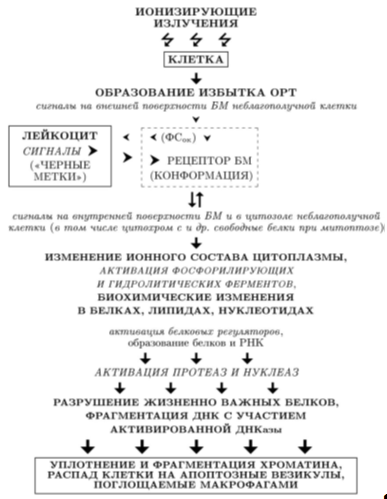
Существует и иной вариант митохондриального пути, когда в результате открытия пор проницаемости и утраты протонного и электрического градиента на внутренней митохондриальной мембране из митохондрий выходит белок, получивший название апоптоз-индуцирующего фактора (apoptosis-inducing factor, AIF), прямо активирующий каспазу-3. В отличие от некроза, уже незначительные нарушения окислительно-восстановительного равновесия в клетке могут послужить начальной стадией реализации многоплановой программы апоптоза. При этом к ее "запуску" в данной клетке могут быть причастны другие клетки. На рис. 5 представлена ориентировочная схема реализации апоптоза, вызванного образованием ОРТ в облученной клетке.
Рис.5 Схема модели апоптоза облученной клетки
Похожие статьи
-
Заключение - Радиационный апоптоз и некроз клеток облученного организма
Итак, апоптоз завершается потерей целостности, фрагментацией клетки. Хроматин - главный ядерный компонент, состоящий из ДНК и белков, уплотняется, а ядро...
-
Введение - Радиационный апоптоз и некроз клеток облученного организма
Еще в начале века были описаны различные реакции клеток на облучение - от временной задержки роста и размножения до полной деградации и лизиса. Выражение...
-
Молекулярные механизмы регуляции клеточной смерти - Биологические механизмы жизненного цикла клетки
Апоптоз - многоэтапный процесс. Первый этап - прием сигнала, предвестника гибели в виде информации, поступающей к клетке извне или возникающей в недрах...
-
Некротическая, беспрограммная форма гибели наиболее характерна для сильных воздействий, например, для облучения клеток и организма в высоких, летальных...
-
Апоптоз - Характеристика основ иммунологии
Пролиферация клеток Количество клеток в ткани регулируется двумя процессами-- Пролиферацией Клеток и " Программированной, или физиологической, гибелью...
-
Виды клеточной смерти - Биологические механизмы жизненного цикла клетки
Гибель (смерть) отдельных клеток или целых их групп постоянно встречается у многоклеточных организмов, также как гибель одноклеточных организмов. Причины...
-
Обмен белков в организме человека - Строение, функции и значение белков
Важный критерий пищевой ценности белков - доступность аминокислот. Аминокислоты большинства животных белков полностью высвобождаются в процессе...
-
Итак, материальная, физико-химическая сущность жизни проявляется, прежде всего, в непрерывном обмене веществ и энергии, который происходит между живой...
-
Размеры бактериальной клетки обычно составляют от 1 до 15 мкм. Форма клеток очень разнообразна: палочковидные (бациллы), сферические (кокки),...
-
Органы-мишени и механизм действия инсулина - Биохимия поджелудочной железы
1. В крови инсулин может быть в двух формах: свободной и связной. Органы - мишени свободного инсулина: печень, скелетная мускулатура, кишечник; связного...
-
Клетки и многоклеточный организм - Клеточная теория
Роль отдельных клеток во многоклеточном организме подвергалась неоднократному обсуждению и критике и претерпела наибольшие изменения. Т. Шванн...
-
Чем занимаются немедленные ранние гены в клетке? - Технологии изучения клеточных механизмов памяти
Некоторые из них кодируют транскрипционные факторы для структурных генов, другими словами, регулируют уровни их экспрессии [3]. Это очень важная функция,...
-
В настоящее время проблема адаптации спортсмена к физическим нагрузкам является одной из актуальных проблем. Проблематика заключается в раскрытии...
-
Жизненный цикл клетки - Биологические механизмы жизненного цикла клетки
Биологический клетка деление До сих пор много тайн клетки остаются неразгаданными. Загадочным во многом остается и запрограммированный генетически...
-
Особенности питания растущего организма - Возрастная биохимия
Обязательным условием нормального роста и развития организма, повышения уровня физической работоспособности, профилактики заболеваний является...
-
Фагоциты как центральное звено неспецифической защиты организма На современном этапе развития медицинской науки иммунофагоцитарная система...
-
Обмен белков - Роль белков в организме
Аминокислоты, образовавшиеся после расщепления белков в пищеварительном тракте, всасываются в кровь. В кровь всасывается также незначительное количество...
-
Механизм действия гормонов. Роль циклазной системы в механизме действия гормонов - Понятие гормонов
По механизму действия гормоны делят на два основные типа. Первый - это белковые и пептидные гормоны, катехоламины и гормоноиды. Их молекула, подойдя к...
-
Происхождение вирусов и происхождение клетки - Строгие постулаты Коха
Проблема происхождения вирусов - это, по существу проблема независимости генетических элементов в репродуктивном и эволюционном отношении. Основные...
-
Биохимические особенности стареющего организма, Основные механизмы старения - Возрастная биохимия
Основные механизмы старения Биология старения - раздел геронтологии, который изучает старение живых организмов на всех уровнях их организации....
-
Смерть как биологическое понятие является выражением необратимого прекращения жизнедеятельности организма [7]. В любом организме постоянно идет гибель...
-
Все нормальные процессы жизнедеятельности человека в какой-то данной среде имеют адаптивный характер. Иначе говоря, все физиологические реакции в...
-
Жизненный цикл клетки Жизненный цикл-- это время существования клетки от момента ее образования путем деления материнской клетки до собственного деления...
-
В многоклеточном организме все сложные проявления жизни возникают в результате координированной активности составляющих его клеток. Задача цитолога -...
-
Ауксины - Клетка как осмотическая система. Электрон-транспортная цепь митохондрий. Фитогормоны роста
Ауксины -- это вещества индольной природы. Основным фитогормоном типа ауксина является B -индолилуксусная кислота (ИУК). Открытие ауксинов связано с...
-
В большинстве других случаев клеточной пролиферации в период между митозами происходит рост клеток. Клетка увеличивается в объеме почти вдвое и затем...
-
Если возбуждение нейронов, активировавшихся при восприятии нами информации из внешней среды, поддерживается длительно, то сигнал доходит до их ядер и...
-
Строение растительной клетки - Производство биоферментных препаратов
Биотехнологический хемостат вакцина антибиотик Растительная клетка состоит из более или менее жесткой клеточной оболочки и протопласта. Клеточная...
-
Особенности метаболизма растущего организма - Возрастная биохимия
Основной биологической особенностью растущего организма является высокая интенсивность обмена веществ. На биологическом уровне это проявляется в высоких...
-
Метод микрофигурии - Методы изучения клетки
С помощью микроманипулятора отдельные части клетки можно удалять, добавлять или каким-то образом видоизменять. Крупную клетку амебы удается разделить на...
-
Введение, Белки - Анализ пищевых веществ, необходимых для организма человека
Организм человека состоит из белков (19,6 %), жиров (14,7 %), углеводов (1 %), минеральных веществ (4,9 %), воды (58,8 %), Он постоянно расходует эти...
-
Строение клетки - Химический состав клетки
1. Типы клеточной организации. Среди всего многообразия ныне существующих на Земле организмов выделяют две группы: вирусы и фаги, не имеющие клеточного...
-
Действие на организм и токсичность - Метаболизм этилового спирта в организме
Этиловый спирт может поступать в организм несколькими путями: при приеме внутрь, при внутривенном введении, а также через легкие в виде паров с вдыхаемым...
-
ВКЛЮЧЕНИЯ РАСТИТЕЛЬНОЙ КЛЕТКИ. ВАКУОЛЬ И КЛЕТОЧНЫЙ СОК - Самостоятельные работы по ботанике. 1 курс
Понятие о вакуоли, функции и возникновения вакуолей. Вакуоли отделены от цитоплазмы тонопластом. Жидкость, заполняющая вакуоль представляет собой...
-
Транспорт питательных веществ в бактериальную клетку - Физиология микроорганизмов
Пассивный - облегченная диффузия, в следствии разности концентрации питательных веществ, без затрата энергии. Отвечает за транспорт цитоплазматическая...
-
Вирус белок генетический фаг Основные проблемы и явления Бактериофаги являются паразитами представителей почти всех групп прокариотических организмов от...
-
Адаптационные изменения в сердечно-сосудистой системе. Сердце, адаптированное к физической нагрузке, обладает высокой сократительной способностью. Но оно...
-
Благодаря постоянному и беспорядочному броуновскому движению молекул воды [4] две идентичные по всем параметрам биомолекулы (БМ) способны не только...
-
Библиография - Биологические механизмы жизненного цикла клетки
1. Анатомия и физиология человека: учебник для 9 кл. шк. с углубл. изучением биологии / М. Р. Сапин, З. Г. Брыксина - М.: Просвещение, 1998. - 256 с.,...
-
Нейроглиальные взаимоотношения, Активность нейронов и глия - Нейроглия и нервная деятельность
Активность нейронов и глия В центральной нервной системе соотношение нейронов и глиальных клеток составляет 1 к 10, т. е. нейроны весьма плотно окружены...
Механизмы апоптоза - Радиационный апоптоз и некроз клеток облученного организма